
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние концентрации реагирующих веществ.Содержание книги
Поиск на нашем сайте
Пусть молекула вещества А реагирует с молекулой вещества В с образованием продукта реакции АВ в газовой смеси. А+В=АВ Для получения АВ из А и В необходимо, чтобы молекулы А и В прореагировали, т.е. столкнулись между собой. Без соударения вещества А В не получится. Скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, возведенных в степень их стехиометрических коэффициентов – это закон действующих масс. Математический закон выражается так: аА+вВ=сС
а и в – стехиометрические коэффициенты. В случае гетерогенных реакций в уравнение закона действующих масс входят концентрации только жидких и газообразных веществ. Концентрация твердого вещества величина постоянная, поэтому не входит в константу скорости К. Например, для реакции горения угля: С(тв.)+О2=СО2(газ)
Влияние температуры на скорость реакции. Зависимость скорости реакции от температуры выражается правилом Вант - Гоффа: при увеличении температуры на каждые 10°С скорости реакции возрастает в 2-4 раза.
Где Примеры решения задач. Пример 1: Как изменится скорость реакции протекающей в закрытом сосуде, если увеличить давление в 4 раза? 2NO(г.)+О2(г.)=2NO2 Решение: увеличить давление в 4 раза означает увеличить и концентрацию газов во столько же раз. 1. Определяем скорость реакции до повышения давления. V1 =K*C2NO*CO2 2. Определяем скорость реакции после повышения давления. V2=K*(4CNO)2*(4CO2)=64K*C2NO*CO2 3. Определяем, во сколько раз возросла скорость реакции V1/V2=64*K*C2NO*CO2 / K*C2NO*CO2 Ответ: скорость реакции возросла в 64 раза. Пример 2: Во сколько раз возрастёт скорость реакции при повышении температуры с 20 С˚ до 50 С˚? Температурный коэффициент равен 3. Решение: По правилу Вант – Гоффа:
По условию требуется определить
Ответ: скорость реакции возросла в 27 раз. ОБЪЕКТ ИССЛЕДОВАНИЯ. Зависимость скорости химической реакции от концентрации реагирующих веществ должна быть показана на основании измерения времени от момента сливания растворов до начала реакции, определяемой по помутнению раствора, обусловленному выделением свободной серы. КОНТРОЛЬНЫЕ ВОПРОСЫ. 1.Что называется скоростью химической реакции? 2. Какова зависимость скорости реакции от концентрации реагирующих веществ? 3. Как называется величина К? Каков её физический смысл? 4. Зависит ли коэффициент К от изменения температуры? 5. Как влияет температура на скорость химической реакции? 6. Как влияет давление на скорость химической реакции между газообразными веществами?
|
||||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 437; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.36.36 (0.005 с.) |


 – коэффициент пропорциональности, константа скорости реакции. Коэффициент
– коэффициент пропорциональности, константа скорости реакции. Коэффициент 

 и
и  - скорости при температуре Т1 и Т2. γ - температурный коэффициент.
- скорости при температуре Т1 и Т2. γ - температурный коэффициент.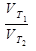 . Подставим данные в формулу:
. Подставим данные в формулу:



