
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Катодные процессы в водных растворахСодержание книги
Поиск на нашем сайте
Характер реакций, протекающих на аноде, зависит от природы аниона и материала анода. Аноды подразделяются на нерастворимые и растворимые. Нерастворимые аноды изготавливаются из угля, графита, платины, иридия, при электролизе они служат лишь передатчиками электронов. Анионы бескислородных кислот (S2-, I-, Вг-, Сl-) при их достаточной концентрации окисляются довольно долго: 2 Сl--2е→С12 2Вг--2е→Вг2 Если же раствор содержит анионы кислородных кислот (например, SO42-,NO3-, СО22-, РО43-), то на аноде окисляются не эти ионы, а молекулы воды: 2Н2О-4е→О2 + 4Н+ Если растворимые аноды изготавливаются из меди, серебра, цинка, кадмия, никеля, железа (в определенных условиях нерастворимыми становятся и аноды из железа, никеля, свинца), при электролизе они окисляются сами. Me - ne→ Me n+ Рассмотренные правила сведены в таблицу 2: Таблица 2. Анодные процессы в водных растворах
Решение типовых задач Задача 1. Написать уравнение электролиза раствора KCl, если анод нерастворимый.
Катод (-) Анод (+) 2H2O+2e↔ H2↑+2OH 2Cl-2e↔Cl2 Суммарное ионное уравнение: 2Н2О + 2С1 → Н2↑ + С12↑ + 2ОН- Суммарное молекулярное уравнение: 2КС1 + 2Н2О→ 2Н2↑ + С2↑+ 2КОН Вторичный продукт электролиза Задача 2. Написать уравнение реакции электролиза водного раствора AgNO3, если а) анод нерастворимый; б) анод растворимый, серебряный. Решение: а) анод нерастворимый AgNO3↔ Ag + + NO3- катод(-)…………………………………….анод(+)
Суммарное уравнение процессов: 4AgNO3 + 2H2O→4Ag + О2+4 HNO 3 Вторичный продукт электролиза б) анод растворимый, серебряный
Суммарное уравнение электролиза с растворимым анодом написать нельзя. Расчет количества веществ, разложенных или образовавшихся в процессе электролиза, производится по закону Фарадея. Теоретически массы веществ, испытавших изменение при электролизе, определяются
Q – количество прошедшего электричества m – масса вещества, г.
J – сила тока, А
Пример: Сколько меди выделяется при пропускании через раствор ее соли тока силой 6А, в течение 1 часа, если выход по току составляет 98%? m(Си)факт = m(Си)теор*0,98 = Следовательно, на катоде выделится 7 грамм меди. ОБЪЕКТ ИССЛЕДОВАНИЯ. Лабораторная установка для проведения процесса электролиза с растворимым медным анодом. КОНТРОЛЬНЫЕ ВОПРОСЫ. 1. В каких случаях образуются вторичные продукты при электролизе? 2. В какой последовательности и выделяются на катоде металлы при электролизе раствора, содержащего ионы Ni2+, Cr2+,Fe3+? 3. Какой силы должен быть ток, чтобы при пропускании его через расплав MgSO4 выделить на катоде 6 г. магния за 10 часов? Написать уравнения электродных процессов. 4. Через последовательно соединенные электролитические ванны с платиновыми электродами пропустили ток. В первой ванне раствор сульфата натрия, во второй-раствор нитрата серебра, а в третьей - раствор соляной кислоты. Какие продукты выделились на электродах во всех трех ваннах и сколько их получилось по массе, если в первой ванне выделится на катоде 1 мг. водорода? 5. Через водный раствор NaCl (электроды угольные) пропускали ток сначала при перемешивании раствора, а затем без перемешивания, отделив в последнем вторичные продукты. Написать уравнения электродных процессов для двух случаев.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 593; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |


 J-, Br-, S2-, Сl-, ОН-, SO42-, NO3-, F-
J-, Br-, S2-, Сl-, ОН-, SO42-, NO3-, F-
 Решение: KCl↔K+ +Cl-
Решение: KCl↔K+ +Cl- Ag++1e→Ag0 2H2O-4e→O2+4H+
Ag++1e→Ag0 2H2O-4e→O2+4H+ катод(-) анод(+)
катод(-) анод(+) Ag++1e→Ag Ag0-1e→Ag+
Ag++1e→Ag Ag0-1e→Ag+

 - химический эквивалент вещества, г.
- химический эквивалент вещества, г.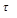 - время электролиза, сек.
- время электролиза, сек.


