
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Периодическая система химических элементовСодержание книги
Поиск на нашем сайте
ПЕРИП 41. Приведите полные и сокращенные электронные формулы двух элементов из разных электронных семейств с формулой высшего оксида ЭО3. укажите низшие степени окисления этих элементов.
42. На основании строения атомов лития и бериллия поясните, почему первый потенциал ионизации у лития меньше, чем у бериллия, а второй потенциал ионизации лития больше, чем у бериллия?
43. В ряду оксидов P2O5, SO3, B2O3, Al2O3, MgO, Na2O, Jn2O3, Tl2O3 установите, используя разные оксиды, два закономерных перехода: основной → амфотерный → кислотный. 44. Исходя из положения галогенов в периодической системе, поясните, как изменяются восстановительные свойства в ряду HCl – HBr – HJ. Почему HF входит в исключение? 45. Составьте формулы оксидов и гидроксидов марганца. Как изменяется кислотно-основной и окислительно-восстановительный характер этих соединений? Подчиняются ли эти соединения общей закономерности изменения свойств оксидов и гидроксидов? 46. Приведите современную формулировку периодического закона. Объясните, почему в периодической системе элементов аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, йодом и протактинием, хотя имеют бóльшую атомную массу. Как называются пары таких элементов?
47. Исходя из положения технеция, селена, цезия в периодической системе, составьте формулы следующих соединений: технециевой кислоты, оксида селена, гидрокарбоната цезия, отвечающих их высшей степени окисления. Изобразите структурные формулы соединений.
48. Исходя из строения атомов элементов, определите, какое основание более сильное: а) Sr(OH)2 или Fe(OH)2; б) Cu(OH)2 или KOH; какая кислота более сильная: а) H3AsO4 или H2SeO4; б) HClO4 или HMnO4.
49. Из оксидов As2O3, P2O5, GeO2, SO3, Al2O3, V2O5 выберите два оксида с наиболее выраженными кислотными свойствами. Укажите валентные электроны выбранных элементов.
50. Из оксидов BaO, K2O, TiO2, CaO, Al2O3, MgO, ZnO выберите два оксида с наиболее выраженными основными свойствами. Укажите валентные электроны выбранных элементов.
51. Какую высшую и низшую степени окисления проявляют молибден, йод и цирконий? Почему? Составьте формулы соединений, отвечающих этим степеням окисления и изобразите их структурные формулы.
52. Исходя из положения хрома, селена, углерода и серы в периодической системе, определите, какая из кислот является более сильным окислителем: а) H2CrO4 или H2SeO4, б) H2CO3 или H2SO3. 53. Какую высшую и низшую степени окисления проявляют вольфрам, теллур, серебро в соединениях? Почему? Составьте формулы соединений, отвечающих этим степеням окисления и изобразите их структурные формулы. 54. Исходя из положения металлов в периодической системе, определите, какой из двух гидроксидов является более сильным основанием: а) KOH или Mn(OH)2; б) Zn(OH)2 или Сa(OH)2; в) Mg(OH)2 или Be(OH)2. 55. Какие элементы принадлежат к f –электронному семейству? На примерах строения атомов двух любых лантаноидов (или актиноидов) докажите, что химические свойства в группах лантаноидов (или актиноидов) близки друг к другу.
56. Составьте формулы оксидов и гидроксидов ванадия. Как изменяется кислотно-основной и окислительно-восстановительный характер этих соединений? 57. Составьте два ряда из элементов Ca, Mn, C, Si, Zn, Br, Sn, Ge в порядке уменьшения ЭО в периоде и группе. 58. Как изменяется прочность связи между атомами в молекулах галогенов Cl2 – Br2 – J2? Почему молекула F2 выпадает из общей закономерности?
59. Исходя из положения серы, фосфора и хлора в периодической системе, определите, как изменяются окислительные свойства кислот: H2SO4, H3PO4, HClO4? 60. Даны пары элементов: а) C и N; б) N и P; в) P и F; г) S и CL. Укажите пару элементов, которые образуют соединения состава Ca3Э2.
ХИМИЧЕСКАЯ СВЯЗЬ
61. Какая химическая связь называется водородной? Приведите три примера соединений с водородной связью. Изобразите структурные схемы приведенных ассоциатов. Как влияет образование водородной связи на свойства веществ (вязкость, температуры кипения и плавления, теплоты плавления и парообразования? 62. Какая связь называется s- и какая - p-связью? Какая из них менее прочная? Изобразите структурные формулы этана C2H6, этилена C2H4 и ацетилена C2H2. Отметьте s- и p-связи на структурных схемах углеводородов. 63. В молекулах F2, O2, H2SO4, HCl, CO2 укажите тип связей, число s- и p-связей. 64. Какие силы межмолекулярного взаимодействия называются диполь-дипольными (ориентационными), индукционными и дисперсионными? Объясните природу этих сил. Какова природа преобладающих сил межмолекулярного взаимодействия в каждом из следующих веществ: H2O, HBr, Ar, N2, NH3?
65. Приведите две схемы заполнения МО при образовании донорно-акцепторной связи в системах с атомными заселениями: а) электронная пара – свободная орбиталь (2+0) и б) электронная пара – электрон (2+1). Определите порядок связи, сравните энергии связей. Какая из рассмотренных связей участвует в образовании иона аммония [NH4]+?
66. На основании строения атомов в нормальном и возбужденном состояниях определите ковалетность бериллия и углерода в молекулах BeCl2, (BeCl2)n, CO и CO2. Изобразите структурные формулы молекул. 67. На основании положений зонной теории кристаллов охарактеризуйте металлы, проводники и диэлектрики. От чего зависит ширина запрещенной зоны? Какие примеси нужно добавить к кремнию, чтобы превратить его в: а) n-полупроводник; б) р-полупроводник? 68. Приведите электронную конфигурацию молекулы NO по методу МО. Как изменяются магнитные свойства и прочность связи при переходе от молекулы NO к молекулярному иону NO+? 69. Какая химическая связь называется ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите примеры молекул с типично ионными связями и укажите тип кристаллической решетки. Составьте изоэлектронный ряд ксенона.
70. На основании строения атомов в нормальном и возбужденном состояниях определите ковалентность лития и бора в соединениях: Li2Cl2, LiF, [BF4]-, BF3.
71. Какая химическая связь называется координационной или донорно-акцепторной? Разберите строение комплекса [Zn(NH3)4]2+. Укажите донор и акцептор. Как метод валентных связей (ВС) объясняет тетраэдрическое строение этого иона? 72. Почему существует молекула PCl5, но не существует молекула NCl5, хотя азот и фосфор находятся в одной и той же подгруппе VA периодической системы? Какой тип связи между атомами фосфора и хлора? Укажите тип гибридизации атома фосфора в молекуле PCl5. 73 Охарактеризуйте типы кристаллических структур по природе частиц узлов решеток. Какие кристаллические структуры имеют: CO2, CH3COOH, алмаз, графит, NaCl, Zn? Расположите их по порядку возрастания энергий кристаллических решеток. Что такое интеркалирование? 74. Приведите четыре примера молекул и ионов с делокализованными связями. Изобразите их структурные формулы. 75. Какой тип гибридизации в молекулах CCl4, H2O, NH3? Изобразите в виде схем взаимное расположение гибридных облаков и укажите углы между ними. 76. Приведите две схемы заполнения МО при взаимодействии двух АО с заселениями: а) электрон + электрон (1+1) и б) электрон + вакантная орбиталь (1+0). Определите ковалентность каждого атома и порядок связи. В каких пределах энергия связи? Какие из указанных связей в молекуле водорода H2 и молекулярном ионе 77. Приведите электронную конфигурацию молекулы азота по методу МО. Докажите, почему молекула азота обладает большой энергией диссоциации. 78. Что такое дипольный момент? Как он изменяется в ряду сходно построенных молекул: HCl, HBr, HJ? Какой тип связи осуществляется между атомами водорода, хлора, брома и йода в приведенных молекулах? s- или p-связи в этих молекулах? 79. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа ABn, если связь в них образуется за счет sp-, sp2-, sp3- гибридизации орбиталей атома A? Приведите примеры молекул с указанными типами гибридизации. Укажите углы между связями. 80. Даны пары веществ: а) H2O и CО; б) Вr2 и CH4; в) CаО и N2; г) H2 и NH3. Для какой пары веществ характерна ковалентная неполярная связь? Изобразите структурные схемы выбранных молекул, укажите формы этих молекул и углы между связями.
ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
81. На восстановление 14 г диоксида кремния SiO2 (к) углеродом, в результате которого образуются кремний и оксид углерода СО(г), требуется 148,7 кДж теплоты. Рассчитайте тепловой эффект реакции и напишите термохимическое уравнение. Вычислите теплоту образования SiO2.
82. Вычислите тепловой эффект реакции восстановления Fe2O3 металлическим алюминием. Напишите термохимическое уравнение. Сколько выделяется тепла, если в реакцию вступают 8 молей Fe2O3 и сколько молей железа образуется при этом? 83. Определите тепловой эффект сгорания жидкого сероуглерода CS2(ж) до образования газообразных СО2 и SO2. Сколько молей CS2 вступят в реакцию, если выделится 700 кДж тепла? 84. Рассчитайте энтальпию образования жидкого сероуглерода CS2 по следующим данным: Sмонокл. + О2(г) = SО2(г); DН = -296,9 кДж; СS2(ж) + 3О2(г) = СО2(г) + 2SО2(г); DН = -1076,43 кДж; С(граф.) + О2(г) = СО2(г); DН = -393,5 кДж. 85. Определите тепловой эффект сгорания природного газа, протекающего по уравнению: СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г),
Сколько тепла выделится при сгорании 1 м3 газа? Расчет проведите с допущением, что стандартные условия течения реакции совпадают с нормальными условиями. 86. Вычислитетепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
FeO (к) + CO (г) = Fe (к) + CО2 (г); DH = -18,20 кДж; СO (г) + 1/2O2 (г) = СO2 (г) DН = -283,0 кДж; H2 (г) + ½ O2 (г) = H2O (г) DН = -241,83 кДж.
87. Растворение моля безводной соды Na2CO3 в достаточно большом количестве воды сопровождается выделением 25,10 кДж теплоты, тогда как при растворении кристаллогидрата Na2CO3×10Н2О поглощается 66,94 кДж теплоты. Составьте термохимические уравнения процессов гидратации и растворения гидратированной соли. Вычислите теплоту гидратации Na2CO3.
88. Реакция горения бензола выражается термохимическим уравнением:
С6Н6(ж) + 7½ О2(г) = 6СО2(г) + 3Н2О(г) – 3135,6 кДж.
Вычислите теплоту образования жидкого бензола. Определите теплотворную способность жидкого бензола при условии, что стандартные условия совпадают с нормальными. 89. Рассчитайте, сколько тепла выделится при гашении 50 кг 80%-ной негашеной извести, если теплота гашения на 1 моль СаО составляет - 65 кДж/моль. Определите теплоту образования гашеной извести. 90. Реакция окисления этилового спирта выражается уравнением:
С2Н5ОН(ж) + 3,0 О2(г) = 2СО2(г) + 3Н2О(ж).
Определить теплоту образования С2Н5ОН(ж) , зная DН х.р. = - 1366,87 кДж. Напишите термохимическое уравнение. Определите мольную теплоту парообразования С2Н5ОН(ж) ® С2Н5ОН(г), если известна теплота образования С2Н5ОН(г), равная –235,31 кДж · моль-1. 91. Используя энтальпии образования веществ, определите DН0 химической реакции:
2Mg(к) + СО2(г) = 2MgО(к) + Сграфит.
Сколько образуется графита, если в реакцию вступит 100 г Mg и сколько выделится тепла при этом? 92. Вычислите тепловой эффект реакции горения толуола С7Н8(ж):
С7Н8(ж) + 9О2(г) = 7 СО2(г) + 4Н2О(г)
Напишите термохимическое уравнение. Сколько тепла выделится при сгорании 200 г толуола? 93. Вычислите теплоту образования карбида кальция СаС2, исходя из теплового эффекта реакции: СаО(т) + 3С(т) = СаС2(т) + СО(г) +462,2кДж
и стандартных энтальпий образования СаО и СО. Сколько нужно затратить тепла для получения 100 кг СаС2(т)? 94. При получении одного грамм-эквивалента гидроксида кальция из CaO(к) и Н2О(ж) выделяется 32,75 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция. 95. Реакция горения аммиака выражается термохимическим уравнением:
4NH3(г) + 3О2(г) = 2N2(г) + 6H2О(ж); DН = -1530,0 кДж.
Вычислите теплоту образования аммиака NH3(г).Сколько тепла выделяется при сгорании 10 молей NH3(г)? 96. Тепловой эффект реакции восстановления оксида вольфрама WO3(к) водородом, приводящий к образованию вольфрама и паров воды, равен +117,2 кДж. Вычислите теплоту образования оксида вольфрама. Сколько нужно затратить тепла для получения 500 г вольфрама?
97. Определите тепловой эффект химической реакции:
Al2O3 (к) + SO3 (г) = Al2 (SO4)3 (к) ,
ная при стандартных условиях теплоты образования Al2O3 (к), SO3 (г) и Al2(SO4)3 (к) соответственно, кДж·моль-1: -1676,0; -395,8 и -3441,2. Сколько тепла выделится, если в реакции участвует 0,25 моль Al2O3 (к)? 98. Реакция горения аммиака выражается уравнением:
4 NН3 (г) + 5О2(г) = 4 NО (г) + 6Н2О(г).
Вычислите тепловой эффект реакции в пересчете на 1 моль NН3 (г). Напишите термохимическое уравнение горения аммиака. 99. Вычислите тепловой эффект реакции спиртового брожения глюкозы (под действием ферментов), если известны теплоты образования C6H12O6 (к), C2H5OH (ж) соответственно, кДж /моль: - 1273,0; -277,6:
С6Н12О6(к) = 2 С2Н5ОН(ж) + 2СО2(г)
Напишите термохимическое уравнение. Сколько выделится тепла при брожении 1кг глюкозы? 100. Определите тепловой эффект реакции разложения 1 моля бертолетовой соли КСlО3(к), протекающей по уравнению:
2КСlО3(к) = 2КСl(к) + 3О2(г).
Напишите термохимическое уравнение. Определите, сколько тепла выделится при разложении 100 г бертолетовой соли. Какая из солей KCl или KClO3 более термически стойкая? ХИМИЧЕСКОЕ СРОДСТВО 101. Рассчитав на основании табличных данных DG и DS, определите тепловой эффект реакции: 2 NO (г) + Cl2 (г) ↔ 2 NOCl (г).
Экзотермической или эндотермической является данная реакция?
102. Вычислите изменение энергии Гиббса при 250С для реакции:
2 Н2O (г) + 2 I2(г) ↔ 4 HI (г) + O2 (г)
по стандартным значениям энтальпий образования и абсолютных энтропий химических веществ. Можно ли назвать этот процесс самопроизвольным? Изменится ли направление процесса при повышении температуры до 4000С? Укажите роль энтальпийного и энтропийного факторов. 103. Чем можно объяснить, что при стандартных условиях, невозможна экзотермическая реакция: СО2 (г)+Н2 (г) ↔ СО (г)+Н2О (ж)?
Рассчитайте DG данной реакции. При каких температурах данная реакция становится самопроизвольной?
104. Не производя вычислений, установить знак D S следующих процессов:
а) NН3(г) + НI(г) = NН4I(к); б) HNO3(р-р) ® Н+(р-р) + NO3-(р-р); в) плавление льда; г) ВаО(к) + СО2(г) = ВаСО3(к).
Ответ поясните. 105. Рассчитайте DG0 реакции:
СН4 (г) +2Н2S(г) → CS2(ж)+ 4H2(г)
и сделайте вывод о возможности самопроизвольного протекания данного процесса. Не производя вычислений укажите, каково будет изменение энтропии.
106. Прямая или обратная реакция будет протекать в системе:
4NH3(г) +5O2(г) = 4NО(г) + 6Н2О(ж)?
Ответ мотивируйте, вычислив DG0 прямой реакции по стандартным энтальпиям образования и абсолютным энтропиям химических веществ. Изменится ли направление процесса при повышении температуры до 15000 С?
107. При какой температуре наступит равновесие системы:
СО2 (г) + 4 Н2(г) ↔ СH4 (г) + 2 Н2О (ж)?
При каких температурах реакция будет протекать в прямом, а при каких – в обратном направлении?
108. Не прибегая к вычислениям, определите, какие знаки (>0, <0, @0) имеют DG, DH и DS для протекающей в прямом направлении реакции:
4 НBr (г) + O2(г) ↔ 2 H2O (г) + 2 Br2 (г)
Как повлияет повышение температуры на направленность химической реакции?
109. Какой из сульфатов: Na2SО4, или FeSО4 можно получить по реакции взаимодействия соответствующих оксидов с SО3? Какая реакция идет более энергично? Ответ дайте, вычислив DG реакций.
110. При какой температуре наступит равновесие системы:
4 Н2S (г) + I2(г) ↔ 2 HI (г) + S (т)?
При каких температурах более сильным окислителем будет являться иод, а при каких – сера? 111. Пользуясь справочными данными, определите, возможно ли при стандартных условиях получение по схеме: 2Al2O3(к) +3C(к) = 4Al(к) + 3CО2(г).
Как будет влиять повышение температуры до 2500оС на направление реакции?
112. На основании расчета значений DG0 реакций:
Н2 (г) + Br2 (г) ↔ 2 НBr (г) и Н2 (г) + Cl2 (г) ↔ 2 HCl (г)
определите, бром или хлор является более сильным окислителем при стандартных условиях и при температуре 600оС. 113. С чем будет более интенсивно взаимодействовать газообразный хлористый водород (в расчете на 1 моль): с алюминием или с оловом? Ответ дайте, рассчитав DG0 обеих реакций. Продуктами реакций являются твердая соль и газообразный водород. Ответ: - 325,88 и -266,28 кДж/моль. 114. На основании расчета значений DG0 реакций:
4 P (к) + 3 О2 (г) ↔ 2 P2O3 (к) и 4 P (к) + 5 О2 (г) ↔ 2 P2O5 (к)
определите, какой из оксидов будет преимущественно образовываться при стандартных условиях и при 700оС?
115. Рассчитайте DG0 реакции:
NH4NO3(к) = N2О (г) + 2 H2O(г)
и сделайте вывод о возможности самопроизвольного протекания данного процесса при стандартных условиях. Не производя вычислений, укажите, каково будет изменение энтропии, а также экзо- или эндотермической является данная реакция.
116. Прямая или обратная реакция будет протекать в системе:
Ответ мотивируйте, вычислив DG0 прямой реакции по стандартным энтальпиям образования и абсолютным энтропиям химических веществ. Изменится ли направление процесса при повышении температуры до 3000 С?
117. При какой температуре наступит равновесие системы:
MnO2(к) + 4HCl(г) ↔ MnCl2(к) + Cl2(г)+2Н2О(г)?
При каких температурах реакция будет протекать в прямом, а при каких – в обратном направлении?
118. Не прибегая к вычислениям, определите, какие знаки (>0, <0, @0) имеют DG, DH и DS для протекающей в обратном направлении реакции:
СО2(г) +2 SO3(г) ↔СS2(г) + 4 О2(г).
Как повлияет повышение температуры на направленность химической реакции?
119. При какой температуре наступит равновесие системы:
2 НBr (г) + I2(к) ↔ 2 HI (г) + Br2 (г)?
При каких температурах более сильным восстановителем будет являться иод, а при каких – бром?
120. С чем будет более интенсивно взаимодействовать газообразный иодоводород (в расчете на 1 моль): с железом или с магнием? Ответ дайте, рассчитав DG обеих реакций. Продуктами реакций являются твердая соль и газообразный водород.
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
121. Начальная концентрация серной кислоты в реакции:
MgСО3 (т) + H2SO4(раствор) →MgSO4(раствор) +СО2(г) + H2О(раствор)
равнялась 10%масс. Как изменится скорость данной реакции при снижении концентрации H2SO4 до 5%масс.?
122. Как следует изменить температуру для уменьшения скорости реакции в 32 раза, если температурный коэффициент скорости составляет 2. 123. Константа скорости реакции омыления уксусноэтилового эфира:
СН3СООС2Н5(р-р) + КОН(р-р)→СН3СООК (р-р) +С2Н5ОН(р-р)
равна 0,1 л/моль∙мин. Начальная концентрация уксусноэтилового эфира была равна 0,01 моль/л, а щелочи – 0,05 моль/л. Вычислите начальную скорость реакции и в тот момент, когда концентрация эфира станет равной 0,008 моль/л. Ответ: 5,0∙10-5 и 3,84∙10-5 моль/л∙мин. 124. При повышении температуры с 40 до 65оС скорость гомогенной реакции возросла в 40 раз. Рассчитайте температурный коэффициент и энергию активации данной реакции.
125. Рассчитайте скорость реакции между растворами хлорида калия и нитрата серебра, концентрации которых составляют соответственно 0,2 и 0,3 моль/л, а k=1,5∙10-3л∙моль-1∙с-1 126. Начальные концентрация исходных веществ в системе:
N2(г) +3H2(г) ↔ 2NH3(г) составили: азота – 0,5 моль/л, водорода – 3 моль/л. Как изменится скорость данной реакции к моменту, когда в системе образуется 0,1моль/л аммиака? 127. Как следует изменить концентрацию кислорода, чтобы скорость гомогенной элементарной реакции: 2 NО(г) +O2(г) → 2 NО2(г)
не изменилась при уменьшении концентрации оксида азота (II) в 2 раза? 128. Как следует изменить объем реакционной смеси системы:
8NH3(г) + 3Br2(ж)→6NH4Br(к) + N2(г),
чтобы скорость реакции уменьшилась в 60 раз? 129. При увеличении температуры с 30 до 45оС скорость гомогенной реакции повысилась в 20 раз. Чему равна энергия активации реакции? 130. Как следует изменить концентрацию оксида серы (IV), чтобы скорость гомогенной элементарной реакции: 2SO2 + O2 → 2SO3
не изменилась при увеличении концентрации кислорода в 8 раз?
131. Исходные концентрации оксида углерода (II) и кислорода в системе:
СО (г)+ 2 Н2 (г) ↔ СН3ОН (ж)
равны соответственно 0,01 и 0,05 моль/л. Как изменятся их концентрации к тому моменту, когда скорость реакции снизится в 3 раза по сравнению с исходной?
132. Как следует изменить давление в системе:
2С2Н2(г) + 3H2O(г) → С3Н6О(г) + СО2(г) + Н2(г)
чтобы увеличить скорость реакции 400 раз? 133. Как изменится скорость реакции:
Fe2O3(к) + 3 СО(г) ↔ 2 Fe(к) + 3СО2(г) , если а) увеличить объем системы в 3 раза? б) увеличить давление в системе в 5 раз? 134. Рассчитайте скорость реакции между растворами сульфата натрия и нитрата бария, концентрации которых составляют соответственно 0,3 и 0,5 моль/л, а k=9,2∙10-4л∙моль-1∙с-1 135. При 509оС константа скорости реакции: 2HI → H2 + I2 составляет 0,0047 л/(моль∙мин). Вычислите концентрацию НI, если скорость реакции равна 5,8·10-4 моль/(л∙мин). 136. Определите температурный коэффициент скорости реакции между карбонатом магния и серной кислотой, если известно, что при 250С растворение происходит за 16 сек, а при 550С – за 2 сек. 137. Начальная концентрация исходных веществ в системе H2 + I2 → 2HI была равна 0,7 и 0,3 моль/л. Как изменится скорость реакции к тому моменту, когда концентрация НI станет равна 0,2 моль/л? 138. Как изменится скорость реакции, протекающей в системе:
MnO2(к) + 4HCl(г) → MnCl2(к) + Cl2(г) + 2 Н2О(г)
при увеличении давления в ней в 2 раза? 139. Как следует изменить давление в системе:
4HI(г) +O2(г) →2I2(г) + 2H2О(г)
чтобы скорость реакции возросла в 243 раза? 140. Энергия активации реакции равна 64,3 кДж/моль. Во сколько раз уменьшится скорость реакции при нагревании реакционной смеси с 25 до 70оС?
ХИМИЧЕСКОЕ РАВНОВЕСИЕ 141. Какие условия будут способствовать выходу SO3 по реакции: 2SO2 + O2 ↔ 2SO3 ; ΔНо298 = - 98,9 кДж/моль?
Напишите выражение константы равновесия данной реакции. 142. Как повлияет на выход хлора в системе:
4HCl(г) +O2(г) ↔2Cl2(г) + 2H2О(ж); ΔНо298 =−202,4кДж
а) повышение температуры; б) уменьшение общего объема смеси; в) уменьшение концентрации кислорода; д) введение катализатора?
143. Константа равновесия системы:
2NО (г) +О2 (г) ↔ 2NО2 (г)
равна при некоторой температуре 2,22, а начальная концентрация NО составила 2,8 моль/л. Какова должна быть начальная концентрация О2, чтобы доля окисленного NO составила 60%?
144. При каких условиях равновесие реакции:
MnO2(к) + 4HCl(г) ↔ MnCl2(к) + Cl2(г)
будет смещаться в сторону образования Cl2? Напишите выражение константы равновесия данной реакции. 145. Почему при изменении давления смещается равновесие реакции:
N2(г) +3H2(г) ↔ 2NH3(г),
и не смещается равновесие реакции:
FeO(к) + CO(г)↔Fe(к) + CO2(г)?
Напишите выражения констант равновесия данных реакций. 146. Равновесие в системе H2(г)+ I2(г)↔ 2HI(г) установилось при следующих концентрациях участников реакции: HI – 0,05 моль/л, водорода и иода – по 0,01моль/л. Как изменятся концентрации водорода и иода при повышении концентрации HI до 0,08моль/л? 147. Константа равновесия реакции:
СОСl2(г) ↔ СО(г)+С12(г)
равна 0,02. Исходная концентрация СОCl2 составила 1,3 моль/л. Рассчитайте равновесную концентрацию Сl2. Какую исходную концентрацию СОCl2 следует взять, чтобы увеличить выход хлора в 3 раза?
148. Напишите выражение для константы равновесия гомогенной системы:
СН4(г) + СО2(г) ↔ 2 СО(г) + 2 Н2(г) ΔНо298>0;
Как следует изменить температуру и давление, чтобы увеличить выход водорода? Как повлияет на величину выхода водорода увеличение концентрации СН4? 149. Константа равновесия системы:
СCl4(г) ↔ 2Cl2 (г) +C (к)
при температуре 700 К составляет 0,77. Равновесная концентрация хлора составила 0,5 моль/л. Рассчитайте равновесную и начальную концентрацию СCl4. 150. Константа равновесия реакции:
PCl5 ↔ PCl3 + Cl2
равна 0,63 при 500оС. Исходная концентрация PCl5 равна 1,2 моль/л. Рассчитайте равновесные концентрации PCl3 и Cl2. 151. Исходные концентрации водорода и иода в системе:
H2(г)+ I2(г)↔ 2HI(г)
равны соответственно 1,55 и 1,0 моль/л.Рассчитайте константу равновесия системы, если известно, что к моменту установления равновесия прореагировало 90% I2. 152. В каком направлении сместится равновесие системы:
СО(г) + 3 Н2(г) ↔ СН4(г) + Н2О(г); ΔНо298<0
а) при понижении температуры; б) введении катализатора; в)повышении давления? Напишите выражение константы равновесия данной реакции.
153. В системе: СО(г)+С12(г) ↔ СОСl2(г)
начальная концентрация СО и С12 была равна 0,28 и 0,09 моль/л; равновесная концентрация СО равна 0,20 моль/л. Найдите константу равновесия.
154. Восстановление Fe3O4 водородом протекает по уравнению: Fe3O4(к) + 4 H2(г) ↔ 3 Fe(к) + 4 H2O(г) ; ΔНо298 > 0 Как следует изменить: а) температуру; б) концентрацию водорода; в) давление в системе, чтобы увеличить выход железа? Напишите выражение константы равновесия данной реакции. 154. Для реакции: FeO(к) + CO(г)↔Fe(к) + CO2(г)
константа равновесия при 1000оС равна 0,5. Начальные концентрации СО и СО2 были соответственно равны 0,05 и 0,01 моль/л. Найдите их равновесные концентрации. 156. В какую сторону смещается химическое равновесие в следующих обратимых реакциях при: а) повышении температуры; б) уменьшении давления.
1) N2(г) + О2(г) 2) СО2(г) + С(к) 157. В каком направлении сместится равновесие в системе:
SO3(г) + C(к) ↔ SO2(г) + CO(г)); ΔНо298<0
а) при уменьшении общего объема смеси; б) уменьшении концентрации SO2; в) введении катализатора; г) увеличении температуры? Напишите выражение константы равновесия данной реакции. 158. Исходные концентрации NО и О2 в реакции:
2NО (г) +О2 (г) ↔ 2NО2 (г)
соответственно равны 0,025 и 0,0325 моль/л. Вычислите равновесные концентрации всех веществ и константу равновесия, если известно, что к моменту установления равновесия прореагировало 20% NО.
159. В каком направлении сместится равновесие в системе:
СО2 (г)+Н2 (г) ↔ СО (г)+Н2О (ж); ΔНо298<0
а) при увеличении давления; б) уменьшении концентрации SO2; в) введении катализатора; г) увеличении температуры? Напишите выражение константы равновесия данной реакции. 160. В системе: PCl5 ↔ PCl3 + Cl2 равновесие при 500 оС установилось, когда исходная концентрация PCl5, равная 1 моль/л, уменьшилась до 0,46 моль/л. Найдите значение константы равновесия при указанной температуре.
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ
161. Из скольких атомов состоит молекула иода в спиртовом растворе, если раствор 6,35 г иода в100 г этанола кипит при 78,59оС? 162. Давление пара 10%-ного водного раствора бромида аммония при 100оС равно 0,9560∙105 Па. Давление пара чистой воды при 100оС равно 1,0133∙105 Па. Чему равна степень диссоциации данной соли?
163. Сколько граммов глюкозы С6Н12О6 было растворено в 0,5л воды, если температура кипения полученного раствора составила 1020С?
164. Чему равна температура замерзания раствора AlCl3 с молярной концентрацией эквивалента 0,3 моль/л, если его степень диссоциации равна 60%?
165. В каком количестве воды надо растворить 6,84 г глюкозы С6Н12О6, чтобы давление пара воды, равное при 65оС 250 гПа, снизилось до 248 гПа?
166. Найдите относительную молярную массу неэлектролита, если его 10%-ный раствор кипит при 100,60С.
167. Какое осмотическое давление будет иметь при 40оС 6%-ный водный раствор Ва(ОН)2, если экспериментально найденная степень диссоциации данной соли равна 72%? 168. Температура кипения раствора, полученного растворением 9,6 г NH4Cl в 900мл воды, равна 100,09оС. Найдите величину степени диссоциации данной соли.
169. Сколько воды надо прибавить к 2 л раствора сахара, чтобы понизить его осмотическое давление в 3 раза? 170. Вычислите давление насыщенного пара 5%-ного раствора сульфата меди, имеющего степень диссоциации 65%. 171. Какое осмотическое давление имеет раствор 50 г мочевины (NH2)2CO в 4 л воды при 15оС и до какой температуры его надо нагреть, чтобы повысить осмотическое давление на 25 кПа? 172. Найдите молекулярную формулу серы, зная, что температура кипения чистого бензола на 0,081оС ниже температуры кипения 0,8%-ного раствора серы в бензоле. 173. Рассчитайте при 25оС давление насыщенного пара диэтилового эфира над раствором 0,8 г бутанола в 20 мл диэтилового эфира. 174. Сколько граммов глицерина С3Н5(ОН)3 следует растворить в 250 г воды при 250С, чтобы понизить давление насыщенного пара воды на 20 Па? 175. При 200С давление насыщенного пара бензола равно 100кПа. Рассчитайте давление насыщенного пара над раствором бензола С6Н6, в 83 г которого содержится 12,8 г нафталина С10Н8.
176. Вычислите, как различаются температуры замерзания 5%-ных водных растворов сахара С12Н22О11 и хлорида алюминия, если степень диссоциации соли равна 80%-ной. 177. При растворении 2,3 г некоторого неэлектролита в 100 г воды температура кипения повысилась на 0,26 градусов. Рассчитайте молярную массу данного неэлектролита. 178. Раствор, полученный из 500г циклогексана С6Н12 и 0,1 моль бензола С6Н6, кристаллизуется при температуре на 4оС ниже, чем чистый циклогексан. Рассчитайте значение криоскопической постоянной циклогексана. 179. Экспериментальные значение степени диссоциации нитратов серебра и алюминия в 0,1 m растворах приблизительно одинаковы и равны 80%. Как различаются температуры плавления данных растворов? 180. Рассчитайте массовую долю хлорида натрия в физиологическом растворе, осмотическое давление которого при 25оС составляет 762,7 кПа (α=1, ρ=1г/см3).
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 142; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.135.24 (0.027 с.) |

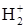 ?
?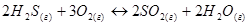
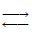 2NО(г); DН > 0;
2NО(г); DН > 0;


