
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Подписано в печать . Формат 60х90 1/16.Содержание книги
Поиск на нашем сайте
Министерство транспорта Российской Федерации Федеральное агентство железнодорожного транспорта ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ Самарский государственный университет путей сообщения Кафедра «Общая и инженерная химия»
ХИМИЯ
Методические указания к выполнению контрольных заданий для студентов всех специальностей
Составители: Васильченко Л.М. Сеницкая Г.Б. Халикова А.В. Сотова Н.В.
Самара 2011
УДК 546
Методические указания к выполнению контрольных заданий для студентов всех специальностей. - Самара: СамГУПС, 2011. - 62 с.
Утверждено на заседании кафедры «Общая и инженерная химия (ОИХ)», протокол № 3 от 25.10.2011 г. Печатается по решению редакционно-издательского совета университета.
Методуказания содержат задания двух контрольных работ по 20-ти разделам курса общей химии.
Составители: Васильченко Лидия Михайловна Сеницкая Галина Борисовна Халикова Алла Викторовна Сотова Наталья Васильевна
Рецензенты: к.х.н., доцент кафедры «Физическая химия и хроматография» Самарского государственного университета Колосова Е.А. к.т.н., доцент кафедры «Физика и экологическая теплофизика» Самарского государственного университета путей сообщения Вилякина Е.В.
Редактор: Комп. верстка:
Подписано в печать. Формат 60х90 1/16. Бумага писчая. Печать оперативная. Усл. п.л.. Тираж экз. Заказ №.
ã Самарский государственный университет путей сообщения, 2011 I. ОБЩИЕ ПОЛОЖЕНИЯ ПО ВЫПОЛНЕНИЮ КОНТРОЛЬНЫХ РАБОТ В соответствии с Государственным стандартом высшего профессионального образования для инженерных специальностей транспортных вузов и рабочими программами по специальностям основными целями обучения студентов – заочников по дисциплине «Химия» являются, прежде всего, приобретение навыков решения задач, относящихся к теоретическому курсу или лабораторно - практическим работам. Выполнение студентами контрольных работ является необходимым условием допуска к зачёту или экзамену. В двух контрольных работах содержатся 20 заданий, каждое из которых отвечает указанному в заголовке отдельному разделу курса общей химии. Номер варианта контрольной работы соответствует двум последним цифрам номера зачётной книжки, например, 6100 – вариант 00; 6102 – вариант 02. Студенты, получившие допуск к собеседованию, должны устранить все указанные рецензентом недоработки, даже при наличии отдельных замечаний их необходимо устранить. Работы, выполненные неудовлетворительно, возвращаются на доработку. При этом преподаватель в рецензии отмечает те вопросы, которые нуждаются в доработке. До предэкзаменационного собеседования студент должен в конце своей работы письменно проделать работу над ошибками с указанием номера задания. Собеседование по выполненным контрольным работам может проводиться как до, так и непосредственно в ходе предусмотренных расписанием консультаций, зачётов и экзаменов. После прохождения собеседования преподаватель на титульном листе (или обложке) контрольного задания проставляет отметку «зачтено после собеседования» с указанием своей подписи и даты. II. ОФОРМЛЕНИЕ КОНТРОЛЬНЫХ РАБОТ Первым листом контрольной работы является титульный лист, на котором вверху приводится аббревиатура вуза, а ниже указываются номера работ, фамилия и инициалы студента, номер его зачётной книжки, курс и обозначение специальности, а также фамилия и инициалы преподавателя, проверяющего работу. В нижней части титульного листа проставляются город и год выполнения работы. Содержание контрольной работы включает номера, условия заданий, их решения. Последние, в случае количественного характера задачи, включают необходимые пояснения и исходные выражения с указанием проверки размерностей в полученном результате. В заданиях количественного характера должна в сжатом виде содержаться информация с исчерпывающим ответом на поставленные вопросы. При изложении решений и ответов на вопросы заданий рекомендуется пользоваться общепринятыми в учебной химической литературе терминологией и символикой, а также данными из таблиц, указанных в Приложениях в конце методических указаний. Рекомендуется использовать также литературу, указанную в библиографическом списке. Список использованной литературы, включающий настоящую методику, приводится после выполненных заданий, где указываются также подпись исполнителя и дата.
III. ПРОГРАММА ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ПО ХИМИИ
Основные химические понятия: моль, атомная масса, молярная масса. Основные химические законы, закон Авогадро, уравнение состояния идеального газа Менделеева-Клапейрона. Эквивалент, закон эквивалентов. Основные классы неорганических соединений. Расчет эквивалентных масс простых веществ и сложных соединений. Химическая термодинамика. Основной закон термодинамики. Основные понятия. Внутренняя энергия и энтальпия. Термохимические законы: закон Гесса, следствие из него. Стандартная теплота образования. Понятие об энтропии. Изменение энтропии в химических процессах и фазовых переходах. Энергия Гиббса. Направленность химических процессов. Расчет изменения энтропии и энергии Гиббса в химических реакциях. Химическая кинетика. Скорость гомогенных химических реакций и ее зависимость от концентрации реагирующих веществ (закон действия масс), от температуры (правило Вант-Гоффа, уравнение Аррениуса), энергия активации. Колебательные реакции. Скорость гетерогенных химических реакций. Химическое равновесие. Константа равновесия и ее связь с энергией Гиббса. Правило смещения химического равновесия Ле Шателье. Периодический закон Д.И. Менделеева. Строение атома. Состав атома. Электронные оболочки атомов. Квантовые числа. Порядок заполнения электронных оболочек: принцип Паули, правило Гунда, правила Клечковского. Электронные семейства элементов. Периодическая система элементов Менделеева. Энергия ионизации, сродство к электрону, электроотрицательность, степень окисления элементов. Изменение радиусов, металлических, кислотно-основных и окислительно-восстановительных свойств элементов. Химическая связь. Основные характеристики связи: энергия, длина, угол связи. Метод валентных связей. Основные характеристики ковалентной связи: направленность, кратность, полярность, насыщаемость. Дипольный момент молекул. Возбужденное состояние атома и гибридизация атомных орбиталей. Донорно-акцепторная связь. Понятие о методе молекулярных орбиталей. Ионная связь, ее отличие от ковалентной связи. Химические основы нанотехнологии.
Растворы. Способы выражения концентраций растворов. Термодинамика растворения. Основные законы растворов неэлектролитов. Основные законы для растворов электролитов. Изотонический коэффициент. Электролитическая диссоциация, основные положения теории диссоциации. Степень диссоциации, константа диссоциации. Закон разведения Оствальда. Реакции в растворах электролитов. Правила записи уравнений реакций ионного обмена. Слабые электролиты. Электролитическая диссоциация воды, ионное произведение воды, водородный показатель. Труднорастворимые соединения, произведение растворимости. Комплексные соединения, константа нестойкости комплексных соединений. Гидролиз солей. Виды гидролиза. Константа гидролиза. Условия смещения равновесия гидролиза.
Химия воды. Состав природных вод. Жесткость воды, единицы ее измерения. Временная и постоянная жесткость. Водоподготовка: удаление механических примесей, коллоидных частиц, методы снижения жесткости воды. Окислительно-восстановительные реакции. Правила определения степени окисления. Классификация окислителей и восстановителей. Методы электронного и электронно-ионного баланса. Классификация окислительно-восстановительных реакций. Направленность окислительно-восстановительных реакций. Электрохимия. Электрохимические процессы, их особенность. Электродный потенциал. Измерение стандартных электродных потенциалов. Уравнение Нернста. Химические источники тока: гальванические элементы, концентрационные гальванические элементы, аккумуляторы, топливные элементы. Электролиз. Электролиз расплавов, его применение. Электролиз растворов. Катодное восстановление и анодное окисление, связь со значениями электродных потенциалов. Электролиз растворов с инертным и активным анодом. Законы Фарадея. Выход по току. Применение электролиза в гальванотехнике, получении и очистке металлов. Металлы, их классификация по физическим свойствам. Химические свойства металлов. Коррозия металлов: газовая и электрохимическая. Способы защиты металлов от коррозии. Дисперсные системы. Классификации дисперсных систем. Методы получения дисперсных систем. Устойчивость дисперсных систем. Силы, действующие между коллоидными частицами. Влияние стабилизаторов на устойчивость коллоидных систем. Строение коллоидной частицы. Электрокинетические свойства коллоидных растворов. Факторы, влияющие на геле- и студнеобразование. Полимерные материалы. Методы синтеза полимеров: полимеризация и поликонденсация. Линейные, разветвленные и пространственные полимеры. Вулканизация. Состояния линейных полимеров. Физико-механические свойства полимеров в высокоэластичном состоянии. Применение полимеров на железнодорожном транспорте. Основы аналитической химии. Количественный и качественный анализ. Гравиметрический и титриметрический методы. Физико-химические методы анализа: электрохимические, хроматографические и оптические методы анализа. РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Основная учебная литература
1. Коровин Н.В. Учебник для технич. направл. и спец. вузов – 6-е изд., испр. – М.: Высш. шк., 2005. – 557 с. 2. Глинка Н. Л. Общая химия. – 30-е изд. - М.: Интеграл-пресс, 2006. - 728 с. 3. Зубрев Н.И. Инженерная химия на железнодорожном транспорте. – М.: УМК МПС РФ, 2002. – 292 с. 4. Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов / Под. ред. В.А. Рабиновича и Х.М. Рубиной – М.: Интеграл – Пресс, 2007. – 240 с. 5. Гольбрайх З.Е. Сборник задач и упражнений по общей химии: учебное пособие для вузов / Под. ред В.А. Рабиновича. - М.: Интеграл – Пресс, 2007. – 240 с.
Учебно-методическая литература
1. Васильченко Л.М., Сеницкая Г.Б., Халикова А.В., Сотова Н.В. Справочный материал по дисциплинам «Химия» и «Коррозия металлов» для студентов 1-го курса всех специальностей и форм обучения. Часть I. – Самара: СамГУПС, 2005. – 98 с. 2. Васильченко Л.М., Сеницкая Г.Б., Халикова А.В., Яковлев В.М. Контрольные задания для студентов-заочников всех специальностей. Самара: СамГУПС, 2008. – 44 с. 3. Васильченко Л.М., Сеницкая Г.Б., Халикова А.В., Яковлев В.М., Сотова Н.В. Методические указания для выполнения учебно-исследовательской работы по химии. – Самара: СамГУПС, 2009. – 30 с. 4. Васильченко Л.М., Сеницкая Г.Б., Халикова А.В., Яковлев В.М., Сотова Н.В. Методические указания для выполнения лабораторных работ по количественному анализу химических соединений для студентов всех специальностей очной формы обучения. – Самара: СамГУПС, 2009. – 31 с. 5. Васильченко Л.М., Сеницкая Г.Б., Халикова А.В., Яковлев В.М., Сотова Н.В. Химия. Лабораторные работы и методические указания к выполнению для студентов всех специальностей очной формы обучения. – Самара: СамГУПС, 2009. – 35 с. 6. Васильченко Л.М., Сеницкая Г.Б., Халикова А.В., Яковлев В.М., Сотова Н.В. Химия. Лабораторные работы и методические указания к выполнению для студентов всех специальностей заочной формы обучения. – Самара: СамГУПС, 2009. – 35 с. 7. Васильченко Л.М., Сотова Н.В. Окислительно-восстановительные процессы. Методические указания к выполнению лабораторной работы по химии для студентов всех специальностей и форм обучения. – Самара: СамГУПС, 2008. – 15 с. 8. Васильченко Л.М, Сотова Н.В., Яковлев В.М. Основные классы неорганических соединений. Методические указания к выполнению лабораторной работы по химии для студентов всех специальностей и форм обучения. – Самара: СамГУПС, 2007. – 20 с. 9. Васильченко Л.М., Сотова Н.В. Тестовые задания по дисциплине «Химия» для студентов транспортных вузов всех специальностей. – Самара: СамГУПС, 2009. – 62 с. 10. Васильченко Л.М., Сеницкая Г.Б., Халикова А.В., Яковлев В.М., Сотова Н.В. Методическое пособие на тему «Инструментальные методы анализа» по дисциплинам «Химия» и «Коррозия металлов и средства защиты от нее». - Самара: СамГУПС, 2010. – 10 с. 11. Васильченко Л.М., Сеницкая Г.Б., Халикова А.В., Сотова Н.В. Коррозия металлов и средства защиты от нее. Методические указания к выполнению лабораторных работ для студентов всех специальностей дневной и заочной форм обучения. Часть I. - Самара: СамГУПС, ноябрь 2010. – 29 с. 12. Васильченко Л.М., Сеницкая Г.Б., Халикова А.В., Сотова Н.В. Коррозия металлов и средства защиты от нее. Методические указания к выполнению лабораторных работ для студентов всех специальностей дневной и заочной форм обучения. Часть II. - Самара:СамГУПС, ноябрь 2010. – 33 с. 13. Васильченко Л.М., Сеницкая Г.Б., Халикова А.В., Яковлев В.М., Сотова Н.В. Химия. Тестовые задания для студентов всех специальностей очной и заочной форм обучения. Часть II. - Самара: СамГУПС, ноябрь 2010. – 30 с. 14. Васильченко Л.М., Сеницкая Г.Б., Халикова А.В., Сотова Н.В. Коррозия металлов и средства защиты от нее. Контрольные задания для студентов транспортных специальностей. - Самара: СамГУПС, ноябрь 2010. – 25 с. 15. Васильченко Л.М., Кажанова Т.В., Сотова Н.В. Методические указания к выполнению лабораторных работ по химии для студентов 1 курса всех специальностей и форм обучения. – Самара-Оренбург, СамГУПС, январь 2011 – 77 с. 16. Васильченко Л.М., Кажанова Т.В. Методические указания к выполнению лабораторной и учебно-исследовательской работы по химии для студентов 1 курса всех специальностей и форм обучения. – Самара-Оренбург: СамГУПС, апрель 2011 – 16 с.
Дополнительная литература
1. Ахметов Н.С. Общая и неорганическая химия. Учебник для вузов. – М.: Высш. шк., издат. центр «Академия», 2001. – 743 с. 2. Горбунов А.И., Гуров А.А., Филиппов Г.Г., Шаповал В.Н. Теоретические основы общей химии: Учебник для студентов технических университетов и вузов. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2003. – 720 с. 3. Степин Б. Д. Демонстрационные опыты по общей и неорганической химии. – М.: Владос, 2004. – 335 с. 4. Колпакова Н. А. Сборник задач по электрохимии. – М.: Высш. шк., 2003.- 142 с. СТРОЕНИЕ АТОМОВ 21. На каких орбиталях находятся электроны, если l = 3? Сколько таких орбиталей? Чему равен суммарный спин, если 4 электрона на орбиталях? Укажите максимальное число электронов на рассматриваемых орбиталях, используя магнитное и спиновое квантовые числа. 22. Напишите значения всех четырех квантовых чисел для трех любых электронов на 4p-подуровне. Значениями какого квантового числа различаются три электрона указанного подуровня? Почему максимальное число электронов на p-подуровне равно 6? 23. По какому признаку элементы подразделяются на электронные семейства? Напишите электронные формулы атомов любых двух элементов пятого периода, принадлежащих к разным электронным семействам. Какие электроны этих элементов являются валентными? Какой подуровень заполняется раньше: 5s или 4d? Почему?
24. Напишите электронные формулы атома железа, ионов Fe2+ и Fe3+. Докажите с помощью электронно-графической схемы, что максимальная валентность железа в соединениях равна 6.
25. Напишите электронные формулы атома водорода и ионов Н+, Н-. Какие элементарные частицы входят в состав атома водорода и ионов? Вычислите энергию связи электрона в электрон-Вольтах (эВ) на первой и пятой стационарных орбиталях атома водорода и сравните (<, >) их величины. 26. Какое состояние атома называется основным и какое – возбужденным? Чем ион отличается от нейтрального атома? Ответы на вопросы подтвердите написанием электронных формул атома брома и бромид-иона. Изобразите электронно-графические схемы атома брома в нормальном и возбужденных состояниях. 27. Структуры валентных электронных слоёв атомов элементов выражаются формулами: а) 5s25p4; б) 3d54s1; в) 7s2. Определите порядковые номера, приведите названия элементов, а также укажите принадлежность к электронным семействам. 28. Распределение валентных электронов в двух элементах одной подгруппы ns1 (n - 1) d5. Приведите электронные формулы элементов. Укажите низшую и высшую степени окисления этих элементов.
29. Напишите электронные формулы атома Te и иона Te2-. Докажите, что валентность теллура в соединениях 2, 4, 6.
30. На примерах галлия и марганца докажите, что имеется взаимосвязь строения атомов элементов с положением их в периодической системе химических элементов Д.И. Менделеева. 31. Структуры валентных электронных слоев выражаются формулами: а) 4s24p2; б) 5d46s2; в) 4s1. Составьте полные электронные формулы, определите порядковые номера, приведите названия элементов, определите принадлежность к электронным семействам. 32. Напишите электронную формулу атома кислорода. Какие элементарные частицы входят в состав атома? Рассчитайте длину волны де Бройля для молекулы кислорода, движущейся со скоростью 1000 м/с, учтите единицы измерения Джоуля [м2×кг×с-2]. Возможно ли обнаружение волновой природы этой частицы?
33. Напишите электронную формулу атома меди; учтите, что у меди происходит провал одного 4s электрона на 3d-подуровень. Приведите электронные формулы двух последних уровней электронных аналогов меди. 34. Составьте электронные формулы и электронно-графические схемы атомов элементов с порядковыми номерами 23 и 33 в нормальном и возбужденных состояниях. Приведите валентные электроны этих элементов и их электронных аналогов. 35. Напишите электронные формулы атома Ba и иона Ba2+. Какую валентность проявляет барий в нормальном и возбужденном состояниях? Структуру какого инертного газа имеет ион Ba2+?
36. Напишите электронные формулы и электронно-графические схемы атомов фосфора и ванадия в нормальном и возбужденном состояниях. К какому электронному семейству относится каждый из этих элементов?
37. Напишите электронную формулу атома технеция. Укажите валентные электроны. Распределите валентные электроны по энергетическим ячейкам в нормальном и возбужденном состояниях. Определите суммарный спин электронов в возбужденном состоянии. 38. Что такое изотопы? Приведите примеры изотопов какого-либо элемента, напишите электронную формулу изотопов этого элемента. Почему изотопы элемента имеют сходные химические свойства?
39. На каком основании иттрий (Z=39) и индий (Z=49) помещены в одну группу периодической системы элементов Д.И. Менделеева? Почему они в разных подгруппах? Приведите валентные электроны этих элементов и их электронных аналогов.
40. Напишите электронные формулы атома стронция и иона Sr2+. Укажите валентность стронция в нормальном и возбужденном состояниях. Какие значения принимают кантовые числа для внешних электронов атома стронция? ПЕРИП 41. Приведите полные и сокращенные электронные формулы двух элементов из разных электронных семейств с формулой высшего оксида ЭО3. укажите низшие степени окисления этих элементов.
42. На основании строения атомов лития и бериллия поясните, почему первый потенциал ионизации у лития меньше, чем у бериллия, а второй потенциал ионизации лития больше, чем у бериллия?
43. В ряду оксидов P2O5, SO3, B2O3, Al2O3, MgO, Na2O, Jn2O3, Tl2O3 установите, используя разные оксиды, два закономерных перехода: основной → амфотерный → кислотный. 44. Исходя из положения галогенов в периодической системе, поясните, как изменяются восстановительные свойства в ряду HCl – HBr – HJ. Почему HF входит в исключение? 45. Составьте формулы оксидов и гидроксидов марганца. Как изменяется кислотно-основной и окислительно-восстановительный характер этих соединений? Подчиняются ли эти соединения общей закономерности изменения свойств оксидов и гидроксидов? 46. Приведите современную формулировку периодического закона. Объясните, почему в периодической системе элементов аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, йодом и протактинием, хотя имеют бóльшую атомную массу. Как называются пары таких элементов?
47. Исходя из положения технеция, селена, цезия в периодической системе, составьте формулы следующих соединений: технециевой кислоты, оксида селена, гидрокарбоната цезия, отвечающих их высшей степени окисления. Изобразите структурные формулы соединений.
48. Исходя из строения атомов элементов, определите, какое основание более сильное: а) Sr(OH)2 или Fe(OH)2; б) Cu(OH)2 или KOH; какая кислота более сильная: а) H3AsO4 или H2SeO4; б) HClO4 или HMnO4.
49. Из оксидов As2O3, P2O5, GeO2, SO3, Al2O3, V2O5 выберите два оксида с наиболее выраженными кислотными свойствами. Укажите валентные электроны выбранных элементов.
50. Из оксидов BaO, K2O, TiO2, CaO, Al2O3, MgO, ZnO выберите два оксида с наиболее выраженными основными свойствами. Укажите валентные электроны выбранных элементов.
51. Какую высшую и низшую степени окисления проявляют молибден, йод и цирконий? Почему? Составьте формулы соединений, отвечающих этим степеням окисления и изобразите их структурные формулы.
52. Исходя из положения хрома, селена, углерода и серы в периодической системе, определите, какая из кислот является более сильным окислителем: а) H2CrO4 или H2SeO4, б) H2CO3 или H2SO3. 53. Какую высшую и низшую степени окисления проявляют вольфрам, теллур, серебро в соединениях? Почему? Составьте формулы соединений, отвечающих этим степеням окисления и изобразите их структурные формулы. 54. Исходя из положения металлов в периодической системе, определите, какой из двух гидроксидов является более сильным основанием: а) KOH или Mn(OH)2; б) Zn(OH)2 или Сa(OH)2; в) Mg(OH)2 или Be(OH)2. 55. Какие элементы принадлежат к f –электронному семейству? На примерах строения атомов двух любых лантаноидов (или актиноидов) докажите, что химические свойства в группах лантаноидов (или актиноидов) близки друг к другу.
56. Составьте формулы оксидов и гидроксидов ванадия. Как изменяется кислотно-основной и окислительно-восстановительный характер этих соединений? 57. Составьте два ряда из элементов Ca, Mn, C, Si, Zn, Br, Sn, Ge в порядке уменьшения ЭО в периоде и группе. 58. Как изменяется прочность связи между атомами в молекулах галогенов Cl2 – Br2 – J2? Почему молекула F2 выпадает из общей закономерности?
59. Исходя из положения серы, фосфора и хлора в периодической системе, определите, как изменяются окислительные свойства кислот: H2SO4, H3PO4, HClO4? 60. Даны пары элементов: а) C и N; б) N и P; в) P и F; г) S и CL. Укажите пару элементов, которые образуют соединения состава Ca3Э2.
ХИМИЧЕСКАЯ СВЯЗЬ
61. Какая химическая связь называется водородной? Приведите три примера соединений с водородной связью. Изобразите структурные схемы приведенных ассоциатов. Как влияет образование водородной связи на свойства веществ (вязкость, температуры кипения и плавления, теплоты плавления и парообразования? 62. Какая связь называется s- и какая - p-связью? Какая из них менее прочная? Изобразите структурные формулы этана C2H6, этилена C2H4 и ацетилена C2H2. Отметьте s- и p-связи на структурных схемах углеводородов. 63. В молекулах F2, O2, H2SO4, HCl, CO2 укажите тип связей, число s- и p-связей. 64. Какие силы межмолекулярного взаимодействия называются диполь-дипольными (ориентационными), индукционными и дисперсионными? Объясните природу этих сил. Какова природа преобладающих сил межмолекулярного взаимодействия в каждом из следующих веществ: H2O, HBr, Ar, N2, NH3?
65. Приведите две схемы заполнения МО при образовании донорно-акцепторной связи в системах с атомными заселениями: а) электронная пара – свободная орбиталь (2+0) и б) электронная пара – электрон (2+1). Определите порядок связи, сравните энергии связей. Какая из рассмотренных связей участвует в образовании иона аммония [NH4]+?
66. На основании строения атомов в нормальном и возбужденном состояниях определите ковалетность бериллия и углерода в молекулах BeCl2, (BeCl2)n, CO и CO2. Изобразите структурные формулы молекул. 67. На основании положений зонной теории кристаллов охарактеризуйте металлы, проводники и диэлектрики. От чего зависит ширина запрещенной зоны? Какие примеси нужно добавить к кремнию, чтобы превратить его в: а) n-полупроводник; б) р-полупроводник? 68. Приведите электронную конфигурацию молекулы NO по методу МО. Как изменяются магнитные свойства и прочность связи при переходе от молекулы NO к молекулярному иону NO+? 69. Какая химическая связь называется ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите примеры молекул с типично ионными связями и укажите тип кристаллической решетки. Составьте изоэлектронный ряд ксенона.
70. На основании строения атомов в нормальном и возбужденном состояниях определите ковалентность лития и бора в соединениях: Li2Cl2, LiF, [BF4]-, BF3.
71. Какая химическая связь называется координационной или донорно-акцепторной? Разберите строение комплекса [Zn(NH3)4]2+. Укажите донор и акцептор. Как метод валентных связей (ВС) объясняет тетраэдрическое строение этого иона? 72. Почему существует молекула PCl5, но не существует молекула NCl5, хотя азот и фосфор находятся в одной и той же подгруппе VA периодической системы? Какой тип связи между атомами фосфора и хлора? Укажите тип гибридизации атома фосфора в молекуле PCl5. 73 Охарактеризуйте типы кристаллических структур по природе частиц узлов решеток. Какие кристаллические структуры имеют: CO2, CH3COOH, алмаз, графит, NaCl, Zn? Расположите их по порядку возрастания энергий кристаллических решеток. Что такое интеркалирование? 74. Приведите четыре примера молекул и ионов с делокализованными связями. Изобразите их структурные формулы. 75. Какой тип гибридизации в молекулах CCl4, H2O, NH3? Изобразите в виде схем взаимное расположение гибридных облаков и укажите углы между ними. 76. Приведите две схемы заполнения МО при взаимодействии двух АО с заселениями: а) электрон + электрон (1+1) и б) электрон + вакантная орбиталь (1+0). Определите ковалентность каждого атома и порядок связи. В каких пределах энергия связи? Какие из указанных связей в молекуле водорода H2 и молекулярном ионе 77. Приведите электронную конфигурацию молекулы азота по методу МО. Докажите, почему молекула азота обладает большой энергией диссоциации. 78. Что такое дипольный момент? Как он изменяется в ряду сходно построенных молекул: HCl, HBr, HJ? Какой тип связи осуществляется между атомами водорода, хлора, брома и йода в приведенных молекулах? s- или p-связи в этих молекулах? 79. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа ABn, если связь в них образуется за счет sp-, sp2-, sp3- гибридизации орбиталей атома A? Приведите примеры молекул с указанными типами гибридизации. Укажите углы между связями. 80. Даны пары веществ: а) H2O и CО; б) Вr2 и CH4; в) CаО и N2; г) H2 и NH3. Для какой пары веществ характерна ковалентная неполярная связь? Изобразите структурные схемы выбранных молекул, укажите формы этих молекул и углы между связями.
ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
81. На восстановление 14 г диоксида кремния SiO2 (к) углеродом, в результате которого образуются кремний и оксид углерода СО(г), требуется 148,7 кДж теплоты. Рассчитайте тепловой эффект реакции и напишите термохимическое уравнение. Вычислите теплоту образования SiO2.
82. Вычислите тепловой эффект реакции восстановления Fe2O3 металлическим алюминием. Напишите термохимическое уравнение. Сколько выделяется тепла, если в реакцию вступают 8 молей Fe2O3 и сколько молей железа образуется при этом? 83. Определите тепловой эффект сгорания жидкого сероуглерода CS2(ж) до образования газообразных СО2 и SO2. Сколько молей CS2 вступят в реакцию, если выделится 700 кДж тепла? 84. Рассчитайте энтальпию образования жидкого сероуглерода CS2 по следующим данным: Sмонокл. + О2(г) = SО2(г); DН = -296,9 кДж; СS2(ж) + 3О2(г) = СО2(г) + 2SО2(г); DН = -1076,43 кДж; С(граф.) + О2(г) = СО2(г); DН = -393,5 кДж. 85. Определите тепловой эффект сгорания природного газа, протекающего по уравнению: СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г),
Сколько тепла выделится при сгорании 1 м3 газа? Расчет проведите с допущением, что стандартные условия течения реакции совпадают с нормальными условиями. 86. Вычислитетепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
FeO (к) + CO (г) = Fe (к) + CО2 (г); DH = -18,20 кДж; СO (г) + 1/2O2 (г) = СO2 (г) DН = -283,0 кДж; H2 (г) + ½ O2 (г) = H2O (г) DН = -241,83 кДж.
87. Растворение моля безводной соды Na2CO3 в достаточно большом количестве воды сопровождается выделением 25,10 кДж теплоты, тогда как при растворении кристаллогидрата Na2CO3×10Н2О поглощается 66,94 кДж теплоты. Составьте термохимические уравнения процессов гидратации и растворения гидратированной соли. Вычислите теплоту гидратации Na2CO3.
88. Реакция горения бензола выражается термохимическим уравнением:
С6Н6(ж) + 7½ О2(г) = 6СО2(г) + 3Н2О(г) – 3135,6 кДж.
Вычислите теплоту образования жидкого бензола. Определите теплотворную способность жидкого бензола при условии, что стандартные условия совпадают с нормальными. 89. Рассчитайте, сколько тепла выделится при гашении 50 кг 80%-ной негашеной извести, если теплота гашения на 1 моль СаО составляет - 65 кДж/моль. Определите теплоту образования гашеной извести. 90. Реакция окисления этилового спирта выражается уравнением:
С2Н5ОН(ж) + 3,0 О2(г) = 2СО2(г) + 3Н2О(ж).
Определить теплоту образования С2Н5ОН(ж) , зная DН х.р. = - 1366,87 кДж. Напишите термохимическое уравнение. Определите мольную теплоту парообразования С2Н5ОН(ж) ® С2Н5ОН(г), если известна теплота образования С2Н5ОН(г), равная –235,31 кДж · моль-1. 91. Используя энтальпии образования веществ, определите DН0 химической реакции:
2Mg(к) + СО2(г) = 2MgО(к) + Сграфит.
Сколько образуется графита, если в реакцию вступит 100 г Mg и сколько выделится тепла при этом? 92. Вычислите тепловой эффект реакции горения толуола С7Н8(ж):
С7Н8(ж) + 9О2(г) = 7 СО2(г) + 4Н2О(г)
Напишите термохимическое уравнение. Сколько тепла выделится при сгорании 200 г толуола? 93. Вычислите теплоту образования карбида кальция СаС2, исходя из теплового эффекта реакции: СаО(т) + 3С(т) = СаС2(т) + СО(г) +462,2кДж
и стандартных энтальпий образования СаО и СО. Сколько нужно затратить тепла для получения 100 кг СаС2(т)? 94. При получении одного грамм-эквивалента гидроксида кальция из CaO(к) и Н2О(ж) выделяется 32,75 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция. 95. Реакция горения аммиака выражается термохимическим уравнением:
4NH3(г) + 3О2(г) = 2N2(г) + 6H2О(ж); DН = -1530,0 кДж.
Вычислите теплоту образования аммиака NH3(г).Сколько тепла выделяется при сгорании 10 молей NH3(г)? 96. Тепловой эффект реакции восстановления оксида вольфрама WO3(к) водородом, приводящий к образованию вольфрама и паров воды, равен +117,2 кДж. Вычислите теплоту образования оксида вольфрама. Сколько нужно затратить тепла для получения 500 г вольфрама?
97. Определите тепловой эффект химической реакции:
Al2O3 (к) + SO3 (г) = Al2 (SO4)3 (к) ,
ная при стандартных условиях теплоты образования Al2O3 (к), SO3 (г) и Al2(SO4)3 (к) соответственно, кДж·моль-1: -1676,0; -395,8 и -3441,2. Сколько тепла выделится, если в реакции участвует 0,25 моль Al2O3 (к)? 98. Реакция горения аммиака выражается уравнением:
4 NН3 (г) + 5О2(г) = 4 NО (г) + 6Н2О(г).
Вычислите тепловой эффект реакции в пересчете на 1 моль NН3 (г). Напишите термохимическое уравнение горения аммиака. 99. Вычислите тепловой эффект реакции спиртового брожения глюкозы (под действием ферментов), если известны теплоты образования C6H12O6 (к), C2H5OH (ж) соответственно, кДж /моль: - 1273,0; -277,6:
С6Н12О6(к) = 2 С2Н5ОН(ж) + 2СО2(г)
Напишите термохимическое уравнение. Сколько выделится тепла при брожении 1кг глюкозы? 100. Определите тепловой эффект реакции разложения 1 моля бертолетовой соли КСlО3(к), протекающей по уравнению:
2КСlО3(к) = 2КСl(к) + 3О2(г).
Напишите термохимическое уравнение. Определите, сколько тепла выделится при разложении 100 г бертолетовой соли. Какая из солей KCl или KClO3 более термически стойкая? ХИМИЧЕСКОЕ СРОДСТВО 101. Рассчитав на основании табличных данных DG и DS, определите тепловой эффект реакции: 2 NO (г) + Cl2 (г) ↔ 2 NOCl (г).
Экзотермической или эндотермической является данная реакция?
102. Вычислите изменение энергии Гиббса при 250С для реакции:
2 Н2O (г) + 2 I2(г) ↔ 4 HI (г) + O2 (г)
по стандартным значениям энтальпий образования и абсолютных энтропий химических веществ. Можно ли назвать этот процесс самопроизвольным? Изменится ли направление процесса при повышении температуры до 4000С? Укажите роль энтальпийного и энтропи
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 102; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.174.253 (0.016 с.) |

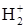 ?
?


