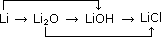Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства металловСодержание книги Поиск на нашем сайте
321. Чем обусловлены восстановительные свойства химических элементов металлов? Объясните, почему в водных растворах восстановительную способность можно оценить, используя ряд напряжений металлов, по величине стандартного электродного потенциала. Укажите примеры любых четырёх металлов, вытесняющих никель из растворов его солей. Назовите причину этого явления и приведите уравнение электронного баланса одной из соответствующих реакций. 322. Какие периодические характеристики химических элементов могут служить в качестве меры проявления их металлических свойств? Назовите химический элемент, образующий простое вещество - самый активный металл. У каких элементов из сравниваемых ниже пар металлические свойства выражены более заметно: а) Be и Mg, б) Mg и Al? Из указанных трех металлов выберите те, которые растворимы не только в кислотах, но и в сильных основаниях (щёлочах). Ответ аргументируйте, а также проиллюстрируйте его уравнениями соответствующих реакций в молекулярной и ионной формах. 323. Как можно объяснить такие свойства металлов, как электропроводность, теплопроводность, пластичность, металлический блеск? От чего зависят такие свойства металлов, как механическая прочность, плотность, температура плавления? 324. Какие металлы называются ферромагнетиками, парамагнетиками и диамагнетиками? Приведите примеры. 325. 3акончите следующие уравнения реакций:
Ca+H2O= Zn+NaOH+H2O= CH3OH+Na= CH3-C6H4-OH+Na= 326. Опишите наблюдаемые особенности поведения металлов при взаимодействии их с разбавленной и концентрированной серной кислотой. Какие металлы и почему окисляются концентрированной H2SO4? Как различаются продукты окисления в зависимости от активности реагирующего металла? Приведите молекулярные и электронные уравнения реакций меди с разбавленной и концентрированной серной кислотой. 327. Какие свойства металлов лежат в основе образных литературных выражений: серебряный иней, золотая заря, свинцовые тучи, стальной характер, железные нервы, золотое сердце, металлический голос, свинцовый кулак? Почему металлы проводят электрический ток?
328. Как ведут себя различные металлы в отношении разбавленной и концентрированной азотной кислоты? В каких случаях, как и почему результат этого воздействия зависит от активности металла? Приведите примеры реакций одного из металлов с разбавленной и концентрированной HNO3; составьте соответствующие уравнения электронного баланса. Назовите металлы, которые не реагируют с этой кислотой. 329. Выберите правильные ответы. Напишите уравнения реакций. Медь реагирует с: хлором, соляной кислотой, концентрированной серной кислотой, нитратом свинца, гидроксидом калия.
330. Выберите правильные ответы. Напишите уравнения реакций. Магний реагирует с: кислородом, гидроксидом калия, иодидом калия, концентрированной серной кислотой, разбавленной серной кислотой.
331. Выберите правильные ответы. Напишите уравнения реакций. С раствором сульфата никеля реагирует: медь, цинк, олово, алюминий, железо.
332. Выберите правильные ответы. Напишите уравнения реакций. С соляной кислотой не реагирует: ртуть, цинк, серебро, натрий, железо.
333. Чтобы осуществить цепочку превращений: медь → хлорид меди (II) → нитрат меди (II) → медь необходимо последовательно использовать: а) соляная кислота, азотная кислота, серебро; б) хлор, нитрат железа (III), серебро; в) хлор, нитрат серебра, железо; г) соляная кислота, азотная кислота, железо.
334. Для осуществления превращений в соответствии со схемой: Al (амальгама) → Al(OH)3 → Al(NO3)3 необходимо последовательно использовать: а) воду и азот; б) гидроксид калия и азотную кислоту; в) воду и азотную кислоту; г) гидроксид калия и нитрат калия.
335. Напишите уравнения реакций в молекулярном и ионном видах:
а) ZnCl + Mg = б) Al + CuSO4 = в) Fe + O2 = г) Ba + HBr = д) K + H2O = 336. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
337. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Сa → СаO → Сa(OH)2 → СaСО3 → СаO → CaCl2 → Ca3(PO4)2. 338. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Al → AlCl3 → Al(ОН)3 → Al2O3 → NaAlО2 → Al2(SO4)3 → Al(ОН)3 → AlCl3. 339. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Fe → FeCl2 → Fe(ОН)2 → Fe(ОН)3 → Fe2O3 → Fe. 340. Какой из металлов способен вытеснять водород из воды при комнатной температуре? а) медь, б) железо, в) натрий, г) серебро. Какой металл не будет взаимодействовать с водой? а) кальций, б) хром, в) литий, г) натрий.
ПОЛИМЕРЫ
341. Полимером какого непредельного углеводорода является натуральный каучук? Напишите структурную формулу этого углеводорода. Как называют процесс превращения каучука в резину? Чем по строению и свойствам различаются каучук и резина?
342. Напишите уравнения реакций получения ацетилена и превращения его в ароматический углеводород. При взаимодействии какого вещества с ацетиленом образуется акрилонитрил? Составьте схему полимеризации акрилонитрила. 343. К синтетическим органическим полимерам относится… 1) протеин 2) тефлон 3) крахмал 4) целлюлоза. Составьте схему полимеризации винилхлорида.
344. Как получают в промышленности стирол? Приведите схему его полимеризации. Изобразите с помощью схем линейную и трехмерную структуры полимеров.
345. Какой полимер получается при сополимеризации стирола и бутадиена? Составьте схему сополимеризации. Приведите примеры биополимеров.
346. Составьте схему полимеризации изопрена. Какие полимеры называются термопластичными, термореактивными? Укажите три состояния полимеров. Чем характеризуется переход из одного состояния в другое?
347. Составьте схему образования каучука из дивинила и стирола. Что такое вулканизация? При взаимодействии какого вещества а ацетиленом образуется акрилонитрил? Составьте схему полимеризации акрилонитрила.
348. Что такое полимеризация, поликонденсация? Чем отличаются друг от друга эти реакции? Приведите примеры.
349. Для улучшения механических свойств полимеров в их состав вводят: а) разрыхлители в) катализаторы б) наполнители г) стабилизаторы. Как называется полимер, полученный при взаимодействии терефталевой кислоты и этиленгликоля? Напишите реакцию полимеризации.
350. К синтетическим полиамидным волокнам относятся: а) вискоза, лавсан, капрон в) только капрон б) капрон, найлон, энант г) найлон, лавсан, капрон. Приведите пример полимера изотактического строения.
351. Высокомолекулярные соединения, из которых получают лавсан – это: а) полиэтилен в) полиэфир б) полиуретан г) полистирол. Напишите формулу найлона – 6,6.
352. Капрон получают полимеризацией: а) этилена в) виниловых эфиров б) формальдегида г) капролоктама. Как получают искусственные полимеры?
353. На основе фенол-формальдегидных смол получают: а) фторопласты в) пенопласты б) фенопласты г) пентапласты. Напишите формулу капрона.
354. Фенолформальдегидные смолы – это продукты поликонденсации: а) фенола и формальдегида в) фенола и ацетальдегида б) нафтола и ацетальдегида г) нафтола и формальдегида. Напишите реакцию получения поливинилхлорида.
355. Тефлон относится к: а) хлоропластам в) полиэтиленам б) полиэфирам г) фторопластам. Приведите примеры синтетического, искусственного и природного полимеров.
356. Вещества, которые предотвращают прилипание полимера к оборудованию – это: а) соосаждающие вещества в) индикаторы б) отвердители г) смазывающие вещества. Рассчитайте степень полимеризации полипропилена, если его масса 210000 г.
357. Мономером для получения поливинилхлорида является: а) хлорэтен в) хлористый алкин б) 1,1- дихлорэтен г) бромэтен. Какие полимеры относятся к карбоцепным? Приведите примеры.
358. Технический продукт превращения каучука: а) гуттаперча в) резина б) ликопин г) латекс. Напишите реакцию получения полистирола.
359. Реакцию, в которую вступают смеси полимеров называют смешанной полимеризацией или: а) димеризацией в) сополимеризацией б) тримеризацией г) ионизацией. Напишите реакцию получения полиэтиленбензола.
360. Исходные низкомолекулярные вещества в процессе полимеризации называются: а) олигомеры в) димеры б) мономеры г) триммеры Приведите по три примера природных и синтетических полимеров. Приведите один пример искусственного полимера и укажите, из какого природного полимера его можно получить. ДИСПЕРСНЫЕ СИСТЕМЫ 361. Какой объем 0,001 н. раствора BaCl2 надо добавить к 0,03 л 0,001 н. раствора K2CrO4, чтобы получить положительно заряженные частицы золя BaCrO4? Составьте формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат калия или фосфат калия. Поясните выбор.
362. Золь Al(OH)3 получен при добавлении к 0,005 л 0,001 н. раствора AlCl3 0,002 л 0,0015 н. раствора NaOH. Напишите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: нитрат калия, сульфат магния или фосфат калия. Поясните выбор. 363. Какой объем 0,0025 н. раствора KI надо добавить к 0,035 л 0,003 н. раствора Pb(NO3)2, чтобы получить золь PbI2, противоионы которого двигались бы в электрическом поле к аноду? Напишите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид натрия, сульфат натрия или фосфат калия. Поясните выбор. 364. Какой объем 0,001 н. раствора Na2SO4 надо добавить к 0,01 л 0,00045 н. раствора BaCl2, чтобы получить отрицательно заряженные частицы золя BaSO4? Напишите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат железа (II) или сульфат железа (III). Поясните выбор. 365. Золь HgI2 получен смешиванием равных объемов 0,005 M раствора KI и 0,0005 М раствора Hg(NO3)2. Напишите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид магния, нитрат калия или хлорид хрома. Поясните выбор. 366. Золь Mg3(РО4)2 получен при добавлении к 0,015 л 0,002 н. раствора Na3PO4 0,005 л 0,004 н. раствора MgCl2. Укажите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат меди или нитрат алюминия. Поясните выбор.
367. Золь Zn(OH)2 получен при взаимодействии растворов КОН и ZnCl2. Составьте формулу мицеллы золя, если противоионы движутся в электрическом поле к катоду. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: ацетат калия, сульфат никеля или сульфат хрома. Поясните выбор.
368. Золь Cu(OH)2 получен при взаимодействии растворов КОН и CuCl2. Напишите формулу мицеллы золя, если известно, что противоионы движутся в электрическом поле к аноду. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: иодид калия, карбонат калия или фосфат натрия. Поясните выбор. 369. Золь Ag2S получен при добавлении к 0,015 л 0,003 н. раствора Na2S 0,035л 0,0005 н. раствора AgNO3. Напишите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат цинка или фосфат калия. Поясните выбор.
370. Золь Fe(OH)3 получен смешиванием равных объемов 0,0001 н. раствора KOH и 0,00015 н. раствора FeCl3. Укажите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: нитрат свинца, сульфат марганца или фосфат калия. Поясните выбор. 371. Золь СuS получен смешиванием равных объемов 0,001 н. раствора K2S и 0,0005 н. раствора CuSO4. Напишите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат калия или нитрат висмута. Поясните выбор. 372. Золь СdS получен смешиванием равных объемов 0,003 н. раствора Cd(NO3)2 и 0,0004 н. раствора K2S. Напишите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: ацетат натрия, силикат калия или фосфат натрия. Поясните выбор. 373. Золь ВаСО3 получен при добавлении к 0,02 л 0,003 н. раствора BaCl2 0,01 л 0,005 н. раствора Na2CO3. Укажите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: фторид натрия, сульфит калия или фосфат калия. Поясните выбор. 374. Золь Сr(OH)3 получен смешиванием равных объемов 0,001 М раствора CrCl3 и 0,002 н. раствора NaOH. Напишите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: нитрит калия, сульфат калия или фосфат натрия. Поясните выбор. 375. Золь Са3(РО4)2 получен смешиванием равных объемов 0,002 н. раствора CaCl2 и 0,0003 М раствора Na3PO4. Составьте формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: цианид калия, сульфат магния или фосфат калия. Поясните выбор. 376. Золь кремниевой кислоты H2SiO3 получен при взаимодействии растворов К2SiO3 и HCl. Укажите формулу мицеллы золя, если его противоионы движутся в электрическом поле к катоду. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: ацетат магния, силикат натрия или сульфат алюминия. Поясните выбор. 377. Золь MnS получен при добавлении к 0,02 л 0,0001 н. раствора Na2S 0,01 л 0,00015 н. раствора MnSO4. Напишите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид лития, нитрат меди или нитрат висмута. Поясните выбор. 378. Золь Ag3PO4 получен при взаимодействии растворов К3PO4 и AgNO3. Напишите формулу мицеллы золя, если его противоионы движутся в электрическом поле к катоду. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид кальция, хлорид аммония или нитрат алюминия. Поясните выбор.
379. Золь As2S3 получен смешиванием равных объемов 0,0002 н. раствора Na2S и 0,00005 M раствора AsCl3. Укажите формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: хлорид калия, сульфат кобальта или нитрат хрома. Поясните выбор. 380. Какой объем 0,002 н. раствора MgCl2 надо добавить к 0,02 л 0,0025 н. раствора K2S, чтобы получить положительно заряженные частицы золя MgS? Составьте формулу мицеллы золя. Какой из перечисленных электролитов будет обладать более сильным коагулирующим действием: ацетат цинка, сульфид калия или фосфат натрия. Поясните выбор.
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
381. В соляную кислоту поместилисплав меди с цинком массой 20 грамм, массовая доля цинка в сплаве - 12 процентов, рассчитайте объём водорода, который выделится в реакции.
382. При сливании гидроксида калия и сульфата меди (II), получили 9,8 грамм осадка. Осадок отфильтровали, высушили и подвергли термическому разложению. Напишите реакции. Определите количество образующегося оксида меди (II).
383. Вычислите массу хлорида натрия и воды, необходимых для приготовления 500 г раствора, в котором содержание хлорида натрия в массовых долях равно 5%.
384. В серной кислоте при нагревании полностью растворили оксид меди, массой 4 г. Рассчитайте массу и количества вещества соли.
385. В 80 г 20%-ного раствора хлорида натрия растворили 10 г той же соли. Определите массовую доля хлорида натрия в полученном растворе.
386. Вычислите массу осадка, образующегося при взаимодействии 180г 10 % раствора поваренной соли с нитратом серебра. 387. 3,17 г хлора занимают объем равный 1 л (при н.у.). Вычислите по этим данным молекулярную массу Cl2. 388. При взаимодействии металлического натрия с водой выделилось 280 мл водорода (при н. у.). Сколько граммов натрия вступило в реакцию? 389. Найдите объем водорода, выделившегося в ходе реакции:
Mg + 2HCl = MgCl2 + H2
Известно, что масса Mg, взятого для реакции, была 4,8 г.
390. Для восстановления меди из оксида меди (II) израсходован водород объемом 1,12 л (н.у.). Рассчитайте массу полученной меди.
391. Какова масса нитрата меди, образующегося при взаимодействии оксида меди (II) с азотной кислотой?
392. Вычислить объем оксида углерода (IV), полученный при сгорании ацетилена объемом 10 л (н.у.). 393. Рассчитайте, какую массу меди можно получить при восстановлении 8г оксида меди (II) водородом. Какой объём водорода необходимо для этого использовать.
394. Вычислить массу чистого железа, которое можно получить при восстановлении железной окалины Fe3O4 массой 50г, содержащей 0,072 массовой доли примесей, водородом. 395. Для нейтрализации 30 мл 0,1 н. раствора щелочи потребовалось 10 мл раствора кислоты. Определите нормальность кислоты.
396. Вычислить, какой объём оксида углерода (IV) (н.у.) выделиться при обработке азотной кислотой известняка массой 400г, содержащего 25% примесей.
397. К 27г раствора хлорида меди () с массовой долей 10% добавили избыток раствора сульфида натрия. Определите массу выпавшего осадка. 398. К 300г 15% раствора КОН прибавили 250 г воды. Определить процентную концентрацию полученного раствора.
399. Сколько Н2О необходимо прибавить к 200 мл 20% р-ра Н2SO4 (ρ=1,14), чтобы получить 5% раствор?
400. Сколько граммов 30% раствора гидроксида калия надо прибавить к 200 г 90% раствора, чтобы получить 50% раствор?
Приложения
Таблица 1 Термодинамические константы веществ
Таблица 2 Константы диссоциации некоторых слабых электролитов
Таблица 3
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 128; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.198.113 (0.012 с.) |