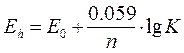Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамика химических превращенийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Химическое превращение есть качественный скачок, при котором исчезают одни вещества и образуются другие. При этом происходит перестройка электронных структур атомов, ионов, молекул, что сопровождается выделением или поглощением энергии. Таким образом, при химической реакции происходит преобразование химической энергии в другой вид энергии. Энергетические эффекты химических реакций изучает термохимия. В основе термохимических расчетов лежит закон Гесса – суммарный тепловой эффект ряда последовательных химических реакций равен тепловому эффекту любого другого ряда реакций с теми же самыми начальными и конечными продуктами. Теплоты (энтальпии) образования. По теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ. Стандартные теплоты образования обозначают DНообр.298. Теплоты образования простых веществ в стандартных условиях приняты равными 0. Согласно закону Гесса тепловой эффект реакции равен сумме теплот (энтальпий) образования продуктов реакции за вычетом теплот образования исходных веществ. В настоящее время теплоты образования известны примерно для 4000 веществ, что позволяет чисто расчетным путем устанавливать тепловые эффекты различных химических реакций.
Большинство химических реакций представляет собой два одновременно протекающих явления: передачу энергии и изменение в упорядоченности расположения частиц относительно друг друга. Количественно степень беспорядка системы измеряется энтропией (S). Энтропия возрастает при переходе жидкости в пар, при растворении кристаллического вещества. Во всех этих случаях наблюдается уменьшение порядка в относительном расположении частиц (элементов системы). Наоборот, в процессах кристаллизации или конденсации за счет упорядочивания структуры системы энтропия уменьшается.
Направленность реакции. В химических процессах одновременно действуют две тенденции – стремление частиц объединиться в более сложные, что уменьшает энтропию и стемление частиц разъединиться, что энтропию увеличивает. Суммарный эффект этих двух процессов, протекающих при постоянных температуре и давлении отражает изменение изобарно-изотермического потенциала DG (энергии Гиббса):
DG=DH-TDS
Химический процесс принципиально осуществим, если реакция протекает с уменьшением химического потенциала, который есть изобарный потенциал, или энергия Гиббса, т. е. возможность протекания реакции определяется неравенством DGреакции < 0,
где DGреакции - изменение энергии Гиббса при превращении исходных веществ в продукты. DGреакции = SDGобр. продуктов реакции - SDGобр. реагентов
В справочной литературе по термодинамике приведены значения стандартных энергий Гиббса (DG 298обр) образования веществ при температуре 298 К (25оС). Зависимость энергии Гиббса от температуры: DGреакции = DHреакции - TDSреакции где DHреакции, DSреакции - изменения энтальпии и энтропии.
Таким образом, самопроизвольная химическая реакция идет с уменьшением энтальпии системы и увеличением ее энтропии. Процессы протекающие с уменьшением энтальпии (выделение тепла) и увеличением энтропии необратимы.
Химическое равновесие
Согласно закону действия масс, направление химической реакции зависит от концентрации реагирующих веществ и продуктов реакции. Химическая система считается равновесной, если скорости протекания прямой и обратной реакции равны. Рассмотрим реакцию:
bB + cC = dD + eE где B, C - реагирующие вещества; D, E - продукты реакции; b,c,d,e - число молей (стехиометрические коэффициенты). Скорость прямой реакции, согласно закону действия масс:
V 1 = k1 *[B]b * [C]c обратной
V 2 = k2 *[D] d *[E] e
где [B],[C],[D],[E] - концентрации веществ; k1,k 2 - соответственно коэффициенты скорости прямой и обратной реакции.
Отношение
называется термодинимической константой равновесия (К). Стандартная свободная энергия реакции связана с константой равновесия К равенством:
DGреакции = - R×T×lnK При значении универсальной газовой постоянной R = 0,008314 Дж/моль ×К, Т = 298.15оК:
DGреакции = - 5,7 lgK
Из этого соотношения понятно, что DGреакции < 0 возможно лишь при К >> 0, т.е. когда равновесие реакции смещено в сторону образования продуктов реакции. Для окислительно-востановительных реакций стандартная свободная энергия реакции определяется соотношением:
DGреакции = n ×E0 × F где n - число участвующих в реакции электронов; Е0 - стандартный окислительный потенциал реакции (при концентрации реагирующих веществ 1 М); F - число Фарадея, кДж/в г-экв (F = 96,39 кДж/в г-экв). Для условий отличающихся от стандартных, окислительный потенциал реакции (Еh) определяется уравнением Нернста:
Eh = E0 + R×T×lnK/n× F После подстановки значений постоянных величин R,T,F:
Данные соотношения позволяют по величине DGреакции вычислить К и определить состояние системы в стадии равновесия. Рассмотрим методику определения условий очистки сточных вод от ионов токсичных металлов при осаждении их в виде гидроксидов. В качестве критерия при определении граничных условий рН примем значения ПДК для рыбохозяйственных и хозяйственно – питьевых водоемов. Рассмотри в качестве примера определение условий осаждения гидроксида кадмияz Cd(OH)2. ПДК для ионов кадмия в водоемах рыбохозяйственной категории – 0,001 мг/л, в водоемах хозяйственно-питьевых – 0.005 мг/л. Реакция растворения Cd(OH)2. описывается уравнением: Cd(OH)2 +2H+ Û Cd2+ + 2H2O Константа скорости реакции:
Прологарифмируем данное уравнение и после преобразования получим:
Значение lgK определяется из соотношения:
DFoреакции = - 5,7 lgK
DFoреакции =(DFoобр.(Cd2+) + 2DFoобр.(H2O)) - (2DFoобр.(H+) + +DFoобр.(Cd(OH)2)) = = (-77,74- 2*-236,94) – (2*0 - 473,8) = -77,82 кДж/моль Тогда lgK = 13,65 Для вычисления величины рН, при которой растворение Cd(OH)2 приведет к созданию концентраций иона Cd2+ на уровне ПДК пересчитаем мг/л в г-ион/л: [Cd2+]=ПДК/(1000*112.4), где 112.4 – атомная масса Cd [Fe2+]рх =0,001/(1000*112.4)= 8.9×10-9 г-ион/л [Fe2+]хп =0,005/(1000*112.4)= 4.45×10-8 г-ион/л Тогда граничные условия по величине рН будут: Для ПДКрх рН=10.85; для ПДКхп рН=10.5. Таким образом, граничные условия по рН для гидроксида кадмия лежат в сильнощелочной области.
Скорость химических реакций
Изменение изобарного потенциала (энергии Гиббса) позволяет судить о принципиальной возможности протекания химической реакции. Однако значение DGреакц. ничего не говорит о том, с какой скорость эта реакция протекает. К примеру, реакция взаимодействия оксида азота с кислородом протекает практически мгновенно: 2NO + O2 = 2NO2 DG298 = -150 кДж
Реакция взаимодействия водорода с кислорода в обычных условиях практически не идет: 2Н2 + О2 = 2Н2О DG298 = -456,5 кДж
хотя величина DG298 в три раза больше. В присутствии катализатора или при температуре 700оС реакция идет мгновенно со взрывом. Таким образом, для полного описания химической реакции с целью последующего управления ее протеканием, необходимо знать ее механизм и закономерность ее протекания во времени. Скорость и механизм протекания химических реакций изучает химическая кинетика. Все химические реакции разделяются на гомогенные и гетерогенные. Гомогенные протекают в одной фазе, гетерогенные – в неоднородной среде, состоящей из двух или трех фаз. Гомогенные реакции протекают во всем объеме, заполненном реагентами, а гетерогенные – только на границе раздела фаз.
|
||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 558; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.012 с.) |