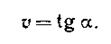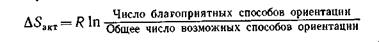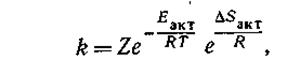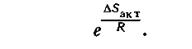Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
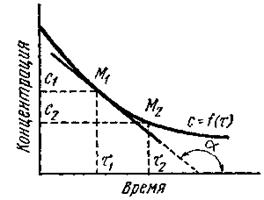
Скорость реакции обычно характеризуют изменением концентрации какого-либо из исходных или конечных продуктов реакции в единицу времени.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
О скорости реакции можно судить также по скорости изменения какого-либо свойства системы, например, окраски, электропроводности, давления, спектра и т. д. Если в моменты времени t1 и t2 концентрации одного из исходных веществ равны с1 и с2, то среднюю скорость v в интервале времени t1 и t2 можно выразить как
Поскольку речь идет об убыли концентрации исходного вещества, изменение концентрации в этом случае берется со знаком минус. Если скорость реакции оценивается увеличением концентрации одного из продуктов реакции, то производная берется со знаком плюс. В ходе химических процессов концентрации веществ меняются непрерывно. Поэтому важно знать величину скорости реакции в данный момент времени, т. е. мгновенную скорость реакции. Последняя выражается первой производной концентрации по времени:
Скорость химических превращений зависит от природы реагирующих веществ, их концентраций и внешних условий. Молекулярность реакции. В элементарном акте реакции могут принимать участие одна, две или три молекулы. По этому признаку различают одномолекулярные, двухмолекулярные и трехмолекулярные реакции. Примером двухмолекулярной реакции является Н2 + J2 = 2НJ трехмолекулярной 2NО (г) + С12 (г) = 2NОС1 (г) Вероятность одновременного соударения большего числа частиц очень мала, поэтому даже трехмолекулярные реакции весьма редки, а четырехмолекулярные неизвестны. В соответствии со сказанным в большинстве случаев стехиометрическое уравнение не определяет характера протекания реакции, т. е. ее механизма. Большинство реакций состоит из ряда более простых элементарных стадий, которые сами протекают по одно-, двух- или трехмолекулярному механизму. Даже реакции с относительно простым стехиометрическим уравнением часто оказываются более сложными, чем это можно было бы заключить по уравнению реакции. Например, реакция Н2 (г) + С12(г)=2НС1 (г) в противоположность реакции взаимодействия Н2 и J2 в действительности протекает очень сложно и к двухмолекулярным не относится. Закон действующих масс. Скорость гомогенных реакций зависит от числа встреч реагирующих частиц в единицу времени в единице объема. Вероятность одновременного соударения взаимодействующих частиц в свою очередь пропорциональна произведению концентраций реагирующих веществ.
Таким образом, скорость реакции пропорциональна произведению концентраций реагирующих веществ. Указанная закономерность называется законом действующих масс (Гульдберг и Вааге). Для двухмолекулярной реакции взаимодействия водорода и иода Н2(г) +J2(г) = 2НJ(г) закон действующих масс выражается в виде следующего кинетического уравнения:
v = k×CH2×CJ2
где v — скорость реакции; CH2×CJ2— концентрации соответственно Н2 и J2. Кинетическое уравнение для трехмолекулярной реакции 2NO(г) + С12 (г) = 2NОС1 (г) будет
v = k×CNO2×CJ2
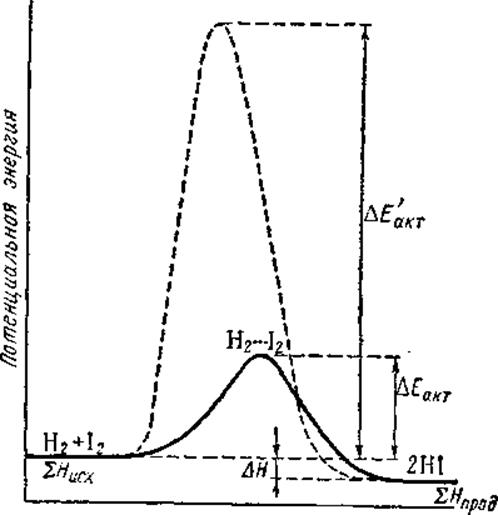
Коэффициент пропорциональности k называется константой скорости реакции. Величина k численно равна скорости реакции, когда концентрации реагирующих веществ равны единице. Константа скоростй реакции зависит от природы реагирующих веществ и от температуры. Энергия активации. Для того чтобы совершился элементарный акт химического взаимодействия, реагирующие частицы должны столкнуться друг с другом. Однако далеко не каждое столкновение частиц приводит к их химическому взаимодействию. Последнее происходит в том случае, когда частицы приближаются на расстояние, при котором становится возможным перераспределение электронной плотности и возникновение новых химических связей. Следовательно, сталкивающиеся частицы должны обладать энергией, достаточной для преодоления сил отталкивания (энергетического барьера), возникающих между их электронными оболочками. Такие реакционноспособные частицы называют активными, а энергия, необходимая для преодоления энергетического барьера,— энергией активации реакции. Группировку частиц, находящихся в процессе взаимодействия (т. е. перераспределения связей), называют активным комплексом. Таким образом, при химическом превращении переход системы из энергетического состояния SНисх в состояние SНпрод осуществляется через некоторый энергетический барьер Еакт. Разность первоначального и конечного уровней энергии системы составляет тепловой эффект реакции DН. Так, на рисунке изображена энергетическая схема хода реакции
Н2(г) +J2(г) = 2НJ(г)
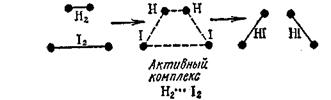
По оси ординат отложена потенциальная энергия системы. В качестве абсциссы использована так называемая координата реакции (реакционный путь), которая в первом приближении характеризует изменения в межъядерных расстояниях взаимодействующих частиц. Рассматриваемая реакция протекает следующим образом. Активные молекулы Н2 и J2 при столкновении объединяются в промежуточный активный комплекс Н2...J2. В этом комплексе связи Н—J начинают образовываться одновременно с разрывом связей Н-Н и J-J:
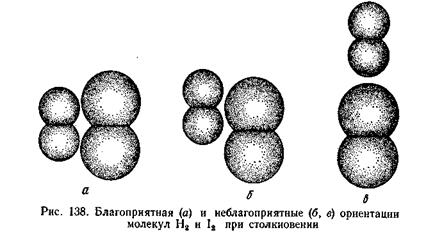
В результате энергия активации (168 кдж) оказывается меньше, чем энергия, необходимая для полного разрыва связей в исходных молекулах (571 кдж). Иными словами, путь реакции через образование активного комплекса энергетически более выгоден, чем путь через полный разрыв связей вступающих в реакцию молекул. Поэтому-то подавляющее большинство реакций и проходит через образование промежуточных активных комплексов. Таким образом, энергия активации — это энергия, необходимая для превращения реагирующих веществ в состояние активного комплекса. Для эндотермического процесса распада 2НJ (г) = Н2 (г) + J2 (г), DH=17 кдж реакционный путь будет обратным пути экзотермической реакции синтеза HJ. Как видно из рисунка, в этом случае начальному состоянию системы соответствует уровень энергии SDH прод, конечному SНисх, а энергия активации реакции составляет.Еакт+DH (185 кдж). Энтропия активации. Кроме энергии активации важным условием осуществления химической реакции является ориентация молекул в момент столкновения. Перераспределению электронной плотности в активном комплексе более всего благоприятствует условие, когда молекулы ориентированы как показано на рисунке (а). При ориентации (б) гораздо меньше вероятность протекания реакции.
Для рассматриваемой реакции вероятность пространственно благоприятных столкновений активных молекул составляет 0,1 от общего числа столкновений. Поэтому реакция между молекулами водорода и иода протекает сравнительно медленно, хотя для ее осуществления требуется небольшая энергия активации. Таким образом, для осуществления реакции молекулы при столкновении должны быть определенным образом ориентированы и обладать достаточной энергией. Вероятность надлежащей ориентации при столкновении характеризуют с помощью энтропии активации DSакт. Последняя пропорциональна отношению числа благоприятных способов ориентации к общему числу способов ориентации:
Очевидно, чем жестче требования ориентации, тем меньше (более отрицательной) делается величина DSакт. Влияние температуры. Зависимость скорости реакции от температуры, энергии активации и энтропии активации определяется следующим выражением для константы скорости реакции:
где Z — в первом приближении общее число столкновений между молекулами в секунду*; Т — абсолютная температура; R — газовая постоянная; е — основание натуральных логарифмов.
Вероятность того, что столкнувшиеся молекулы будут иметь достаточную энергию взаимодействия пропорциональна величиене:
Из уравнения для К видно, что, поскольку Т входит в показатель степени, скорость химической реакции очень чувствительна к изменению температуры. Например, при повышении температуры на 100° скорость реакции
Н2 (г) + J2 (г) = 2НJ(г) возрастает примерно в 1000 раз. Опытные данные свидетельствуют о справедливости правила Вант-Гоффа: при повышении температуры на каждые 10° скорость реакции увеличивается примерно в 2—4 раза. Из уравнения для К также следует, что чем больше энергия активации, тем значительнее влияние температуры на скорость реакции.
Механизм химических реакций В зависимости от природы реагирующих веществ и условий их взаимодействия в элементарных актах реакций могут принимать участие атомы, молекулы, радикалы или ионы. В соответствии с этим по механизму протекания различают простые, ионные и радикальные реакции. Простыми называют реакции, протекающие непосредственно между молекулами, например: Н2 (г)+ J2(г) = 2НJ (г) 2NO (г) + С12 (г) = 2NOС1 (г) Для протекания большинства подобных реакций требуется высокая энергия активации (150—450 кдж/моль), поэтому реакции между валентнонасыщенными молекулами весьма редки. Гораздо чаще элементарные акты химического взаимодействия совершаются с участием ионов и радикалов. Вследствие этого суммарные уравнения в большинстве случаев не отражают истинного механизма реакций. Поскольку в ионных реакциях принимают участие заряженные частицы, энергия активации реакций ионов с молекулами и в особенности между ионами противоположного знака незначительна (0 - 80 кдж/моль). Ионы образуются не только при растворении веществ в ионизирующих растворителях, но и под действием на вещество электроразряда, нагревания, излучений достаточной энергии и др. При этом молекулы могут терять электроны и переходить в молекулярные ионы. Так, под действием гамма-лучей молекулы воды и метана превращаются в молекулярные ионы Н2О+ и СН4+: H2O +g ® H2O+ + е- CH4 +g ®CH4+ + е-
Возможно образование также отрицательно заряженных молекулярных ионов. Поскольку молекулярные ионы имеют неспаренные электроны и обладают зарядом, они чрезвычайно реакционноспособны; в обычных условиях существуют лишь миллионные доли секунды. Радикальными называются реакции с промежуточным образованием свободных радикалов и атомов. Свободными радикалами являются валентноненасыщенные частицы, которые можно представить как осколки молекул, например, ·ОН (осколок от Н2О), ·NН2 (осколок от NH3), ·SН (осколок от Н2S) и т. д. К свободным радикалам относятся и свободные атомы. Свободные радикалы чрезвычайно реакционноспособны, а энергия активации радикальных реакций очень мала (0 — 40 кдж/моль). Например, для реакций
·Cl + H2 Þ HCl + ·H Еакт = 24 кдж/моль H2 + ·Cl Þ HCl + ·Cl Еакт = 8 кдж/моль Образование свободных радикалов может происходить в процессе распада вещества при нагревании, освещении, под действием ядерных излучений, от сильных механических воздействий, при электроразряде и т. д. Свободные радикалы рождаются также в процессе самых разнообразных химических превращений. Цепные реакции. Радикальные реакции обычно протекают по ц е п н о м у механизму. Особенность цепных реакций состоит в том, что один первичный акт активации приводит к превращению огромного числа молекул исходных веществ. В качестве примера радикально-цепной реакции рассмотрим взаимодействие хлора с водородом: Н2(г)+С12(г) = 2НС1(г)
При обычной температуре и рассеянном освещении реакция протекает крайне медленно. При нагревании смеси газов или действии света, богатого ультрафиолетовыми лучами (прямой солнечный, свет горящего магния и др.), смесь взрывается. Как показали многочисленные исследования, эта реакция проходит через отдельные элементарные процессы. Прежде всего, за счет поглощения кванта энергии ультрафиолетовых лучей (или за счет нагревания) молекула хлора диссоциирует на свободные радикалы — атомы хлора:
Cl2 + hn Þ·Cl + ·Cl
Валентноненасыщенный атом-радикал ·С1 затем реагирует с молекулой водорода, образуя молекулу НС1 и атом-радикал ·Н. Последний, взаимодействуя с молекулой С12, дает НС1 и атом-радикал ·С1 и т. д. Таким образом, превращение исходных веществ в конечный продукт протекает через последовательную цепь элементарных актов, что можно представить следующей схемой:
·Cl + H2 Þ HCl + ·Н + Cl2 Þ HCl + ·Cl + H2 Þ HCl + ·Н
Длина цепи элементарных химических актов достигает сотен тысяч звеньев. Так, при освещении смеси Н2 и С12 на каждый поглощенный квант энергии образуется до ста тысяч молекул НС1. Естественно, возможны и столкновения свободных радикалов друг с другом, что приводит к обрыву цепей:
·Н + ·НÞ H2 ·Cl +·Cl Þ Cl2
Однако такой вариант протекания процесса возможен лишь в том случае, если выделяемая энергия поглощается третьим телом (молекулой) или отводится через стенки сосуда. По цепному механизму с разветвлением цепи протекает реакция между кислородом и водородом с образованием воды. При нагревании или электрическом разряде в смеси Н2 + О2 протекает реакция: Н2 + О2 + Е Þ ·ОН + ·ОН Свободные радикалы ·ОН взаимодействуют с Н2: Н2 + ·ОНÞ Н2О + ·Н Радикал ·Н взаимодействует с О2 с образованием двух радикалов: ·Н + О2 Þ ·ОН + ·О· Радикал ·О· взаимодействует с Н2 с образованием 2 радикалов: Н2 + ·О· Þ ·ОН +·ОН Таким образом, когда в результате последних реакций образуются вместо одного два радикала, количество активных частиц резко возрастает и резко возрастает скорость реакции.
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 411; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.249.160 (0.01 с.) |

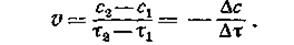
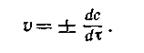 или
или