
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизмы химических реакцийСодержание книги
Поиск на нашем сайте Все реакции можно подразделить на простые и сложные. Простые протекают в одну стадию и называются одностадийными. Сложные реакции либо идут последовательно (многостадийные реакции), либо параллельно, либо последовательно–параллельно. Реакции идут по стадиям. Невозможно представить себе, что в реакции образования аммиака N2 + 3H2 = 2NH3 одновременно столкнутся в одной точке пространства четыре молекулы, да еще нужного сорта. Количество частиц, принимающих участие в элементарном акте химического превращения, называется молекулярностью реакции. Реакции могут быть моно-, би- и тримолекулярными (не больше). Мономолекулярные – реакции разложения и внутримолекулярные перегруппировки: (J2) = 2(J). Бимолекулярные: 2NO2 = N2O4 . Тримолекулярные (редкие): 2NO + O2 = 2NO2. В этих примерах порядок и молекулярность совпадают, но в общем случае они различны. 1.8.1 Последовательные реакции Последовательными называют реакции с промежуточными стадиями, когда продукт предыдущей стадии служит исходным веществом для последующей: k1 k2 А à B à C. При k1>>k2 все исходное вещество может превратиться в промежуточный продукт В, прежде чем начнется вторая реакция. Скорость всей реакции определяется второй стадией. При k1<<k2 концентрация промежуточного продукта мала, поскольку он не успевает накапливаться; эта стадия определяет скорость реакции в целом. Таким образом, скорость определяется самой медленной стадией (принцип лимитирующей стадии). 1.8.2 Параллельные реакции Реакции, в которых исходные вещества способны образовывать разные продукты реакции, называются параллельными.
Например, разложение гидразина: N2H4àN2+2H2; 3N2H4à4NH3+N2. В этом случае суммарная скорость реакции разложения гидразина равна сумме скоростей по тому и другому пути. 1.8.3 Сопряженные реакции Сопряженные реакции – это реакции, в которых с одним и тем же веществом взаимодействуют два и более веществ. A+BàAB A+D=AD 1.8.4 Колебательные реакции В последние годы уделяется большое внимание периодическим процессам, характеризующимся колебаниями концентраций некоторых промежуточных соединений и соответственно скоростями превращения – такие реакции называют колебательными. Наблюдаются такие процессы в газовой и жидкой фазах и особенно часто на границе раздела этих фаз с твердой фазой. Колебательными чаще всего бывают окислительно-восстановительные реакции, а также реакции, сопровождающиеся появлением новой фазы вещества. Причиной возникновения колебаний концентрации является наличие обратных связей между отдельными стадиями сложной реакции. Пример: реакция, открытая Б.П.Белоусовым – взаимодействие лимонной кислоты с броматом, ускоряемое ионами церия. Раствор регулярно изменяет окраску от бесцветного катализатора (Ce III) к желтому (Ce IV) и обратно. Эти процессы объясняются на основе термодинамики необратимых процессов, крупный вклад в развитие теории колебательных реакций внес И.Р.Пригожин. Цепные реакции К цепным реакциям относят реакции, протекающие с образованием свободных радикалов, способных превращать реагенты в конечные продукты, поддерживая постоянство свободных радикалов или даже увеличивая их (разветвленная цепная реакция). В цепных реакциях выделяют три стадии: зарождение цепи, ее развитие и обрыв. Зарождение (инициирование) происходит под воздействием светового, радиационного, термического или другого воздействия. Примером неразветвленной цепной реакции может служить реакция H2 + Br2 = 2HBr, инициирование которой определяется термодиссоциацией. Инициирование:
Рост цепи (разветвление):
Обрыв цепи:
Эта последовательность процессов продолжается дальше: в рассматриваемом случае число звеньев может достигать 100000. Иначе говоря, один поглощенный квант света приводит к образованию до ста тысяч молекул HCl. Заканчивается цепь при столкновении свободного атома со стенкой сосуда, в котором происходит реакция. Цепь может закончиться также при таком соударении двух активных частиц и одной неактивной, в результате которого активные частицы соединяются в молекулу, а выделяющаяся энергия уносится неактивной частицей. В подобных случаях происходит обрыв цепи. Таков механизм цепной неразветвленной реакции: при каждом элементарном взаимодействии один активный центр образует кроме молекулы продукта реакции один новый активный центр. В двадцатых годах XX века H. H. Семенов* совместно с сотрудниками, изучая кинетику различных процессов, открыл явления, необъяснимые на основе существовавших в то время представлений о механизме химических реакций. Для их объяснения H. H. Семенов выдвинул теорию разветвленных цепных реакций, в ходе которых взаимодействие свободного радикала с молекулой исходного вещества приводит к образованию не одного, а двух или большего числа новых активных центров. Один из них продолжает старую цепь, а другие дают начало новым; цепь разветвляется и реакция прогрессивно ускоряется. К разветвленным цепным реакциям относится, например, реакция образования воды из простых веществ. Экспериментально установлен и подтвержден расчетами следующий механизм этой реакции. В смеси водорода с кислородом при нагревании или пропускании электрического разряда происходит взаимодействие молекул этих газов с образованием двух гидроксилъных радикалов; H2 + O2 = • ОН + • ОН. Радикалы •ОН легко реагируют с молекулой водорода • ОН + H2 = H2O + H •, что приводит к образованию молекулы воды и свободного атома водорода. Последний реагирует с молекулой O2, давая уже две новых активных частицы: Н • + 02 = • ОН+O••. Атом кислорода, реагируя с молекулой H2, в свою очередь, может породить два новых активных центра: •O• + H2 = • ОН+ H•. Таким образом происходит прогрессивное увеличение числа активных частиц и, если обрывы цепей не препятствуют этому процессу, скорость реакции резко возрастает. По цепному механизму протекают такие важные химические реакции, как горение, взрывы, процессы окисления углеводородов (получение спиртов, альдегидов, кетонов, органических кислот) и реакции полимеризации. Поэтому теория цепных реакций служит научной основой ряда важных отраслей техники и химической технологии. К цепным процессам относятся и ядерные цепные реакции, протекающие, например, в атомных реакторах или при взрыве атомной бомбы. Здесь роль активной частицы играет нейтрон, проникновение которого в ядро атома может приводить к его распаду, сопровождающемуся выделением большой энергии и образованием новых свободных нейтронов, продолжающих цепь ядерных превращений. Фотохимические реакции Реакции, протекающие под воздействием светового излучения, называются фотохимическими, а раздел, изучающий фотохимические превращения, - фотохимией. Основной закон фотохимии – закон квантовой эквивалентности (А.Эйнштейн, 1912 г.): каждый поглощенный квант света вызывает изменение одной молекулы.
Экспериментальная часть Цель работы: опытным путём изучить зависимость скорости химической реакции: - от концентрации взаимодействующих веществ (закон действующих масс); - от температуры; - от поверхности раздела для гетерогенных химических реакций; - от катализатора.
Опыт 1. Зависимость скорости реакции от концентрации Приготовьте три раствора тиосульфата натрия различной концентрации; для этого налейте в пробирки: в первую – 15 капель раствора; во вторую – 10 капель раствора и 5 капель воды; в третью – 5 капель раствора и 10 капель воды. Затем в каждую пробирку с раствором тиосульфата натрия быстро влейте по 5 капель раствора серной кислоты и одновременно фиксируйте время от начала соединения веществ до появления опалесценции. Na2S2O3+H2SO4→S+Na2SO4+SO2+H2O
Таблица 1 - Результаты опытов и предварительных расчетов
Обработка результатов: 1) напишите математическое выражение закона действующих масс для изучаемой реакции; 2) постройте график зависимости 3) Запишите кинетическое уравнение; 4) сделайте вывод о зависимости скорости реакции от концентрации реагирующих веществ.
Опыт 2. Зависимость скорости реакции от температуры Налейте в одну пробирку 5 капель раствора тиосульфата натрия, а в другую – 5 капель серной кислоты. Обе пробирки поставьте в стакан с водой. Через 3…4 минуты измерьте температуру, запишите ее и слейте содержимое пробирок вместе, отмечая время от начала реакции до появления опалесценции. В две другие пробирки влейте те же растворы и нагрейте на 10 оС выше той температуры, что была в предыдущем опыте, термостатируйте 3…4 минуты в стакане с водой. Слейте вместе содержимое пробирок, отметьте время проведения опыта. Повторите опыт еще раз, повышая температуру на 100С.
Таблица 2 – Отчетная таблица
Обработка результатов: 1) постройте график зависимости скорости реакции от температуры; 2) запишите уравнения, описывающие зависимость скорости химической реакции от температуры; 3) по результатам опыта вычислите температурный коэффициент скорости реакции; 4) сделайте вывод о зависимости скорости реакции от температуры.
Опыт 3. Скорость реакции в гетерогенной системе Налейте в две пробирки по 2 мл раствора HCl. Бросьте в одну пробирку маленький кусочек мела, а в другую – такое же количество измельченного мела. Проследите, в какой из пробирок реакция проходит быстрее. CaCO3+ 2HCl→ CaCl2+H2O+CO2. Обработка результатов: 1) запишите кинетическое уравнение; 2) сделайте обоснованный вывод от чего зависит скорость гетерогенной химической реакции.
Опыт 4. Влияние катализатора на скорость реакции Разложение перекиси водорода при обыкновенной температуре идет медленно, реакцию можно ускорить путем введения катализатора MnO2: 2H2O Поднесите к отверстию пробирки тлеющую лучину. Опишите наблюдаемые явления. Проверьте, произошли ли какие–нибудь изменения с катализатором в результате химической реакции. Обработка результатов: 1) запишите кинетическое уравнение; 2) объясните почему происходит ускорение химической реакции в присутствии катализаторов. Техника безопасности 1. При работе в лаборатории студент должен иметь халат. Рабочее место не должно быть захламлено ненужной посудой и приборами. Перед началом работы необходимо проверить наличие реактивов, тщательно ознакомиться со свойствами веществ, используемых в работе, чтобы принять все меры предосторожности в случае их вредного действия или огнеопасности. 2. При термическом ожоге различают три степени. Первая степень характеризуется краснотой. Обожженное место протирают ваткой, смоченной этиловым спиртом. При второй степени ожога появляются пузыри. Обожженное место смачивают спиртом, 3%-м раствором KMnO4 или 5%-м раствором танина. При третьей степени ожога разрушается кожная ткань. Накрывают ранку стерильной повязкой и вызывают врача. 3. При ожоге кислотой промывают обожженное место большим количеством воды (не менее пяти минут под краном), затем 2%-м раствором питьевой соды или слабым раствором аммиака. 4. При отравлении ядовитым газом пострадавшего следует вынести на свежий воздух, в случае с сернистым газом промыть нос и полость рта 2%-м раствором двууглекислого натрия и предоставить покой.
4 Контрольные вопросы на допуск к лабораторной работе
1. Что называют скоростью химических реакций? 2. От чего зависит константа скорости химических реакций? 3. Сформулируйте закон действующих масс. 4. Как температура влияет на скорость химических реакций? 5. Какие механизмы химических реакций существуют? 6. Методы активирования химических реакций. 7. Какие реакции называют цепными? 8. Необратимые и обратимые реакции. 9. Какие реакции называются: а) гетерогенными; б) гомогенными? 10. Катализ. 11. Методика проведения лабораторной работы.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 433; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.007 с.) |


 .
.
 .
.
 =ƒ(c);
=ƒ(c);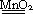 2H2O+O2
2H2O+O2  .
.


