
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние природы реагирующих веществ наСодержание книги
Поиск на нашем сайте
Химическая кинетика
Методические рекомендации по выполнению лабораторных работ для студентов специальностей 120100, 130400, 190900, 351100, 170600, 060800, 071900, 171200, 17150, 230100, изучающих курс "Химия", для всех форм обучения
Барнаул 2004 УДК 546 (075.5) Макрушина Т.И., Верещагин А.Л. Химическая кинетика. Методические рекомендации по выполнению лабораторных работ по курсу "Химия".
Алт. гос. тех. ун-т БТИ. – Бийск. Изд-ство Алт. гос. тех. ун-та, 2004. – 48 с.
Усложнение учебного материала в связи с изменениями принципов построения учебных курсов потребовало в последние годы интенсификации обучения и существенного развития самостоятельной учебной деятельности студентов. Данные методические рекомендации включает в себя систему методической документации, которая обеспечивает модульно–рейтинговую технологию обучения по курсу "Химия". Методические рекомендации предназначены для студентов специальностей 120100 – Технология машиностроения, 130400 – Ракетные двигатели, 190900 – Информационно – измерительная техника; 351100 – Товароведение и экспертиза товаров, 170600- Машины и аппараты пищевых производств, 071900 – Информационные системы и технологии, 171200 – Автоматизированное производство химических предприятий, 171500 – Высокоэнергетические устройства автоматических систем, 230100 – Эксплуатация и обслуживание транспортных технологических машин и оборудования..
Рассмотрено и утверждено на заседании кафедры прото-кол № 11 от 15.01.2004 г
Рецензент: к.х.н., доцент кафедры ХТОСА Орлова З.В.
ã БТИ Алт. ГТУ, 2004 Введение Кинетикой химических реакций называется учение о скорости их протекания, механизме химического взаимодействия и зависимости их от различных факторов. Эти вопросы представляют большой практический и теоретический интерес. Разные реакции совершаются с самыми различными скоростями. Предсказания химической термодинамики наиболее верны в своей «запрещающей» части. Если, например, для реакции N2+O2 = 2NO DG0 = +176кДж, то эта реакция не пойдет самопроизвольно, и никакой катализатор ей не поможет. Известный заводской процесс получения NO из воздуха требует огромных затрат энергии и неравновесного процесса («закалка» продуктов быстрым охлаждением после пропускания смеси газов через электрическую дугу). С другой стороны, далеко не все реакции, для которых DG < 0, «спешат» осуществиться на практике. Куски каменного угля могут веками лежать на воздухе, хотя для реакции: C+O2 = CO2 DG0 = - 395 кДж. Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды, другие осуществляются за минуты, часы, дни, известны реакции, требующие для своего протекания несколько лет, десятилетий и еще более длительных отрезков времени. Кроме того, одна и та же реакция может в одних условиях, например, при повышенных температурах, протекать быстро, а в других — например, "при охлаждении — медленно; при этом различие в скорости одной и той же реакции может быть очень большим. Знание скоростей химических реакций имеет очень большое научное и практическое значение. Например, в химической промышленности при производстве того или иного вещества от скорости реакции зависят размеры и производительность аппаратуры, количество вырабатываемого продукта. Предсказание скорости химической реакции, а также выяснение зависимости этой скорости от условий проведения реакции осуществляет химическая кинетика – наука о химическом процессе, его механизме и закономерностях протекания во времени.
Теоретическая часть Скорость химической реакции При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции), и реакции, протекающие в гетерогенной системе (гетерогенные реакции). Системой в химии принято называть рассматриваемое вещество или совокупность веществ. При этом системе противопоставляется внешняя среда — вещества, окружающие систему. Обычно система физически отграничена от среды. Различают гомогенные и гетерогенные системы. Гомогенной называется система, состоящая из одной фазы, гетерогенной — система, состоящая из нескольких фаз. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком. Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Например, при сливании (и перемешивании) растворов серной кислоты и тиосульфата натрия помутнение, вызываемое появлением серы, наблюдается во всем объеме раствора: H2SO4 + Na2S2O3 = Na2SO4 + H2O + SO2 Если реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности раздела фаз, образующих систему. Например, растворение металла в кислоте Fe + 2HCl = FeCl2 + H2 может протекать только на поверхности металла, потому что только здесь соприкасаются друг с другом оба реагирующие вещества. В связи с этим скорость гомогенной реакции и скорость гетерогенной реакции определяются различно. Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы. Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы:
Скорость химической реакции можно определить как изменение концентрации одного из участвующих в реакции веществ (исходное вещество или продукт реакции) в единицу времени. А®В
где СА, СВ – изменение концентрации исходного вещества и продукта реакции. В любой реакции реагенты расходуются, она замедляется (см. рисунок 1). Поэтому можно говорить только о скорости в данный момент времени. Очевидно, что скорость зависит от концентрации реагирующих веществ.
Рисунок 1-Изменение концентрации исходного вещества в ходе реакции Если хотя бы одно из реагирующих веществ – газ, то удобно следить за скоростью по изменению объема или давлению в закрытом сосуде при постоянной температуре. Иногда можно наблюдать за изменением окраски, за появлением осадка, за изменением электропроводности и спектральных данных. От чего зависит скорость химической реакции? К важнейшим факторам, влияющим на скорость реакции, относятся следующие: природа реагирующих веществ, их концентрации, температура, присутствие в системе катализаторов. Скорость некоторых гетерогенных реакций зависит также от интенсивности движения жидкости или газа около поверхности, на которой происходит реакция. Скорость химических реакций Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с более прочными связями. Так, для разрыва связей в молекулах H2 и N2 требуются высокие энергии; такие молекулы мало реакционноспособны. Для разрыва связей в сильнополярных молекулах (HCI, H2O) требуется меньше энергии, и скорость реакции значительно выше. Реакции между ионами в растворах электролитов протекают практически мгновенно. Примеры: фтор с водородом реагирует со взрывом при комнатной температуре, бром с водородом взаимодействует медленно и при нагревании; оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид меди с водой не реагирует.
Концентрации Необходимым условием того, чтобы между частицами (молекулами, ионами) исходных веществ произошло химическое взаимодействие, является их столкновение друг с другом (соударение). Точнее говоря, частицы должны сблизиться друг; с другом настолько, чтобы атомы одной из них испытывали бы действие электрических полей, создаваемых атомами другой. Только при этом станут возможны те переходы электронов и перегруппировки атомов, в результате которых образуются молекулы новых веществ — продуктов реакции. Поэтому 'скорость реакции пропорциональна числу соударений, которые претерпевают молекулы реагирующих веществ. Число соударений, в свою очередь, тем больше, чем выше концентрация каждого из исходных веществ или, что то же самое, чем больше произведение концентраций реагирующих веществ Рассмотрим зависимость скорости u = f(CA, CB, CD) =? Измерим скорость при каких либо концентрациях, а потом увеличим концентрацию СА вдвое и еще раз измерим скорость. Пусть она возросла вдвое. Это значит, что скорость
где k — коэффициент пропорциональности, называемый константой скорости данной реакции Это уравнение называется кинетическим уравнением реакции. Величина константы скорости k зависит от природы реагирующих веществ, от температуры и от присутствия катализаторов, но не зависит от концентраций веществ. Показатели степеней при концентрациях в кинетическом уравнении называются порядками реакции по данному веществу, а их сумма – общим порядком реакции. Порядки реакции устанавливаются экспериментально, а не по стехиометрическим коэффициентам. Существует совсем немного реакций, где порядок совпадает с суммой стехиометрических коэффициентов. N2O5= 2NO2+ 1/2O2: (H2)+(J2) = 2(HJ): (Cl2) +2(NO) = 2(NOCl):
Наиболее часто встречаются реакции первого, второго, иногда ‑ третьего порядка. H2 + Br2 = 2HBr;
Иными словами, порядок может быть и дробным. Почему, рассмотрим ниже. Реакции обычно идут по стадиям, поскольку невозможно представить себе одновременное столкновение большого числа молекул. Предположим, что некая реакция идет по стадиям: A + 2B = C + D 1) А + В = АВ; 2) АВ + В --> C +D. Тогда, если первая реакция идет медленно, а вторая быстро, то скорость определяется первой стадией (пока она не пройдет, не может идти вторая), т.е. накопление частиц АВ. Тогда и Скорость реакции для последовательных реакций определяется самой медленной стадией. Отсюда различие между порядком реакции и стехиометрическими коэффициентами. Например, реакция разложения перекиси водорода 2H2O2 = 2H2O+O2 на самом деле - реакция первого порядка, т.к. она лимитируется первой стадией H2O2 = H2O+O, а вторая стадия O+O = O2 идет очень быстро. Самой медленной может быть не первая, а вторая или другая стадия, и тогда мы получаем иногда дробный порядок, выражая концентрации интермедиатов (промежуточных соединений) через концентрации начальных веществ. Скорость реакции в момент t - мгновенная скорость - подчиняется закону действующих масс, который был экспериментально открыт и теоретически обоснован в середине ХIX столетия и получил свое название от термина «действующая масса» - синонима современного понятия «концентрация». Закон действующих масс (К. Гульдберг, П.Вааге, 1867г. Норвегия): скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. aA + bB +... ®...
Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов. Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
1.3.1Скорость реакции первого порядка: Рассмотрим химическую реакцию первого порядка – это обычно реакции разложения или диссоциации. H2 à 2H;
принимая для времени t=0 C = C0, получим тогда Концентрация реагентов и скорость реакции первого порядка уменьшаются во времени по экспоненциальному закону. Прологарифмируем уравнение (1.4), получим
Константа скорости реакции первого порядка измеряется в [с-1]
Рисунок 2 – Изменение концентрации реагирующих веществ для реакций первого порядка
(1.8)
Период полураспада (t ½) - время, в течение которого концентрация реагента уменьшается вдвое по сравнению с начальной концентрацией. Подставим С=С0/2 в (1.6), тогда получим
Период полураспада реагента в случае реакции первого порядка не зависит от начальной концентрации, а определяется константой скорости реакции. 1.3.2 Скорость реакции второго порядка Рассмотрим реакцию второго порядка: 2HJ = H2+J2,
Используя уравнения для скоростей реакций и разделяя переменные, получим
Принимая в начальный момент
C = C0. получим
Рисунок 3 - Изменение концентраций исходных веществ во времени для уравнений реакций второго порядка
Химическое равновесие
Все химические реакции можно разбить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца — до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что необратимая реакция может протекать только в одном направлении. Обратимая же реакция может протекать как в прямом, так и в обратном направлениях. Рассмотрим два примера. Пример 1. Взаимодействие между цинком и концентрированной азотной кислотой протекает согласно уравнению: Zn + 4HNO3 = Zn(NO3)2 + 2NO2 + 2H2O. При достаточном количестве азотной кислоты реакция закончится только тогда, когда весь цинк растворится. Кроме того, если попытаться провести эту реакцию в обратном направлении — пропускать диоксид азота через раствор нитрата цинка, то металлического цинка и азотной кислоты не получится — данная реакция не может протекать в обратном направлении. Таким образом, взаимодействие цинка с азотной кислотой — необратимая реакция. Пример 2. Синтез аммиака протекает согласно уравнению: N2+ 3H2 = 2NH3 . Если смешать один моль азота с тремя молями водорода, создать в системе условия, благоприятствующие протеканию реакции, и по истечении достаточного времени произвести анализ газовой смеси, то результаты анализа покажут, что в системе будет присутствовать не только продукт реакции (аммиак), но и исходные вещества (азот и водород). Если теперь в те же условия в качестве исходного вещества поместить не азото-водородную смесь, а аммиак, то можно будет обнаружить, что часть аммиака разложится на азот и водород, причем конечное соотношение между количествами всех трех веществ будет такое же, как в том случае, когда исходили из смеси азота с водородом. Таким образом, синтез аммиака — обратимая реакция. В уравнениях обратимых реакций вместо знака равенства можно ставить стрелки; они символизируют протекание реакции как в прямом, так и обратном направлениях. Обратимые реакции - химические реакции, протекающие одновременно в двух противоположных направлениях.
Рисунок 5 – Изменение скорости прямой и обратной химических реакций
Химическое равновесие - состояние системы, в котором скорость прямой реакции ( Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (k1) и обратной (k2) реакций. Для реакции mA + nB → pC + dD константа равновесия равна:
K = k1 / k2 = ([C]p • [D]d) / ([A]m • [B]n). (1.24) Константа равновесия зависит от температуры и природы реагирующих веществ и не зависит от присутствия катализаторов. Поскольку катализатор изменяет энергию активации и прямой, и обратной реакций на одну и ту же величину, то на отношение констант их скорости он не оказывает влияния. Поэтому катализатор не влияет на величину константы равновесия и, следовательно, не может ни увеличить, ни снизить выход реакции. Он может лишь ускорить или замедлить наступление равновесия. Смысл этого уравнения можно выразить так: для одной и той же температуры отношение произведений равновесных концентраций (в степенях их стехиометрических коэффициентов) веществ в правой и левой частях уравнения химической реакции представляет постоянную величину. Не забывать, что 1) все это правильно только для равновесных концентраций; 2) записывая константу, надо помнить, что в числителе стоят равновесные концентрации конечных продуктов, а в знаменателе – начальных веществ. Что такое К? Константа равновесия показывает глубину протекания процесса. Если К>>1, процесс сильно сдвинут в сторону получения продуктов реакции. Если К<<1, наоборот, процесс сильно сдвинут влево, и реакция практически не идет. К = 1 – равновесие установилось «на полдороге». Следует различать истинное равновесие и мнимое или кажущееся, которое называют еще заторможенным равновесием или метастабильным состоянием (в колбе водород, кислород и вода – ничего не меняется годами, чтобы понять, что это не равновесие, поднесите спичку). Условия истинного равновесия: 1) при сохранении внешних условий состояние системы не меняется во времени; 2) при изменении условий (введение дополнительных количеств реагирующих веществ, изменение давления или температуры) система приходит к новому состоянию равновесия; 3) к состоянию равновесия можно подойти с противоположных сторон. Равновесное состояние системы H2 + I2 ó2HI может быть достигнуто, исходя из водорода и иода, а можно получить то же самое, взяв HI. Для равновесий между газообразными веществами удобно пользоваться не молярными концентрациями, а парциальными давлениями. Константа равновесия, выраженная через молярные концентрации – Кс, а через парциальные давления – Кр. Связь между ними Кс = Кр(RT)D, (1.25) где D - разность числа молей исходных веществ и конечных продуктов. 1.7.1 Способы смещения равновесия Принцип Ле-Шателье: если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие 1) увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул); 2) увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты); 3) увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещает равновесие в сторону прямой реакции; 4) катализаторы не влияют на положение равновесия.
Цепные реакции К цепным реакциям относят реакции, протекающие с образованием свободных радикалов, способных превращать реагенты в конечные продукты, поддерживая постоянство свободных радикалов или даже увеличивая их (разветвленная цепная реакция). В цепных реакциях выделяют три стадии: зарождение цепи, ее развитие и обрыв. Зарождение (инициирование) происходит под воздействием светового, радиационного, термического или другого воздействия. Примером неразветвленной цепной реакции может служить реакция H2 + Br2 = 2HBr, инициирование которой определяется термодиссоциацией. Инициирование:
Рост цепи (разветвление):
Обрыв цепи:
Эта последовательность процессов продолжается дальше: в рассматриваемом случае число звеньев может достигать 100000. Иначе говоря, один поглощенный квант света приводит к образованию до ста тысяч молекул HCl. Заканчивается цепь при столкновении свободного атома со стенкой сосуда, в котором происходит реакция. Цепь может закончиться также при таком соударении двух активных частиц и одной неактивной, в результате которого активные частицы соединяются в молекулу, а выделяющаяся энергия уносится неактивной частицей. В подобных случаях происходит обрыв цепи. Таков механизм цепной неразветвленной реакции: при каждом элементарном взаимодействии один активный центр образует кроме молекулы продукта реакции один новый активный центр. В двадцатых годах XX века H. H. Семенов* совместно с сотрудниками, изучая кинетику различных процессов, открыл явления, необъяснимые на основе существовавших в то время представлений о механизме химических реакций. Для их объяснения H. H. Семенов выдвинул теорию разветвленных цепных реакций, в ходе которых взаимодействие свободного радикала с молекулой исходного вещества приводит к образованию не одного, а двух или большего числа новых активных центров. Один из них продолжает старую цепь, а другие дают начало новым; цепь разветвляется и реакция прогрессивно ускоряется. К разветвленным цепным реакциям относится, например, реакция образования воды из простых веществ. Экспериментально установлен и подтвержден расчетами следующий механизм этой реакции. В смеси водорода с кислородом при нагревании или пропускании электрического разряда происходит взаимодействие молекул этих газов с образованием двух гидроксилъных радикалов; H2 + O2 = • ОН + • ОН. Радикалы •ОН легко реагируют с молекулой водорода • ОН + H2 = H2O + H •, что приводит к образованию молекулы воды и свободного атома водорода. Последний реагирует с молекулой O2, давая уже две новых активных частицы: Н • + 02 = • ОН+O••. Атом кислорода, реагируя с молекулой H2, в свою очередь, может породить два новых активных центра: •O• + H2 = • ОН+ H•. Таким образом происходит прогрессивное увеличение числа активных частиц и, если обрывы цепей не препятствуют этому процессу, скорость реакции резко возрастает. По цепному механизму протекают такие важные химические реакции, как горение, взрывы, процессы окисления углеводородов (получение спиртов, альдегидов, кетонов, органических кислот) и реакции полимеризации. Поэтому теория цепных реакций служит научной основой ряда важных отраслей техники и химической технологии. К цепным процессам относятся и ядерные цепные реакции, протекающие, например, в атомных реакторах или при взрыве атомной бомбы. Здесь роль активной частицы играет нейтрон, проникновение которого в ядро атома может приводить к его распаду, сопровождающемуся выделением большой энергии и образованием новых свободных нейтронов, продолжающих цепь ядерных превращений. Фотохимические реакции Реакции, протекающие под воздействием светового излучения, называются фотохимическими, а раздел, изучающий фотохимические превращения, - фотохимией. Основной закон фотохимии – закон квантовой эквивалентности (А.Эйнштейн, 1912 г.): каждый поглощенный квант света вызывает изменение одной молекулы.
Экспериментальная часть Цель работы: опытным путём изучить зависимость скорости химической реакции: - от концентрации взаимодействующих веществ (закон действующих масс); - от температуры; - от поверхности раздела для гетерогенных химических реакций; - от катализатора.
Опыт 1. Зависимость скорости реакции от концентрации Приготовьте три раствора тиосульфата натрия различной концентрации; для этого налейте в пробирки: в первую – 15 капель раствора; во вторую – 10 капель раствора и 5 капель воды; в третью – 5 капель раствора и 10 капель воды. Затем в каждую пробирку с раствором тиосульфата натрия быстро влейте по 5 капель раствора серной кислоты и одновременно фиксируйте время от начала соединения веществ до появления опалесценции. Na2S2O3+H2SO4→S+Na2SO4+SO2+H2O
Таблица 1 - Результаты опытов и предварительных расчетов
Обработка результатов: 1) напишите математическое выражение закона действующих масс для изучаемой реакции; 2) постройте график зависимости 3) Запишите кинетическое уравнение; 4) сделайте вывод о зависимости скорости реакции от концентрации реагирующих веществ.
Опыт 2. Зависимость скорости реакции от температуры Налейте в одну пробирку 5 капель раствора тиосульфата натрия, а в другую – 5 капель серной кислоты. Обе пробирки поставьте в стакан с водой. Через 3…4 минуты измерьте температуру, запишите ее и слейте содержимое пробирок вместе, отмечая время от начала реакции до появления опалесценции. В две другие пробирки влейте те же растворы и нагрейте на 10 оС выше той температуры, что была в предыдущем опыте, термостатируйте 3…4 минуты в стакане с водой. Слейте вместе содержимое пробирок, отметьте время проведения опыта. Повторите опыт еще раз, повышая температуру на 100С.
Таблица 2 – Отчетная таблица
Обработка результатов: 1) постройте график зависимости скорости реакции от температуры; 2) запишите уравнения, описывающие зависимость скорости химической реакции от температуры; 3) по результатам опыта вычислите температурный коэффициент скорости реакции; 4) сделайте вывод о зависимости скорости реакции от температуры.
Опыт 3. Скорость реакции в гетерогенной системе Налейте в две пробирки по 2 мл раствора HCl. Бросьте в одну пробирку маленький кусочек мела, а в другую – такое же количество измельченного мела. Проследите, в какой из пробирок реакция проходит быстрее. CaCO3+ 2HCl→ CaCl2+H2O+CO2. Обработка результатов: 1) запишите кинетическое уравнение; 2) сделайте обоснованный вывод от чего зависит скорость гетерогенной химической реакции.
Опыт 4. Влияние катализатора на скорость реакции Разложение перекиси водорода при обыкновенной температуре идет медленно, реакцию можно ускорить путем введения катализатора MnO2: 2H2O Поднесите к отверстию пробирки тлеющую лучину. Опишите наблюдаемые явления. Проверьте, произошли ли какие–нибудь изменения с катализатором в результате химической реакции. Обработка результатов: 1) запишите кинетическое уравнение; 2) объясните почему происходит ускорение химической реакции в присутствии катализаторов. Техника безопасности 1. При работе в лаборатории студент должен иметь халат. Рабочее место не должно быть захламлено ненужной посудой и приборами. Перед началом работы необходимо проверить наличие реактивов, тщательно ознакомиться со свойствами веществ, используемых в работе, чтобы принять все меры предосторожности в случае их вредного действия или огнеопасности. 2. При термическом ожоге различают три степени. Первая степень характеризуется краснотой. Обожженное место протирают ваткой, смоченной этиловым спиртом. При второй степени ожога появляются пузыри. Обожженное место смачивают спиртом, 3%-м раствором KMnO4 или 5%-м раствором танина. При третьей степени ожога разрушается кожная ткань. Накрывают ранку стерильной повязкой и вызывают врача. 3. При ожоге кислотой промывают обожженное место большим количеством воды (не менее пяти минут под краном), затем 2%-м раствором питьевой соды или слабым раствором аммиака. 4. При отравлении ядовитым газом пострадавшего следует вынести на свежий воздух, в случае с сернистым газом промыть нос и полость рта 2%-м раствором двууглекислого натрия и предоставить покой.
4 Контрольные вопросы на допуск к лабораторной работе
1. Что называют скоростью химических реакций? 2. От чего зависит константа скорости химических реакций? 3. Сформулируйте закон действующих масс. 4. Как температура влияет на скорость химических реакций? 5. Какие механизмы химических реакций существуют? 6. Методы активирования химических реакций. 7. Какие реакции называют цепными? 8. Необратимые и обратимые реакции. 9. Какие реакции называются: а) гетерогенными; б) гомогенными? 10. Катализ. 11. Методика проведения лабораторной работы. Подготовка к защите лабораторной работы 1. Изучить материал занятия по литературе [1] и конспекту лекций. 2. Выучить значения основных терминов и определений. 3. Подготовиться к письменному опросу по терминам и определениям и решению задач.
ПРИЛОЖЕНИЕ А Адиабатический процесс – процесс перехода изолированной системы из одного состояния в другое при отсутствии обмена теплом (Q=0) с окружающей средой. Адсорбат – адсорбированное вещество. Адсорбтив – вещество, которое может адсорбироваться. Адсорбция – представляет собой процесс поглощения газов, паров или жидкостей поверхностью пористых твердых тел (процесс концентрирования веществ на границе поверхности раздела). Внутренняя энергия (U) – общий запас энергии, включая движение молекул, колебание связей, движение электронов, ядер и т. д. Это все виды энергии кроме потенциальной и кинетической энергии системы в целом. Гетерогенные химические реакции – реакции, протекающие на границе раздела фаз. Гетерогенный катализ – это ускорение химической реакции на границе раздела "катализатор–реагирующая система". Гомогенный катализ – процесс ускорения химических реакций, осуществляется через промежуточные реакции с катализатором и в результате происходит замена одной реакции с высокой энергией активации несколькими, у которых энергия активации ниже, а скорость выше, протекает в гомогенной среде. Диффузионный слой – тонкий слой около реакционной поверхности, перенос вещества в котором осуществляется в основном за счет молекулярной диффузии. Закон действующих масс – скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ при постоянной температуре. Закрытые системы – системы, которые обмениваются с окружающей средой только энергией. Избыток адсорбированного вещества (Г) – количественная мера адсорбции, равен разности концентраций вещества в поверхностном слое и в объеме раствора, моль/м2. Изобарический процесс – процесс перехода системы из одного состояния в другое при постоянном давлении. Изо |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 404; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.219.203 (0.011 с.) |

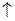 + S
+ S  .
. гомог =
гомог = 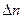 /(V
/(V 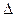 τ);
τ); 
 (1.2)
(1.2)

 ;
; ;
;  .
. , (1.5)
, (1.5)
 . (1.6)
. (1.6) ,
, , тогда
, тогда . (1.7)
. (1.7)

 . (1.9)
. (1.9) ,
,  .
.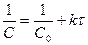 . (1.10)
. (1.10) (л/моль ∙ с). (1.11)
(л/моль ∙ с). (1.11) . (1.12)
. (1.12) . (1.13)
. (1.13)

 .
.
 .
.
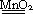 2H2O+O2
2H2O+O2  .
.


