
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скорость химической реакции. КатализСодержание книги
Поиск на нашем сайте
Любая химическая реакция представляет собой совокупность элементарных актов взаимодействий между молекулами, атомами или ионами, при которых образуются продукты реакции. Конечные продукты могут получаться за один или несколько последовательных элементарных актов (ступеней). Скоростью химической реакции называется количество вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объёма (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенных реакций). Если за промежуток времени ∆τ = τ2 - τ1 концентрация одного из веществ, участвующих в реакции, уменьшается на ∆С = С2 - С1, то средняя скорость химической реакции за указанный промежуток времени равна
Величина V выражает скорость химического процесса на некотором отрезке времени. Поэтому чем меньше ∆τ, тем средняя скорость будет ближе к истинной. Скорость химической реакции зависит от следующих факторов: 1) природы и концентрации реагирующих веществ; 2) температуры реакционной системы; 3) наличия катализатора; 4) давления, 5) величины поверхности раздела фаз и скорости перемешивания системы (для гетерогенных реакций); 6) типа растворителя. Влияние концентрации реагентов. Скорость реакции пропорциональна числу соударений молекул реагирующих веществ. Число соударений, в свою очередь, тем больше, чем выше концентрация каждого из исходных веществ. Общую формулировку влияния концентрации на скорость химической реакции даёт закон действия масс (1867 г., Гульдберг, Вааге, Бекетов).
При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях их уравнительных (стехиометрических) коэффициентов.
Для реакции аА + вВ = сС V = K[A]а[B]в, где К – коэффициент пропорциональности или константа скорости; [ ] - концентрация реагента в моль/л.
Если [А] = 1 моль/л, [В] =1 моль/л, то V = K, отсюда физический смысл константы скорости К: константа скорости равна скорости реакции при концентрациях реагирующих веществ, равных единице. Влияние температуры на скорость реакции. С ростом температуры увеличивается частота столкновения реагирующих молекул, а следовательно, увеличивается скорость реакции. Количественно влияние температуры на скорость гомогенных реакций может быть выражено правилом Вант-Гоффа. В соответствии с правилом Вант-Гоффа при повышении (понижении) температуры на 10 градусов скорость химической реакции увеличивается (уменьшается) в 2-4 раза:
где V (t2) и V (t1) – скорости химической реакции при соответствующих температурах; τ(t2) и τ(t1) – продолжительность химической реакции при соответствующих температурах; γ – температурный коэффициент Вант-Гоффа, который может принимать числовое значение в интервале 2-4. Пример. При температуре 298 К некоторая реакция заканчивается за 32минуты. Через сколько минут закончится эта реакция при 348 К, если температурный коэффициент равен 4? Решение. При увеличении температуры от 298 до 348 К скорость реакции возрастает в соответствии с правилом Вант-Гоффа в
Следовательно, данная реакция при 348 К закончится за 32 мин: 1024 = = 0,03 мин = 1,8 с.
Энергия активации. Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации данной реакции (выражается в кДж/моль). Одним из способов активации является увеличение температуры: при повышении температуры число активных частиц сильно возрастает, благодаря чему резко увеличивается скорость реакции. Зависимость скорости реакции от температуры выражается уравнением Аррениуса:
где К – константа скорости химической реакции; Eа – энергия активации; R – универсальная газовая постоянная; А – постоянная; exp – основание натуральных логарифмов. Величина энергии активизации может быть определена, если известны два значения константы скорости К1 и К2 при температуре соответственно Т1 и Т2, по следующей формуле:
Катализ Катализом называют процесс изменения скорости реакции под действием катализаторов. Катализатор – это вещество, которое изменяет скорость реакции, но не расходуется в результате реакции. Различают гомогенный и гетерогенный катализ. В гомогенном катализе катализатор и реагирующие вещества находятся в одной и той же фазе, а при гетерогенном катализе они находятся в разных фазах. Механизм действия как гомогенного, так и гетерогенного катализа обычно заключается в образовании промежуточного комплекса, состоящего из катализатора и исходного вещества, (реже – промежуточного соединения), дальнейший распад которого определяет скорость и селективность всего процесса. Например, для каталитической реакции К А + В = С
механизм действия катализатора К можно схематично представить следующим образом А + К = АК, АК + В = С + К (АК - промежуточный комплекс).
Катализаторы, которые снижают энергию активации и повышают скорость реакции, называют положительными. Отрицательные катализаторы замедляют реакцию, связывая промежуточные молекулы. Их часто называют ингибиторами. Каталитические реакции, в которых катализатором является один из продуктов реакции, называются автокаталитическими (автокатализ).
Лабораторная работа
|
||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 237; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.7.116 (0.006 с.) |

 ,
, 

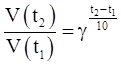 или
или 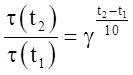 ,
,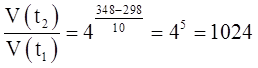 раза.
раза.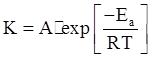 ,
,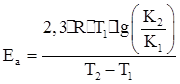 .
.


