
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 2. Приготовление раствора заданной концентрации и проверка ее титрованиемСодержание книги
Поиск на нашем сайте
Пример. Приготовить 100 мл 0,5 Н раствора NaOH из кристаллического NaOH. 1. Определить количество NaOH (m), необходимое для приготовления заданного раствора: 1000 мл – 20 г (0,5 Н) МNaOH = 40 100 мл – m m = 2 г. 2. Взвесить 2 г NaOH, перенести в стакан и добавить примерно 60 мл воды. Стеклянной палочкой тщательно перемешать раствор до полного растворения щёлочи. Раствор перелить в мерную колбу на 100 мл. Стакан сполоснуть небольшим количеством воды (~ 15 мл) и прилить её в ту же колбу с помощью воронки. Объём раствора в цилиндре довести до 100 мл (до метки) и тщательно перемешать. 3. Из мерной колбы отобрать пипеткой 10 мл приготовленного раствора и перенести его в коническую плоскодонную колбу для титрования. В колбу добавить 2…3 капли индикатора (метилоранж) и титровать раствором соляной кислоты до перехода желтого окрашивания раствора в розовый. Титрование повторить три раза, каждый раз точно определяя объем израсходованной кислоты (V1,V2,V3). Затем рассчитать средний объём
4. Число грамм-эквивалентов щёлочи в объёме пипетки (10 мл) равно чис-лу грамм-эквивалентов кислоты в объёме Vс.р.. По формуле Vm . Nm = Vk . Nk определить нормальную концентрацию приготовленного раствора щелочи. Сравнить полученные результаты с заданием.
Контрольные вопросы и упражнения
1. Что такое растворы? 2. Что такое компонент раствора? Из каких компонентов состоят растворы? В каких агрегатных состояниях могут находиться компоненты раствора? 3. Дайте определение процессов гидратации и сольватации при растворении. 4. Охарактеризуйте следующие свойства растворов: давление пара над раствором, температуры кипения и замерзания. 5. Какой раствор называется: разбавленным, концентрированным, насыщенным, ненасыщенным, пересыщенным? 6. Что показывает коэффициент растворимости? 7. Назовите условие выпадения из растворов осадков малорастворимых электролитов. 8. Что выражает величина, называемая концентрацией раствора? 9. Дайте определение молярности, моляльности, нормальности, титра, мольной доли и процентной концентрации. 10. Сколько нужно взять гидроксида калия, чтобы приготовить 500 г 8 %-го водного раствора? 11. Сколько граммов соды Na2CO3 нужно, чтобы приготовить 2 л 0,2 М раствора? 12. В 200 г воды растворили 6,37 г хлорида магния. Определите моляльную концентрацию раствора. 13. В 200 мл воды растворили 20 г нитрата калия. Определить массовую долю (%) KNO3. 14. Какую массу (г) 15 % раствора хлорида кальция можно приготовить, имея 170 мл воды? 15. В 175 мл воды растворили 25 г CuSO4 . 5H2O. Какая массовая доля (%) CuSO4 в полученном растворе? 16. Какой объем (мл) 94 % раствора серной кислоты (пл.1,837 г/мл) требуется для приготовления 1 л 20 % раствора (пл.1,143 г/мл)? 17. Какую массу (г) сульфата натрия надо добавить к 300 г 10 % раствора, чтобы получить 20 % раствор? 18. В 200 мл воды растворили 5,6 л хлороводорода (н.у.). Определить массовую долю (%) хлороводорода в полученном растворе. 19. Какая масса (г) нитрата калия содержится в 2 л 0,1 М раствора нитрата калия? 20. Определить молярную концентрацию раствора, содержащего 14 г гидроксида калия в 500 мл раствора. 21. Какой объём (мл) 0,2 М раствора гидроксида калия требуется, чтобы осадить в виде Fe(OH)3 всё железо, содержащееся в 29 мл 1,4 М раствора хлорида железа (III)? 22. Теплота растворения безводного сульфата натрия равна –80,3 кДж/моль, а теплота растворения кристаллогидрата сульфата натрия Na2SO4 . 10 Н2О равна –78,7 кДж/моль. Вычислить теплоту гидратации Na2SO4. 23. Определить теплоту гидратации безводного сульфата цинка, если известно, что теплота его растворения 77,11 кДж, а теплота растворения ZnSO4 . 7H2O равна –17,67 кДж.
24. К 0,05 л раствора сульфида стронция с молярной концентрацией 0,002 моль/л прилит равный объём раствора сульфата магния с концентрацией 0,004 моль/л. Выпадет ли осадок сульфата стронция?
Ионообменные реакции
Реакции в растворах электролитов, при которых не изменяется заряд ионов, входящих в соединения, называются ионообменными. Например, взаимодействие электролитов в состоянии равновесия
К1А1 + К2А2 D К1А2 + К2А1.
Константа равновесия
Чтобы узнать, в какую сторону смещено данное равновесие, рассмотрим диссоциацию каждого из 4-х электролитов: К1А1⇆К1⁺ + А 1 - К2А2⇆К2⁺ + А2⁻
К1А2⇆К1⁺+А2⁻
К₂А₁⇆К₂⁺+А₁⁻
Подставляя в уравнение (4) вместо концентраций значения К, получим
Если К>1, т.е. К₁₁· К₂₂>К₁₂·К₂₁, то равновесие смещено вправо (легче идёт прямая реакция). Если К<1,т.е. К₁₁·К₂₂<К₁₂·К₂₁, то равновесие смещено влево (в сторону обратной реакции). При К→ ∞ реакция будет необратимой. Равновесие в ионообменных реакциях смещается в сторону образования наименее диссоциированных соединений. Ионообменные реакции протекают в растворах электролитов в следующих случаях: 1) если образуется осадок трудно растворимого вещества; 2) если образуется газ (легколетучее вещество); 3) если образуется слабый электролит (плохо диссоциирующее соединение); 4) если образуется комплексный ион. В уравнениях ионных реакции формулы сильных электролитов записывают в диссоциированном виде, слабых – в недиссоциированном. Примеры: 1.Образование осадков: AgNO3 + NaCl = AgCl↓ + NaNO3; Ag+ + NO₃¯ + Na+ + CI¯ = AgCl + Na+ + NO₃¯; Ag+ + Cl¯ = AgCl.
2. Образование газов: Na₂S + H₂SO₄ = Na2SO4 + H2S↑; 2 Na+ + S²¯+ 2 H+ + SO₄²¯ = H2S↑ + 2 Na+ + SO₄²¯; 2 H+ + S²¯= H₂S↑.
3. Образование слабых электролитов. Чаще всего это – образование воды, слабого основания или слабой кислоты: а) образование воды: NaOH + HCl = H₂O + NaCl; Na+ + OH⁻ + H+ + Cl⁻ = H₂O + Na+ + Cl⁻; H+ + OH⁻ = H₂O;
б) образование слабого основания: NH₄Cl + KOH = NH₄OH + KCl; NH₄+ + Cl⁻ + K+ + OH⁻= NH₄OH + K++ Cl⁻; NH₄+ + OH⁻ = NH₄ОН;
в) образование слабой кислоты: 2 CH₃COONa + H₂SO₄ = 2 CH₃COOH + Na₂SO₄; 2 CH₃COO⁻ + 2 Na+ + 2 H+ + SO₄²⁻ = 2 CH₃COOH + 2 Na+ + SO₄²⁻; CH₃COO⁻ + H+ = CH₃COOH.
4. Образование комплексного иона (например, катиона) CuSO₄ ∙ 4 H₂O + 4 NH₃ = [Cu(NH₃)₄]SO₄ + 4 H₂O; [Cu(H₂O)₄]²+ + SO₄²⁻ + 4 NH₃ = [Cu(NH₃)₄]²+ + SO₄²⁻ + 4 H₂O.
Лабораторная работа Ионообменные реакции Цель работы Получение сильных малорастворимых и слабых электролитов.
Оборудование и реактивы Пробирки. Кусочек мела. Хлорид аммония (крист.). Рзбавленные растворы: хлорида бария, сульфата натрия, нитрата свинца, хлорида калия, йодида калия, соли железа (II), соли меди (II), сульфида аммония, ацетата натрия, дихромата калия, хлорида магния, аммиака, соляной и серной кислот.
Опыт 1. Ионные реакции с образованием осадков Налить в три пробирки по 2…3 капли раствора хлорида бария и добавить в одну из них несколько капель раствора сульфата натрия, в другую – раствора серной кислоты, в третью – раствора сульфата аммония. Наблюдать появление одинакового осадка. Составить уравнение реакции. Что можно сказать о сущности реакций в проделанном опыте?
Опыт 2. Образование осадков и произведение растворимости В две пробирки налить по 3…4 капли 0,005 М раствора нитрата свинца. В одну из них прибавить такой же объём 0,05 М раствора хлорида калия, а в другую – такой же объём 0,05 М раствора йодида калия. В какой из пробирок выпал осадок? Объяснить полученный результат, используя значения произведения растворимости. Составить уравнение реакций.
Опыт 3. Ионообменная реакция с образованием газа В пробирку поместить кусочек мела (CaCO₃) и прибавить столько разбавленной соляной кислоты, чтобы весь мел погрузился в раствор. Наблюдать выделение газа. Составить уравнение реакции.
Опыт 4. Образование сульфидов железа и меди и их растворимость в соляной кислоте В пробирку внести 2…3 капли раствора соли железа (II), в другую – 2…3 капли раствора соли меди (II). В каждую пробирку добавить несколько капель раствора сульфида аммония до появления осадков. Затем прилить к осадкам немного соляной кислоты. Какой из осадков растворяется? Составить уравнения реакций. Объяснить различие в растворимости осадков, используя значения произведения растворимости (см. приложение 2).
|
||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 349; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.15.112 (0.008 с.) |

 .
.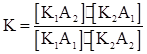 (4)
(4) ;
; ;
;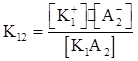 ;
; .
. .
.


