
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярность и порядок химической реакции.Содержание книги
Поиск на нашем сайте
Порядком реакции называют сумму показателей степени концентрационных множителей, определяющих закон изменения скорости реакции. Для кинетического уравнения в виде (8) порядок реакции равен: nf = n1 + n2 +… (9) В сложных реакциях не всегда возможно определить порядок реакции, учитывающий влияние всех реагентов. В этом случае пользуются понятием порядка реакции по веществу, например, порядок реакции по веществу А. Отсюда следует, что константа скорости всегда численно равна скорости реакции при единичных концентрациях, а ее размерность зависит от порядка реакции. Молекулярность химической реакции определяется числом молекул (частиц), участвующих в элементарном акте реакции. Различают одно- (А = В; А = В + С; А = В + С + Д), двух- (2А = В; А + В = С) и трехмолекулярные (А + 2В = С; 3А = С) реакции.
Причины несовпадения порядка и молекулярности реакции. П орядок и молекулярность совпадают лишь для простых одностадийных реакций. Существует две причины несовпадения порядка и молекулярности: 1. Постоянство концентрации одного или нескольких участников реакции (реакции в атмосфере). 2. Ступенчатый характер реакции (если реакция 2А + В = С идет в две стадии, то порядок второй, а молекулярность равна трем). Если скорости отдельных стадий сильно различаются, то скорость реакции в целом и ее порядок определяются скоростью и порядком самой медленной стадии. Не все кинетические уравнения имеют форму уравнения (8) в них могут входить более сложные функции концентраций исходных веществ, продуктов реакции, катализаторов, ингибиторов. Если реакция может осуществляться двумя путями, например каталитическим и некаталитическим, то кинетическое уравнение должно включать два слагаемых, соответствующих этим путям. В полном кинетическом уравнении должно содержаться выражение для константы равновесия, т.е. в него должны входить положительные и отрицательные члены, так что если скорость реакции принять равной нулю, то получиться уравнение для константы равновесия. Однако многие равновесия настолько сдвинуты в сторону образования продуктов, что можно найти кинетическое уравнение только для прямой реакции.
Кинетика реакций в статических условиях Реакции обычно характеризуют кинетическим уравнением, которое позволяет рассчитать константу скорости в любой момент времени от ее начала, и периодом полупревращения t1/2., который определяет момент уменьшения начальной концентрации реагирующих веществ вдвое. Периодом полупревращения называют промежуток времени в течение, которого начальная концентрация реагирующего вещества уменьшается вдвое. Реакция нулевого порядка Существуют реакции, скорость которых не меняется с изменением концентрации одного или нескольких реагирующих веществ, поскольку она определяется не концентрацией, а некоторыми другими ограничивающими факторами, например поглощением света в фотохимических реакциях или количеством катализатора в каталитических реакциях. Также к подобным реакциям относится горение в атмосфере. Тогда
Каталитическая реакция может иметь первый порядок по катализатору и нулевой порядок по реагирующему веществу. Интегрирование дает:
Постоянную интегрирования находят из начальных условий, при t = 0, с = с0. Тогда const = c0 и уравнение приобретает вид:
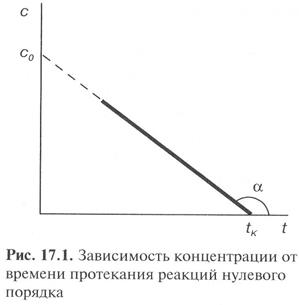
Оно выражает линейную зависимость концентрации от времени и позволяет определить константу скорости как k0 = -tga.
Из (11) получают кинетическое уравнение для реакции нулевого порядка
Размерность константы скорости моль/л·с. По уравнению (13) можно получить выражения для периода полупревращения для реакции нулевого порядка. t1/2 =с0/(2k0) (14) Период полупревращения реакции нулевого порядка прямо пропорционален исходной концентрации вещества. Реакции первого порядка Скорость реакции первого порядка описывается следующим кинетическим уравнением:
Проинтегрировав получим:
Постоянную интегрирования найдем из условия: при t =0 с = с0. Тогда
Это уравнение можно записать иначе
Из уравнения видно, что размерность k1 не зависит от способа выражения концентрации. Если построить график зависимости ln c от t, то тангенс угла наклона определит константу скорости.
Период полупревращения для реакции первого порядка
и не зависит от начальной концентрации реагирующих веществ. Реакции второго порядка Скорость реакции второго порядка определяется кинетическим уравнением:
Если концентрации равны
Из него следует:
Разделив переменные и проинтегрировав, имеем
Постоянную интегрирования находим из условия: при t=0 с=с0
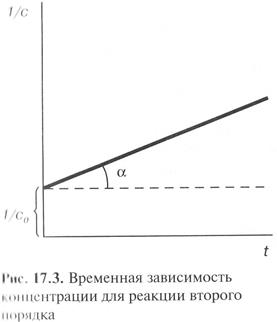
Линейная зависимость для реакций второго порядка наблюдается в координатах 1/с – t. Тангенс угла наклона равен константе скорости.
Период полупревращения для реакции второго порядка:
Период полупревращения для реакций второго порядка обратно пропорционален начальной концентрации веществ. Реакции третьего и более высокого порядка встречаются редко.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 3231; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.71.13 (0.006 с.) |

 (10)
(10)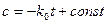 (11)
(11)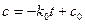 (12)
(12)
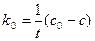 (13)
(13)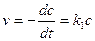 (15)
(15) (16)
(16)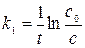 (17)
(17)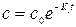 (18)
(18)
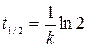 (19)
(19)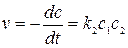 (20)
(20)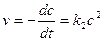 (21)
(21) (21)
(21) (22)
(22)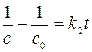 (23)
(23)
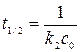 (24)
(24)


