
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетика химических реакций.Содержание книги
Поиск на нашем сайте
Кинетика химических реакций. Формальная кинетика. Скорость реакции. Кинетическое уравнение. Константа скорости. Порядок реакции. Реакции нулевого, первого и второго порядка. Период полупревращения. Химическая кинетика занимается изучением скоростей реакций, а также механизмов их протекания. Для выяснения механизма реакции исследуют влияние на ее скорость изменений концентрации исходных веществ, продуктов реакции, катализаторов и ингибиторов. Принципиально возможность той или иной реакции предсказывает химическая термодинамика (DG <0), однако, далеко не всегда термодинамические возможности реакции осуществляются в действительности. Например, все органические вещества, согласно принципам термодинамики, должны бы были, достаточно быстро, окислятся в углекислоту и воду молекулярным кислородом воздуха, т.к. этот процесс сопровождался бы значительным уменьшением энергии Гиббса. Существование растений, животных, залежей угля, нефти и т.д. обязано тем, что реакция окисления в действительности протекает исключительно медленно. Химическая кинетика состоит из двух разделов: 1 Формальная кинетика, занимающаяся математическим описанием скорости реакции. 2. Молекулярная кинетика – учение о механизмах химического взаимодействия. Скорость реакции Скорость реакции определяется количеством вещества, прореагировавшего в единицу времени в единицу объема. Химическая реакция, протекающая в одну стадию, называется элементарной. Возьмем реакцию, протекающую в закрытой системе. ν1А1 + ν2А2 = ν3А3 + ν4А4 (1) Далее вводится понятие глубины протекания реакции x (или степень превращения), которая определяется соотношением: ni = ni0 + n ix, (2) где ni0 –начальное число молей i - го реагирующего вещества или продукта реакции и ni - число моль, в какой то более поздний момент времени. Следовательно, элементарное количество прореагировавшего вещества, выражается формулой: dni = n idx (3) Скорость реакции выражается как скорость изменения величины x,:
Если в реакции участвуют промежуточные соединения, то скорости, определенные по разным веществам, могут отличаться. Однако, если концентрации промежуточных веществ очень малы, скорости реакции по разным веществам будут практически одинаковыми. Определенная таким образом скорость реакции не зависит от выбора реагента; это определение можно использовать и в тех случаях, когда в ходе реакции происходит изменение объема или когда система состоит из двух или более числа фаз. На практике скорость реакции выражают через изменение концентрации одного из исходных веществ или продуктов.
Такое определение скорости пригодно только в том случае, если в системе отсутствуют в заметных количествах промежуточные вещества и если в ходе реакции не изменяется объем системы. При этом важно помнить, что если не все стехиометрические коэффициенты равны единице, то очень существенно указать, по изменению концентрации какого вещества определяется скорость реакции. Например, для реакции А + 2В = АВ (6) можно записать
Кинетическое уравнение Кинетическое уравнение реакции представляет собой зависимость скорости реакции v от концентраций исходных продуктов, продуктов реакции, катализаторов и ингибиторов. Для многих реакций скорость пропорциональна концентрациям исходных веществ, возведенных в степени, при условии, что объем не изменяется, а концентрации промежуточных соединений малы, отсюда: v= k[A]n1[B]n2… (8) Уравнение (8) получило название кинетического уравнения. В этом выражении [A или B] – концентрация i – го вещества (продукта, реагента); ni – показатель степени в общем случае не имеющий ничего общего со стехиометрическими коэффициентами ( определяются из измерений скорости реакции ); k - константа скорости реакции (удельная константа скорости реакции). Константой скорости реакции (удельной константой скорости) k называют величину, определенную таким образом, что количество продуктов реакции, образовавшихся в единицу времени в единичном объеме, равно этой константе kf умноженной на некоторую функцию концентраций реагентов. Размерность константы скорости зависит от показателей степени концентрационных множителей. Эти показатели определяют порядок реакции.
Реакция нулевого порядка Существуют реакции, скорость которых не меняется с изменением концентрации одного или нескольких реагирующих веществ, поскольку она определяется не концентрацией, а некоторыми другими ограничивающими факторами, например поглощением света в фотохимических реакциях или количеством катализатора в каталитических реакциях. Также к подобным реакциям относится горение в атмосфере. Тогда
Каталитическая реакция может иметь первый порядок по катализатору и нулевой порядок по реагирующему веществу. Интегрирование дает:
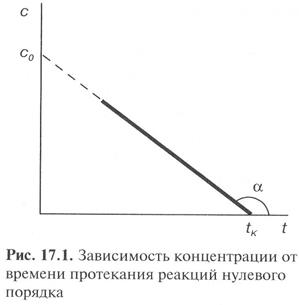
Постоянную интегрирования находят из начальных условий, при t = 0, с = с0. Тогда const = c0 и уравнение приобретает вид:
Оно выражает линейную зависимость концентрации от времени и позволяет определить константу скорости как k0 = -tga.
Из (11) получают кинетическое уравнение для реакции нулевого порядка
Размерность константы скорости моль/л·с. По уравнению (13) можно получить выражения для периода полупревращения для реакции нулевого порядка. t1/2 =с0/(2k0) (14) Период полупревращения реакции нулевого порядка прямо пропорционален исходной концентрации вещества. Реакции первого порядка Скорость реакции первого порядка описывается следующим кинетическим уравнением:
Проинтегрировав получим:
Постоянную интегрирования найдем из условия: при t =0 с = с0. Тогда
Это уравнение можно записать иначе
Из уравнения видно, что размерность k1 не зависит от способа выражения концентрации. Если построить график зависимости ln c от t, то тангенс угла наклона определит константу скорости.
Период полупревращения для реакции первого порядка
и не зависит от начальной концентрации реагирующих веществ. Реакции второго порядка Скорость реакции второго порядка определяется кинетическим уравнением:
Если концентрации равны
Из него следует:
Разделив переменные и проинтегрировав, имеем
Постоянную интегрирования находим из условия: при t=0 с=с0
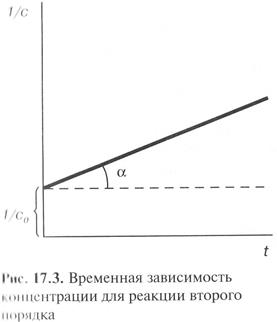
Линейная зависимость для реакций второго порядка наблюдается в координатах 1/с – t. Тангенс угла наклона равен константе скорости.
Период полупревращения для реакции второго порядка:
Период полупревращения для реакций второго порядка обратно пропорционален начальной концентрации веществ. Реакции третьего и более высокого порядка встречаются редко. Интегральные методы Метод подстановки Он заключается в экспериментальном определении концентрации вещества в различные моменты времени от начала реакции. По полученным данным проводят расчет констант скоростей, используя уравнения, нулевого, первого, второго и третьего порядков. Выясняют, по какому уравнению расчет дает практически постоянную величину константы. Графический метод Экспериментально измерив концентрации вещества в различные интервалы времени от начала реакции, строят графики в различных координатах. Реакция, считается, удовлетворяет тому порядку, где указанная зависимость прямолинейна. Определения порядка реакции по периоду полупревращения Как известно, для реакций первого порядка время полупревращения не зависит от начальной концентрации реагирующих веществ, для второго – обратно пропорционально начальной концентрации, для реакций третьего порядка – обратно пропорционально квадрату начальной концентрации. Дифференциальные методы (Метод Вант Гоффа) Дифференциальный метод, предложенный Вант Гоффом, заключается в следующем. Если протекает какая-то реакция n –го порядка, то скорость ее в зависимости от концентрации может быть выражена уравнением: v=kcn. (26) Логарифмирование этого выражения дает: lgv = lgk + nlgc (27) Определяя скорость реакции при различных концентрациях реагирующих веществ и строя график логарифмической зависимости, определяют наклон прямой – порядок реакции. Отрезок на оси ординат – lgk.
Этот метод можно применять в двух вариантах. В первом определяют скорость реакции как производную dc/dt при разных начальных концентрациях. Во втором варианте проводят только один опыт, который заключается в измерении наклонов касательной в различные моменты времени, соответствующие различным значениям концентраций реагентов. Результаты, полученные в том и другом варианте, используются для построения логарифмической зависимости скоростей от концентрации реагентов. Порядок реакции, найденный первым способом, называют концентрационным. Он определен в наиболее простом случае, когда в начале реакции присутствуют в основном исходные вещества. По мере течения реакции образуются промежуточные соединения, которые могут исказить ход реакции. Поэтому порядок, найденный по второму варианту и называемый временной порядок, может отличаться от концентрационного. Если временной порядок выше концентрационного, то это означает, что скорость реакции падает быстрее, чем можно было бы ожидать на основании концентрационного порядка. Сильное падение скорости свидетельствует, что реакция ингибируется промежуточными продуктами. Сложные реакции Кинетика сложных реакций зависит от формы связи между простыми реакциями, от соотношения их скоростей и основывается на принципе независимости простых реакций. Согласно этому принципу, если в системе протекают одновременно несколько реакций, то каждая из них не зависит от других и ее скорость определяется кинетическими уравнениями простых реакций. Обратимые реакции Обратимыми называются реакции, одновременно протекающие в двух противоположных направлениях. Скорость обратимой реакции равна разности скоростей прямой и обратной реакций. Рассмотрим обратимую реакцию первого порядка: kA А ====== В kB В результате прямой реакции концентрация В растет, в результате обратной падает. Выразим скорость суммарной реакции через концентрацию В получим:
Состояние равновесия, характеризуется равенством скоростей прямой и обратной реакций:
Символ “ - означает равновесные концентрации участников реакции. Тогда константу скорости прямой реакции можно выразить так:
Последовательные реакции Последовательными реакциями называют реакции, состоящие из нескольких стадий, следующих друг за другом. Если какая-либо стадия протекает значительно медленнее других, то ее скорость и порядок определяют скорость и порядок всей реакции. Две последовательные реакции первого порядка можно представить схематически: k1 k2 А ® В ® С Если скорости стадий соизмеримы, то для определения зависимости концентрации от времени следует написать кинетические уравнения для каждой стадии, а затем решить их совместно. Аналитической решение задачи связано с определенными сложностями, поэтому рассмотрим только качественные результаты. Качественный характер изменения концентраций от времени представлен на рисунке.
Концентрация вещества А экспоненциально убывает со временем. Концентрация В – проходит через максимум, и снова падает, т. к вещество В полностью превращается в С. Скорость образования С в любой момент пропорциональна концентрации В. Вначале она равна нулю, затем проходит через максимум, когда концентрация В максимальна, а в конце реакции снова приближается к нулю. На этой кривой С имеется период, в течение которого не происходит образования С. Существование такого периода указывает на то, что продукт реакции образуется через промежуточное соединение. Наибольшее количество промежуточного вещества В не зависит от абсолютных скоростей реакций, а определяется их отношением. Чем больше k1/k2, тем больше максимум. Кривая С имеет точку перегиба. В течение некоторого времени, называемого периодом индукции, продукт реакции практически не образуется (кривая идет почти сливаясь с осью). Расчеты показывают, что чем меньше отношение k1/k2, тем больше период индукции. Параллельные реакции Реакции называют параллельными, если исходные вещества одновременно реагируют в нескольких направлениях.
Полная скорость превращения исходного вещества А равна сумме двух скоростей, т.е.
В этом случае кинетическое уравнение тождественно кинетическому уравнению первого порядка с константой скорости, равной сумме констант составляющих реакций. Сопряженные реакции Сопряженными реакциями называют реакции в которых одна идет только в присутствии другой. Например, А + В =М, и А + С = D. В таких реакциях вещество В служит индуктором второй реакции. Вещество С – называют акцептором. Общее для обоих реакций вещество А – актором. Во многих сопряженных реакциях индуктор выступает как катализатор и процесс протекает с образованием нестойких химических соединений. Иногда подразделяют все сопряженные реакции на три типа: 1. Концентрация индуктора во время реакции убывает. 2. Концентрация индуктора не меняется (каталитические реакции). 3. Концентрация индуктора возрастает (автокаталитические реакции). Цепные реакции Цепными называют химические реакции, протекающие путем регулярного повторения элементарных реакций с участием радикалов, атомов или ионов. К ним относятся реакции горения, полимеризации и конденсации, распада ядер и т.д. Различают цепные реакции неразветвленные и разветвленные. Такие реакции являются довольно распространенными и возникают в результате передачи энергии от возбужденной молекулы другой молекуле. Например, при действии света становится возможным возбуждение молекул хлора; они распадаются, давая возбужденные атомы Cl2 = Cl + Cl. Эти возбужденные атомы способны взаимодействовать с молекулами водорода, при этом получается возбужденный атом водорода: Cl + H2 = HCl + H. Цепь продолжает развиваться до тех пор, пока не произойдет ее обрыв: 2H=H2 и 2Cl =Cl2 – обрыв цепи. Эта реакция является примером неразветвленной цепной реакции. Обрыв цепи возможен при столкновении частиц друг с другом, со стенками сосуда, с примесями. Играет роль форма сосуда. На длину цепи также влияет давление и температура. При протекании цепных реакций возможно разветвление. Из одной активной частицы образуется несколько активных частиц – скорость реакции быстро возрастает и процесс может закончиться взрывом. К числу таких реакций относятся термоядерные реакции, реакции горения и окисления.
Если реакция экзотермична, а теплоотдача меньше тепловыделения (в результате реакции), то происходит тепловой взрыв. В разветвленных реакциях, если число возникающих цепей больше числа обрывов, скорость резко возрастает и становится возможным самовоспламенение и взрыв, даже при тех температурах, когда тепловой взрыв невозможен. Взрыв происходит при определенных давлениях в системе. При низких давлениях и температурах самовоспламенение не происходит из-за обрыва цепей в результате ударов о стенки сосуда. При очень высоких давлениях также возможен обрыв, но в результате столкновения активных частиц друг с другом. Скорость разветвленной цепной реакции, согласно теории вероятности будет равна:
где δ – вероятность разветвления цепи; β- вероятность обрыва цепи; Q – вероятность продолжения цепи; (β – δ) – эффективная вероятность обрыва цепи; ν – длинна цепи; v0 – скорость зарождения цепи. Это уравнение показывает, что скорость разветвленной химической реакции, зависит от соотношения скоростей обрыва и разветвления цепи. В случаи (β = δ), для газовой смеси, происходит взрыв. Также в природе имеют место фотохимические реакции, принципы кинетики которых, рассматриваются студентами самостоятельно по учебнику. Кинетическое уравнение реакции включает сумму членов для прямой реакции, что указывает на возможность нескольких путей ее протекания, принцип детального равновесия требует, что бы каждый член в выражении для скорости прямой реакции был компенсирован при равновесии соответствующим членом в выражении для скорости обратной реакции.
КИНЕТИКА ГЕТЕРОГЕННЫХ ПРОЦЕССОВ. ПЕРВЫЙ И ВТОРОЙ ЗАКОНЫ ФИКА ИЗУЧАЮТСЯ ПО УЧЕБНИКУ САМОСТОЯТЕЛЬНО.
Теория активных соударений.
Кинетика химических реакций.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 8663; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.85.74 (0.013 с.) |

 (4)
(4) (5)
(5) (7)
(7) (10)
(10)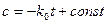 (11)
(11)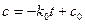 (12)
(12)
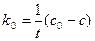 (13)
(13)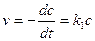 (15)
(15) (16)
(16)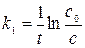 (17)
(17)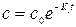 (18)
(18)
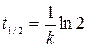 (19)
(19)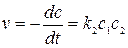 (20)
(20)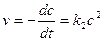 (21)
(21) (21)
(21) (22)
(22)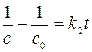 (23)
(23)
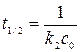 (24)
(24)
 (28)
(28) (29)
(29)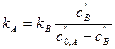 (30)
(30)

 (31)
(31)
 (32)
(32)


