
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизмы химических реакций.Содержание книги
Поиск на нашем сайте
Большинство реакций протекает в несколько стадий. Даже если скорость реакции описывается простым кинетическим уравнением, реакция может состоять из нескольких стадий. Одной из задач кинетики является определение промежуточных стадий, потому что таким путем можно понять, как протекает реакция. Совокупность элементарных реакций представляет механизм реакции. При рассмотрении механизма реакции говорят о молекулярности стадий, которая определяется числом реагирующих молекул, участвующих в элементарной реакции. Установить молекулярность реакции, можно только зная ее механизм. Дело в том, что не так просто установить, сколько молекул «непосредственно» принимают участие в реакции. Например, элементарный акт распада одной молекулы А на две P и Q, может произойти только тогда, когда молекула А получит некоторую дополнительную энергию сверх той, которой она обладает в основном состоянии. Если реакция происходит в газовой фазе, то эту дополнительную энергию молекула может получить только в результате столкновения с другой молекулой А. Такой элементарный акт можно записать в виде: А + А = (P + Q) + А (25) Молекулярность такой реакции равна единице, т.к. одна из сталкивающихся молекул участвует в процессе только косвенным образом. Нужно помнить, что процесс установления механизма какой-либо реакции нельзя описать кратко.
Методы определения порядка химических реакций Для определения порядка реакции в основном используют две группы методов: интегральные и дифференциальные. Интегральные методы Метод подстановки Он заключается в экспериментальном определении концентрации вещества в различные моменты времени от начала реакции. По полученным данным проводят расчет констант скоростей, используя уравнения, нулевого, первого, второго и третьего порядков. Выясняют, по какому уравнению расчет дает практически постоянную величину константы. Графический метод Экспериментально измерив концентрации вещества в различные интервалы времени от начала реакции, строят графики в различных координатах. Реакция, считается, удовлетворяет тому порядку, где указанная зависимость прямолинейна. Определения порядка реакции по периоду полупревращения Как известно, для реакций первого порядка время полупревращения не зависит от начальной концентрации реагирующих веществ, для второго – обратно пропорционально начальной концентрации, для реакций третьего порядка – обратно пропорционально квадрату начальной концентрации. Дифференциальные методы (Метод Вант Гоффа) Дифференциальный метод, предложенный Вант Гоффом, заключается в следующем. Если протекает какая-то реакция n –го порядка, то скорость ее в зависимости от концентрации может быть выражена уравнением: v=kcn. (26) Логарифмирование этого выражения дает: lgv = lgk + nlgc (27) Определяя скорость реакции при различных концентрациях реагирующих веществ и строя график логарифмической зависимости, определяют наклон прямой – порядок реакции. Отрезок на оси ординат – lgk.
Этот метод можно применять в двух вариантах. В первом определяют скорость реакции как производную dc/dt при разных начальных концентрациях. Во втором варианте проводят только один опыт, который заключается в измерении наклонов касательной в различные моменты времени, соответствующие различным значениям концентраций реагентов. Результаты, полученные в том и другом варианте, используются для построения логарифмической зависимости скоростей от концентрации реагентов. Порядок реакции, найденный первым способом, называют концентрационным. Он определен в наиболее простом случае, когда в начале реакции присутствуют в основном исходные вещества. По мере течения реакции образуются промежуточные соединения, которые могут исказить ход реакции. Поэтому порядок, найденный по второму варианту и называемый временной порядок, может отличаться от концентрационного. Если временной порядок выше концентрационного, то это означает, что скорость реакции падает быстрее, чем можно было бы ожидать на основании концентрационного порядка. Сильное падение скорости свидетельствует, что реакция ингибируется промежуточными продуктами. Сложные реакции Кинетика сложных реакций зависит от формы связи между простыми реакциями, от соотношения их скоростей и основывается на принципе независимости простых реакций. Согласно этому принципу, если в системе протекают одновременно несколько реакций, то каждая из них не зависит от других и ее скорость определяется кинетическими уравнениями простых реакций. Обратимые реакции Обратимыми называются реакции, одновременно протекающие в двух противоположных направлениях. Скорость обратимой реакции равна разности скоростей прямой и обратной реакций. Рассмотрим обратимую реакцию первого порядка: kA А ====== В kB В результате прямой реакции концентрация В растет, в результате обратной падает. Выразим скорость суммарной реакции через концентрацию В получим:
Состояние равновесия, характеризуется равенством скоростей прямой и обратной реакций:
Символ “ - означает равновесные концентрации участников реакции. Тогда константу скорости прямой реакции можно выразить так:
Последовательные реакции Последовательными реакциями называют реакции, состоящие из нескольких стадий, следующих друг за другом. Если какая-либо стадия протекает значительно медленнее других, то ее скорость и порядок определяют скорость и порядок всей реакции. Две последовательные реакции первого порядка можно представить схематически: k1 k2 А ® В ® С Если скорости стадий соизмеримы, то для определения зависимости концентрации от времени следует написать кинетические уравнения для каждой стадии, а затем решить их совместно. Аналитической решение задачи связано с определенными сложностями, поэтому рассмотрим только качественные результаты. Качественный характер изменения концентраций от времени представлен на рисунке.
Концентрация вещества А экспоненциально убывает со временем. Концентрация В – проходит через максимум, и снова падает, т. к вещество В полностью превращается в С. Скорость образования С в любой момент пропорциональна концентрации В. Вначале она равна нулю, затем проходит через максимум, когда концентрация В максимальна, а в конце реакции снова приближается к нулю. На этой кривой С имеется период, в течение которого не происходит образования С. Существование такого периода указывает на то, что продукт реакции образуется через промежуточное соединение. Наибольшее количество промежуточного вещества В не зависит от абсолютных скоростей реакций, а определяется их отношением. Чем больше k1/k2, тем больше максимум. Кривая С имеет точку перегиба. В течение некоторого времени, называемого периодом индукции, продукт реакции практически не образуется (кривая идет почти сливаясь с осью). Расчеты показывают, что чем меньше отношение k1/k2, тем больше период индукции. Параллельные реакции Реакции называют параллельными, если исходные вещества одновременно реагируют в нескольких направлениях.
Полная скорость превращения исходного вещества А равна сумме двух скоростей, т.е.
В этом случае кинетическое уравнение тождественно кинетическому уравнению первого порядка с константой скорости, равной сумме констант составляющих реакций. Сопряженные реакции Сопряженными реакциями называют реакции в которых одна идет только в присутствии другой. Например, А + В =М, и А + С = D. В таких реакциях вещество В служит индуктором второй реакции. Вещество С – называют акцептором. Общее для обоих реакций вещество А – актором. Во многих сопряженных реакциях индуктор выступает как катализатор и процесс протекает с образованием нестойких химических соединений. Иногда подразделяют все сопряженные реакции на три типа: 1. Концентрация индуктора во время реакции убывает. 2. Концентрация индуктора не меняется (каталитические реакции). 3. Концентрация индуктора возрастает (автокаталитические реакции). Цепные реакции Цепными называют химические реакции, протекающие путем регулярного повторения элементарных реакций с участием радикалов, атомов или ионов. К ним относятся реакции горения, полимеризации и конденсации, распада ядер и т.д. Различают цепные реакции неразветвленные и разветвленные. Такие реакции являются довольно распространенными и возникают в результате передачи энергии от возбужденной молекулы другой молекуле. Например, при действии света становится возможным возбуждение молекул хлора; они распадаются, давая возбужденные атомы Cl2 = Cl + Cl. Эти возбужденные атомы способны взаимодействовать с молекулами водорода, при этом получается возбужденный атом водорода: Cl + H2 = HCl + H. Цепь продолжает развиваться до тех пор, пока не произойдет ее обрыв: 2H=H2 и 2Cl =Cl2 – обрыв цепи. Эта реакция является примером неразветвленной цепной реакции. Обрыв цепи возможен при столкновении частиц друг с другом, со стенками сосуда, с примесями. Играет роль форма сосуда. На длину цепи также влияет давление и температура. При протекании цепных реакций возможно разветвление. Из одной активной частицы образуется несколько активных частиц – скорость реакции быстро возрастает и процесс может закончиться взрывом. К числу таких реакций относятся термоядерные реакции, реакции горения и окисления.
Если реакция экзотермична, а теплоотдача меньше тепловыделения (в результате реакции), то происходит тепловой взрыв. В разветвленных реакциях, если число возникающих цепей больше числа обрывов, скорость резко возрастает и становится возможным самовоспламенение и взрыв, даже при тех температурах, когда тепловой взрыв невозможен. Взрыв происходит при определенных давлениях в системе. При низких давлениях и температурах самовоспламенение не происходит из-за обрыва цепей в результате ударов о стенки сосуда. При очень высоких давлениях также возможен обрыв, но в результате столкновения активных частиц друг с другом. Скорость разветвленной цепной реакции, согласно теории вероятности будет равна:
где δ – вероятность разветвления цепи; β- вероятность обрыва цепи; Q – вероятность продолжения цепи; (β – δ) – эффективная вероятность обрыва цепи; ν – длинна цепи; v0 – скорость зарождения цепи. Это уравнение показывает, что скорость разветвленной химической реакции, зависит от соотношения скоростей обрыва и разветвления цепи. В случаи (β = δ), для газовой смеси, происходит взрыв. Также в природе имеют место фотохимические реакции, принципы кинетики которых, рассматриваются студентами самостоятельно по учебнику.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1425; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.130.228 (0.01 с.) |


 (28)
(28) (29)
(29)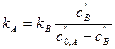 (30)
(30)

 (31)
(31)
 (32)
(32)


