
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скорость реакции пропорциональна концентрации реагирующих веществ.Содержание книги
Поиск на нашем сайте
Множитель «К», показывающий, с какой скоростью идет химический процесс при концентрациях реагирующих веществ равных единице, называется константой скорости химического процесса. Наряду со скоростью константа скорости химического процесса является основной величиной в химической кинетике.
Кинетическая классификация химических реакций
В кинетике химические реакции разделяются по признаку молекулярности и по признаку порядка реакции.
Молекулярность реакции Наименьшее число частиц в элементарном акте химического превращения определяет молекулярность реакции. Если реакция aA + bB К мономолекулярным реакциям относятся некоторые реакции разложения молекул, реакции внутримолекулярных перегруппировок, реакции радиоактивного распада. J2 → 2J
К бимолекулярным реакциям относятся такие, в которых взаимодействие происходит при столкновении двух молекул различного или одинакового вида:
2 НJ → H2 + J2
К тримолекулярным относятся реакции, в которых необходимо столкновение трех молекул: 2 NO + H2 → N2O + H2O. Если же реакция происходит через несколько элементарных актов, то каждый акт имеет свою молекулярность. Например, в реакции Н2(г) + Br2(г) → 2 HBr(г) (а) Происходят следующие стадии: 1. Br2(г) → 2 Br (мономолекулярная стадия); 2. Br +Н2→ HBr(г) + Н (бимолекулярная стадия); 3. Н + Br2(г)
По виду стехиометрического уравнения (а) нельзя судить о молекулярности реакции, надо знать механизм течения реакции, а значит классифицировать по молекулярности можно лишь реакции, протекающие в одну стадию. Поэтому для характеристики кинетики экспериментально изучаемых реакций вводится более формальный признак – порядок реакции.
Порядок реакции Порядок реакции по данному веществу – число, равное степени, в которой концентрация этого вещества входит в кинетическое уравнение реакции:
где m – частный порядок по веществу А; n - частный порядок по веществу В. Сумма показателей степеней, в которых концентрации всех исходных веществ входят в кинетическое уравнение, определяет порядок реакции. Если реакция проходит в одну стадию, то молекулярность совпадает с ее порядком. Обычно же порядок не совпадает с молекулярностью. Это происходит потому, что реакции, как правило, не протекают путем непосредственного взаимодействия одновременно всех исходных частиц с прямым переходом их в продукты реакции. Это прежде всего относится к тем реакциям, в которых принимает участие более трех частиц. Однако, даже реакции, в которых участвуют две или одна молекулы, часто идут не по бимолекулярному или мономолекулярному механизму, а более сложным путем. В простейшем случае, когда одна из стадий протекает очень медленно по сравнению с остальными, скорость (и порядок) реакции определяется этой наиболее медленной реакцией, которая называется лимитирующей. Если же скорости реакций отдельных стадий сравнимы, а эти стадии являются к тому же сложными, то картина еще более усложняется. В общем случае коэффициенты в стехиометрическом уравнении аА + вВ
будут различны, а порядок реакции равен сумме показателей в кинетическом уравнении: m + n. Реакции могут быть первого, второго, третьего, дробного и нулевого порядков. Так, рассмотренная нами выше реакция Н2(г) + Br2(г) → 2 HBr(г) является реакцией полуторного порядка, так как стадия (1) – реакция первого порядка, стадии (2) и (3) – второго порядка, причем стадия (3) является сложной (обратимой). В целом реакция имеет полуторный порядок. Реакциями нулевого порядка называют реакции, в которых скорость процесса сохраняется постоянной во времени. Это встречается в некоторых гетерогенных системах. Так, если в реакции омыления сложного эфира водой в разбавленном водном растворе СН3СООС2Н5 + Н2О → СН3СООН + С2Н5ОН применять эфир, малорастворимый в воде, и взять его в избытке, чтобы в системе присутствовал эфирный слой, то расход эфира будет постоянно восполняться из эфирного слоя. Таким образом, концентрация его в водном растворе будет постоянной. Но так как реакция идет в разбавленном водном растворе, то есть в присутствии избытка воды, то концентрация воды изменяется весьма незначительно, ее можно считать тоже постоянной, следовательно, постоянной будет скорость процесса. И реакция в целом имеет нулевой порядок. Если же только один из компонентов, например, вода, в избытке, то расход ее в реакции практически не отражается на ее концентрации (порядок по воде равен нулю) и скорость реакции зависит лишь от изменения концентрации эфира. Порядок реакции в этом случае равен порядку по эфиру.
Реакции первого порядка
Пусть реакция является кинетически необратимой реакцией первого порядка. Составим дифференциальное уравнение которым описывается изменение концентрации исходного вещества А:
Поскольку А – единственное исходное вещество впредь будем опускать индекс А. Решаем дифференциальное уравнение:
Уравнение (3.2) является уравнением прямой в координатах (lnC; t), рисунок 3.2.
Рисунок 3.2 – Зависимость lnC от времени для реакций первого порядка
Константа скорости может быть найдена как тангенс угла наклона прямой. Определенное интегрирование дает:
то есть константа не зависит от способа выражения концентрации. Размерность константы [t-1]. Если известна константа скорости k, то можно определить текущую концентрацию:
Отсюда Существенное значение имеет время, за которое концентрация исходного вещества упадет в два раза, так называемое время полураспада (t1/2) или полупериод реакции.
Таким образом, из уравнения (3.4) видно, что полупериод реакции первого порядка не зависит от начальной концентрации. Скорость, разумеется, будет зависеть от концентрации (рисунок 3.3).
Рисунок 3.3 – Кинетическая кривая реакции первого порядка
Как видно из рисунка 3.3 время, за которое начальная концентрация упадет вдвое, сохраняется постоянным для данной реакции, а скорость понижается (кривые становятся более пологими с уменьшением начальной концентрации).
Реакции второго порядка
Кинетическое уравнение для реакции второго порядка имеет вид: А + В → С + D. Приведем выводы (аналогичные реакции первого порядка), для простоты, полагая, что концентрации веществ А и В одинаковы:
Полученное уравнение – линейная зависимость
Рисунок 3.4 – Зависимость
Из уравнения (3.5) выводится значение константы скорости реакции второго порядка:
Время полупериода вычисляется так:
Отсюда видно, что время полураспада зависит от начальной концентрации. Во сколько раз уменьшается концентрация, во столько раз увеличивается полупериод реакции.
Рисунок 3.5 – Кинетическая кривая реакции второго порядка
Если же исходные концентрации веществ А и В различны, то константа скорости определяется уравнением:
где
|
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 184; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.156.17 (0.009 с.) |

 cC + +dD протекает в одну стадию, то есть является элементарной, то молекулярность ее равна величине а+b, то есть сумме стехиометрических коэффициентов исходных веществ. Молекулярность - всегда целое число. Существуют моно-, би- и, редко, тримолекулярные реакции. Вероятность столкновений четырех и более частиц невелика.
cC + +dD протекает в одну стадию, то есть является элементарной, то молекулярность ее равна величине а+b, то есть сумме стехиометрических коэффициентов исходных веществ. Молекулярность - всегда целое число. Существуют моно-, би- и, редко, тримолекулярные реакции. Вероятность столкновений четырех и более частиц невелика.

 ,
,
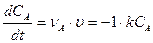 .
.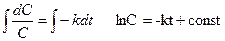 . (3.2)
. (3.2)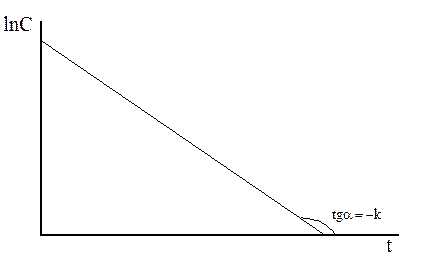

 .
. - уравнение текущей концентрации. (3.3)
- уравнение текущей концентрации. (3.3) . (3.4)
. (3.4)
 .
.
 , из которой можно графически определить константу скорости как тангенс угла наклона прямой,
, из которой можно графически определить константу скорости как тангенс угла наклона прямой,  .
.
 от времени для реакций второго порядка
от времени для реакций второго порядка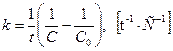 .
.

 ,
, - начальные концентрации веществ А и В; СА, СВ – текущие концентрации к моменту времени t от начала реакции.
- начальные концентрации веществ А и В; СА, СВ – текущие концентрации к моменту времени t от начала реакции.


