
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетические различия между простой и сложной реакциямиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Одна из задач, которая возникает при кинетическом исследовании, заключается в выяснении, является реакция простой или сложной. Ниже перечислены кинетические признаки, по которым можно отличить простую реакцию от сложной. Следует иметь ввиду, что для признания реакции сложной достаточно проявления у нее хотя бы одного из нижеперечисленных признаков. Таблица 3.1 - Кинетические признаки простых и сложных реакций
Примеры решения задач
Задача 1 Время половинного разложения уксусно-этилового эфира (С0 = 0,025 моль/л) щелочью (С0 = 0,050 моль/л) равно 6,81 мин. Определить время разложения эфира на 80 %. Реакция второго порядка. Дано:
t1/2 = 681 мин β = 0,8 n = 2
Решение: СН3СООС2Н5 + NaOH → СН3СООNa + С2Н5OH t = 0 0,025 0,050 t1/2 = 6,81 0,025-0,025∙1/2 0,050-0,025∙1/2 t =? 0,025-0,025∙0,8 0,050-0,025∙0,8
При расчете текущей концентрации следует учесть, что по уравнению реакции исходные вещества реагируют в соотношении 1: 1, поэтому в любой момент времени количество прореагировавших эфира и щелочи одинаково. Можно рассчитать константу равновесия из данных второй строчки, то есть через 6,81 минут от начала реакции.
Задача 2 При 310 0С AsH3 (газ) разлагается с образованием твердого мышьяка и водорода. Во время реакции давление в системе изменяется следующим образом:
Показать, что реакция является реакцией первого порядка и вычислить константу скорости.
Решение: Для подтверждения первого порядка используем графический метод, по которому зависимость lnP от t должна быть линейной. Под логарифмом стоит текущее давление исходного компонента AsH3. В то же время в таблице дано давление в системе, то есть общее давление, состоящее из исходного AsH3 и образующегося Н2, поэтому следует из общего давления выделить давление AsH3.
2AsH3 → 2As + 3 Н2 газ тв газ t = 0 P0 0 t P0-x 3/2x
Отсюда текущее давление AsH3:
Р0 =733 мм.рт.ст. при t = 0. Данные текущего давления заносим в таблицу, строим график lnP = f (t).
Константу скорости можно найти из графика, поскольку
Задача 3 Определить порядок реакции: 2СО → СО2 + С, если при постоянной температуре в одном опыте начальное давление СО упало с 787 до 688 мм.рт.ст. за 10 минут, а в другом с 535 до 468 мм.рт.ст. за это же время.
Дано:
P 1 = 688 мм.рт.ст. ∆ t 1 = ∆ t 2 = 10 мин
P 2 = 468 мм.рт.ст. n =?
Решение: В данном случае порядок можно определить методом начальных скоростей:
Задача 4 При изучении реакции 2NO + 2H2 → N2 + 2H2O при начальных давлениях NO и H2 равных 4,72∙104 Па в первом опыте и 2,69∙104 Па во втором половина вещества прореагировала за 81 с и 239 с соответственно. Определить порядок реакции.
Дано:
а1 = а2 = 1/2 n =?
Решение: Поскольку в обоих опытах доля непрореагировавшего вещества одинакова, то порядок определим по уравнению:
В данном случае получен общий порядок реакции, так как исходные давления взяты в стехиометрическом соотношении. Задача 5 Для обратимой газофазной реакции K1 А K2 начальные давления А и В соответственно равны 1,33∙104 Па и 0. Через 10 минут после начала реакции РА = 5,3∙103 Па. Определить значение РА и РВ через 40 минут после начала реакции, если Дано:
t1 = 10 мин Р 1А = 5,3∙103 Па t2 = 20 мин
Р 2(А) =? Р 2(В) =? К 1 =? К 2 =?
Решение Представим данные задачи следующим образом: K1 А K2 t = 0 t1 = 10 мин t2 = 20 мин t = ∞ (равновесие) Для нахождения констант скоростей прямой и обратной реакций используем систему уравнений (3.19) и (3.20).
Первое из уравнений может быть отнесено к 10 минутам от начала реакции. По условию Р 1А = x 1 = 1,33∙104 -0,53∙104 = 0,80∙104 Па.
x равн. можно найти по закону действующих масс из константы равновесия, которая равна Кр =
Составляем систему уравнений
К 1 = 0,12 мин-1; К 2 = 0,04 мин-1.
Давление А через 20 минут равно
x 2 находим по уравнению (3.21)
Р 2(А) = 1,33∙104 -0,96∙104 = 0,37∙104 Па. Вещества В образовалось столько же, сколько израсходовалось вещества А, то есть Р 2(В) = 0,96∙104 Па. Задача 6 В условиях ацетолиза β-D-глюкопиранозы (А), наряду с пентаацетатом D-глюкопиранозы (В) образуется также некоторое количество продукта (С). Через 20 минут от начала реакции осталось от одного моля А 0,845 моль. При этом образовалось 0,012 моль вещества С. Рассчитать К 1и К 2. Дано: а = 1 моль а – х = 0,845 моль t = 20 минут хс = 0,012 моль К 1 =? К 2 =? Решение Реакция является параллельной
Для нахождения К 1 и К 2 надо решить систему уравнений
а – х = 0,845 х = хС + хВ
К 1= 12 К 2 К 1 + К 2 = 13 К 2 = 8,42∙10-3 К 2 = 0,65∙10-3 мин-1 К 1 = 7,77∙10-3 мин-1 Задача 7 Реакция термического крекинга нефти (Н) является последовательной, причем бензин (Б) является промежуточным продуктом, распадающимся на газообразные вещества (Г). Определить максимальное количество бензина и время его достижения при крекинге 1 тонны нефти, если при 673 К константа образования бензина равна 0,283 ч-1, а распада – равна 0,102 ч-1. Дано: m0(H) = 1 т К 1 = 0,283 ч-1 К 2 = 0,102 ч-1 tmax (Б) =? mmax (Б) =? Решение: Реакция является последовательной, схематически может быть представлена так:
Количество образовавшегося бензина через 5,6 ч определяем по уравнению (3.22). m (Б) = Задача 8 Получить выражение скорости реакции разложения гидрида силана SiH4 → Si + 2H2, протекающей через стадии SiH4 SiH2 SiH2 + H2
Решение: Запишем общее выражение для искомой скорости. Обозначим концентрацию веществ в виде С(А) ≡ [A].
Промежуточное вещество SiH2 является неустойчивым и реакционно-активным, следовательно, можно применить к данному процессу метод стационарных концентраций.
[ SiH2 ] = Подставив это значение в выражение для скорости разложения SiH4, найдем:
Вопросы для самоконтроля 1. Сформулировать и записать основной постулат химической кинетики. 2. Указать размерность констант скоростей нулевого, первого, второго порядков. 3. Изобразить линейные зависимости концентрации от времени для реакций нулевого, первого, второго порядков. 4. Сформулировать принцип независимости химических реакций. 5. Записать систему уравнений для расчета констант скоростей: а) параллельных реакций; б) обратимых реакций. 6. Выразить скорость образования продукта Р, используя метод стационарных концентраций, учитывая, что вещество В – активное промежуточное соединение. 2 A 7. Каков физический смысл энергии активации? Как величина энергии активации влияет на величину скорости реакции? 8. Записать уравнение Аррениуса в дифференциальном и интегральном виде. Пояснить. 9. Перечислить методы определения порядка реакции. 10. Для реакций какого порядка время полураспада не зависит от начальной концентрации?
Литература 1 Стромберг, А. Г. Физическая химия [Текст] / А. Г. Стромберг, Д. П. Семченко. - М.: Высшая школа, 2006. - 527 с. 2 Романовский, Б. В. Основы химической кинетики [Текст] / Б. В. Романовский. - М.: «Экзамен» Москва, 2006. - 416 с. 3 Физическая химия [Текст] в 2 кн. / под ред. К. С. Краснова. - М.: Высшая школа, 2001. - Кн.1. - 512 с., Кн.2. - 319 с. 4 Дамаскин, Б. Б. Электрохимия [Текст] / Б. Б. Дамаскин, О. А. Петрий, Г. А. Цирлина. - М.: КолосС, 2006. - 672 с. 5 Краткий справочник физико-химических величин / под ред. А. А. Равделя, А. М. Пономаревой. – М.: изд-во Иван Федоров, 2009. - 232 с. 6 Рекомендации и номенклатурные правила ИЮПАК по химии: книга- справочник / сост. Б. Ф. Мясоедов, Ю. А. Золотов, В. М. Иванов [и др.] [Текст]. - М.: Наука, 2004. - 158 с.
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 1524; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.008 с.) |

 2HBr
описывается формулой
υ = k[Н2][Вr2]1/2∙(1 +K´[HBr]/[Br2]-1.
2HBr
описывается формулой
υ = k[Н2][Вr2]1/2∙(1 +K´[HBr]/[Br2]-1.
 = 0,025 моль/л
= 0,025 моль/л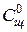 = 0,050 моль/л
= 0,050 моль/л По рассчитанному значению константы, из этого же уравнения находится время, в течение которого прореагирует 80 % эфира, то есть
По рассчитанному значению константы, из этого же уравнения находится время, в течение которого прореагирует 80 % эфира, то есть  (данные третьей строки).
(данные третьей строки).


 , м.рт.ст.
, м.рт.ст.



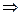
 .
.
 = 787 мм.рт.ст.
= 787 мм.рт.ст.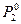 =535 мм.рт.ст.
=535 мм.рт.ст.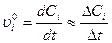 ,
, ,
, ,
,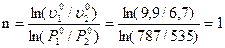 .
.
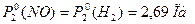



 .
.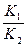 = 3. Найти К 1 и К 2.
= 3. Найти К 1 и К 2. = 1,33∙104 Па
= 1,33∙104 Па = 0
= 0 0
0
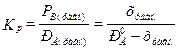 =
=  = 3, откуда x равн.= 1,00∙104 Па
= 3, откуда x равн.= 1,00∙104 Па

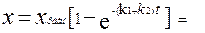 1,00∙104
1,00∙104 


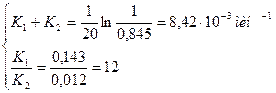


 .
. (e-k1tmax - e-k2tmax)=
(e-k1tmax - e-k2tmax)=  (e- 0,283∙5,6 - e- 0,102∙5,6 )= 0,58 т
(e- 0,283∙5,6 - e- 0,102∙5,6 )= 0,58 т SiH2+ H2;
SiH2+ H2; Si + H2;
Si + H2; SiH4.
SiH4.
 . Откуда находим [ SiH2 ]:
. Откуда находим [ SiH2 ]: .
.



