
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Повышение температуры кипения идеального раствораСодержание книги
Поиск на нашем сайте
Кипение жидкости наступает тогда, когда давление насыщенного пара над раствором равно внешнему давлению. Зависимость давления насыщенного пара от температуры определяется уравнением Клаузиуса-Клапейрона
Рисунок 1.3 - Давление пара в зависимости от температуры: 1 - для чистого растворителя; 2, 3 - для растворов, Сз > С2; 4 - для твердого чистого растворителя Давление насыщенного пара чистого растворителя равно внешнему при где Кэ - эбулиоскопическая постоянная - величина, равная повышению температуры кипения одномоляльного раствора неэлектролита. Значение Кэ определяется свойствами растворителя, где М1 - молярная масса растворителя, кг/моль; Таким образом, величина DT не зависит от природы растворенного вещества, а лишь от его концентрации и природы растворителя. (Это относится к растворам неэлектролитов; в случае электролитных растворов за счет диссоциации число частиц растворенного вещества увеличивается, DР и DT увеличиваются).
Понижение температуры замерзания раствора При кристаллизации чистого растворителя в равновесии находятся три фазы:
При кристаллизации растворителя из раствора:
Условием равновесия фаз является равенство химических потенциалов вещества в различных фазах:
При этом в первом случае давление пара над чистым твердым и чистым жидким растворителем будет одним и тем же,
где b - моляльность растворенного вещества; Кк - криоскопическая постоянная, равная понижению температуры замерзания растворителя при кристаллизации его из одномоляльного раствора неэлектролита:
где М 1, Значения К э и Кк - табличные данные. В случае растворов электролитов число растворенных частиц увеличивается за счет диссоциации, давление пара понижается, понижается и температура замерзания, то есть
Осмотическое давление
Поясним понятие осмоса в растворах (рисунок 1.4). Поместим в сосуд (А) чистый растворитель. Трубка (В) заканчивается расширением. Широкий конец этой трубки закрывается полупроницаемой перегородкой (С). В трубку (В) наливается раствор до уровня жидкости в сосуде (А). Через полупроницаемую перегородку растворитель из сосуда (А) переходит в раствор в сосуде ( В ). Самопроизвольный переход растворителя через полупроницаемую перегородку в раствор называется осмосом. Частицы растворенного вещества через полупроницаемую перегородку перейти при этом не могут. Объем раствора в трубке (В) увеличивается. Через некоторое время подъем уровня раствора прекратится. Этому состоянию отвечает равенство двух противоположных сил: силе осмотического давления, способствующей всасыванию растворителя в раствор, и гидростатического давления столба жидкости (h), препятствующего осмосу.
Рисунок 1.4 – Простейший прибор для измерения осмотического давления А – внешний сосуд, В – внутренний сосуд, С – полупроницаемая мембрана
Если в сосуд (А) поместить раствор с концентрацией большей, чем в (В), то растворитель будет переходить из (В) в (А) (обратный осмос). Обратный осмос наблюдается и при создании давления в трубке В больше осмотического. При этом возникает миграция молекул растворителя из раствора в сосуд А. Этим методом опресняют морскую воду. Осмотическое давление зависит от концентрации растворенного вещества и температуры по уравнению Вант-Гоффа:
где Уравнение (1.4) справедливо для разбавленных растворов неэлектролитов. В растворах электролитов из-за диссоциации на ионы, число частиц будет больше, чем в растворах неэлектролитов, при тойже концентрации. Вследствие этого, осмотическое давление будет больше:
где i - изотонический коэффициент, i >1. Явление осмоса и осмотическое давление играют важную роль в жизнедеятельности живых и растительных организмов, в технологических процессах - везде, где есть полупроницаемые перегородки. Нормальное осмотическое давление клеточного сока у человека 7,5 -7,9 атм. Любое нарушение осмотического давления вызывает заболевание или свидетельствует о заболевании. В очаге воспаления осмотическое давление увеличивается до 15 -20 атм. Клетка, например, дрожжевая, помещенная в дистиллированную воду, будет набухать и станет упругой и эластичной. В некоторых случаях избыточная вода может привести к разрыву оболочки и гибели клетки (например, красные кровяные тельца гибнут при поступлении воды внутрь, происходит, так называемый, гемолиз). Если клетка помещена в концентрированный раствор, то происходит переход воды из сока клетки в раствор, обезвоживание клетки, сморщивание ее, так называемый, плазмолиз, который вызывает нарушение нормального течения физических и химических процессов. В процессе консервирования и сахар, и соль вызывают плазмолиз клетки микроорганизмов и, тем самым, обеззараживают систему. Кроме того, плазмолиз растительных клеток в растворе соли нарушает полупроницаемые клеточные оболочки. При этом выделяется клеточный сок, содержащий сахара, служащие основой молочно-кислого брожения. Полученная молочная кислота является антисептиком и придает специфический вкус продукту.
Реальные растворы Отклонения от закона Рауля В реальных растворах закон Рауля применим для растворителя лишь в бесконечно разбавленных растворах. В более концентрированных растворах за счет сил межмолекулярного взаимодействия наблюдаются отклонения от закона Рауля. а) Положительные отклонения Если
Положительные отклонения наблюдаются в системах: этанол - диэтиловый эфир; бензол - ацетон; кислород - азот и других. б) Отрицательные отклонения от идеального поведения характерны для растворов, компоненты которых взаимодействуют друг с другом сильнее, чем однородные молекулы, то есть εА-В > εА-А; εА-В > εВ-В. При этом возникают водородные связи, происходит сольватация, а иногда образуются химические соединения. Теплота при смешении выделяется, Такие отклонения наблюдаются в системах хлороформ - бензол; вода - серная кислота и других.
Рисунок 1.5 - Зависимость давления пара от состава раствора в реальных системах: а) положительные отклонения; б) отрицательные отклонения от закона Рауля
Иногда при одних соотношениях компонентов в растворе наблюдаются положительные отклонения, при других - отрицательные. Пример - раствор пиридина в воде (рисунок 1.6). Зависимость общего давления от состава жидкости в системах с отклонениями от закона Рауля будет также нелинейной (рисунки 1.5 и 1.6).
Рисунок 1.6 – Давление в системе пиридин – вода
В системах со значительными отклонениями от закона Рауля на диаграмме Робщ = f(Xж) возможно появление экстремума (минимума или максимума). Экстремум может появиться и при небольшом отклонении от идеального поведения, если давление пара над чистыми компонентами мало отличаются друг от друга, то есть
Рисунок 1.7 – Кривые общего давления с максимумом
|
||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 379; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.223.30 (0.006 с.) |

 , рисунок 1.3.
, рисунок 1.3.
 , давление паров над растворами (2 и 3) при этой температуре меньше давления пара чистого растворителя (по закону Рауля), следовательно, оно меньше внешнего, и потому кипения растворов не будет. Внешнее давление для них достигается при более высоких температурах
, давление паров над растворами (2 и 3) при этой температуре меньше давления пара чистого растворителя (по закону Рауля), следовательно, оно меньше внешнего, и потому кипения растворов не будет. Внешнее давление для них достигается при более высоких температурах  . Величина повышения температуры кипения:
. Величина повышения температуры кипения:  · b,
· b, ,
, - температура кипения чистого растворителя при Р = 1 атм, К;
- температура кипения чистого растворителя при Р = 1 атм, К;  - молярная теплота испарения растворителя, Дж/моль.
- молярная теплота испарения растворителя, Дж/моль.



 (точка 0, рисунок 1.3). Это равенство наступает при температуре
(точка 0, рисунок 1.3). Это равенство наступает при температуре  . Во втором же случае равенство давлений и равновесие двух фаз достигается при более низкой температуре, чем температура замерзания чистого растворителя (
. Во втором же случае равенство давлений и равновесие двух фаз достигается при более низкой температуре, чем температура замерзания чистого растворителя ( и
и  рисунок 1.3). Это понижение зависит от концентрации раствора:
рисунок 1.3). Это понижение зависит от концентрации раствора: b,
b, ,
, и
и  соответственно молярная масса, кг/моль; температура, К; молярная теплота плавления растворителя, Дж/моль.
соответственно молярная масса, кг/моль; температура, К; молярная теплота плавления растворителя, Дж/моль. <
<  .
.
 , (1.4)
, (1.4) - осмотическое давление, Па; С - концентрация растворенного вещества в растворе, моль/м3; R - газовая постоянная, Дж/(моль×К); Т - температура, К.
- осмотическое давление, Па; С - концентрация растворенного вещества в растворе, моль/м3; R - газовая постоянная, Дж/(моль×К); Т - температура, К. ,
,
 ;
;  >
>  > 0 (объем увеличивается), а
> 0 (объем увеличивается), а 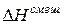 > 0 (тепло поглощается). При этом за счет ослабления сил взаимодействия выход молекул в паровую фазу облегчается и давление пара над реальным раствором становится больше, чем над идеальным:
> 0 (тепло поглощается). При этом за счет ослабления сил взаимодействия выход молекул в паровую фазу облегчается и давление пара над реальным раствором становится больше, чем над идеальным: >
>  ,
,  >
>  .
. < 0; выход молекул в пар затрудняется и
< 0; выход молекул в пар затрудняется и  <
<  ,
,  <
< 
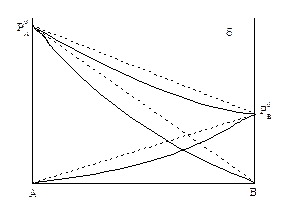

 (рисунок 1.7).
(рисунок 1.7).



