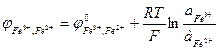Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение растворимости труднорастворимой солиСодержание книги
Поиск на нашем сайте
По величине удельной электрической проводимости насыщенного раствора труднорастворимой соли можно найти ее концентрацию, а следовательно, вычислить растворимость и произведение растворимости. Поскольку в насыщенном растворе такой соли концентрация очень мала, его эквивалентная электрическая проводимость совпадает с
Ввиду малой удельной электрической проводимости раствора необходимо вводить поправку на
Если электролит одновалентный, то произведение растворимости, равное произведению активностей ионов в насыщенном растворе, будет равно (с некоторым приближением):
Для более сложных электролитов произведение растворимости находится аналогично, но с учетом диссоциации электролита. Так, для соли Ag2S с молярной концентрацией С (моль/л): Ag2S
Определение предельной эквивалентной электрической проводимости растворов сильных электролитов Непосредственное экспериментальное измерение В случае слабых электролитов хорошие результаты дает способ, основанный на применении закона Кольрауша, уравнение (2.9), по
Величины Кондуктометрическое титрование Это один из физико–химических методов анализа, основанный на измерении электропроводности системы. Он с успехом применяется в случаях, когда между анализируемым раствором и титрантом могут протекать обменные ионные или окислительно – восстановительные реакции, в результате которых изменяется электропроводящая способность раствора. Зависимость электрической проводимости раствора от объема добавляемого титранта изображают графически. Полученный график называется кривой кондуктометрического титрования. Кривые имеют излом, соответствующий точке эквивалентности. На рисунке 2.3 даны примеры кривых титрования кислот щелочью. В ходе титрования объем раствора не должен значительно изменяться, для чего концентрация титранта должна быть значительно выше концентрации титруемого раствора.
Рисунок 2.3 – Кривые кондуктометрического титрования сильной кислоты (а), слабой (б) и смеси сильной и слабой кислот (в) сильным основанием
Следует отметить, что подвижность ионов Н+ и ОН- является аномально высокой по сравнению с другими ионами:
При титровании сильной кислоты щелочью (рисунок 2.3 а) сначала происходит снижение электрической проводимости раствора за счет замены подвижного иона водорода менее подвижным катионом металла (участок аb). При добавлении к системе, после точки эквивалентности, избытка щелочи электрическая проводимость растет за счет появления ионов ОН- (свободной щелочи). При титровании слабой кислоты (например, СН3СООН) щелочью (NaOH) (рисунок 2.3 б) малая электропроводность кислоты растет за счет появления свободных ионов соли (сильного электролита). После точки эквивалентности в системе появляются избыточные ионы ОН-, имеющие бóльшую подвижность, что приводит к резкому возрастанию электропроводности. При титровании смеси кислот (рисунок 2.3 в) сначала оттитровывается сильная кислота (участок аb), а затем начинается нейтрализация слабой, малодиссоциированной кислоты. При этом образуется хорошо диссоциированная соль, что приводит к повышению Дальнейшее приливание избытка щелочи приводит к более резкому возрастанию Этим методом можно проводить титрование солей, если выпадает осадок, понижающий концентрацию ионов, обусловливающих электропроводность раствора, например, при титровании MgSO4 раствором Ва(ОН)2: MgSO4 + Ва(ОН)2 = Mg(ОН)2 ↓ + Ва SO4 ↓. Электродные процессы 2.3.1 Основные понятия и определения При погружении металлического электрода в раствор, содержащий ионы этого же металла, устанавливается равновесие на границе металл - раствор. Разность химических потенциалов в растворе и электроде приводит к тому, что электрод растворяется и посылает ионы в раствор, если
Экспериментальному определению доступна лишь электрическая разность потенциалов между точками, которые находятся в одинаковых по химическому составу фазах. Если же точки расположены в различных по химическому составу фазах, то электрическую разность потенциалов измерить невозможно. Такой разностью потенциалов между электродом и раствором является гальвани-потенциал. Если же соединить два металлических электрода, погруженных в растворы, содержащие ионы этих металлов, тогда можно замерить разность потенциалов между этими электродами. При этом концы электрохимической цепи должны заканчиваться одинаковыми по своему составу металлами. Такая цепь называется правильно разомкнутой (рисунок 2.4).
Рисунок 2.4 - Правильно разомкнутые электрохимические цепи
На практике это обычно достигается простым подключением медных проводов к обоим электродам (рисунок 2.4 б). Электрохимическая цепь является равновесной, если процессы на электродах протекают бесконечно медленно. Разность потенциалов на концах правильно разомкнутой равновесной электрохимической цепи называется электродвижущей силой (ЭДС). Обозначается ЭДС - Е. Электрохимическую цепь можно представить схематически. Например:
Cu | Zn | ZnS04
Вертикальной сплошной чертой показывается наличие скачка потенциала на границе металл-металл, металл-раствор, а пунктирной - на границе двух растворов, так называемый диффузионный потенциал. Часто при записи цепи опускается повторение металла, предполагая, что цепь является правильно разомкнутой: Zn | ZnS04 Разность потенциалов Е на концах этой цепи складывается из четырех гальвани-потенциалов, каждый из которых отдельно замерен быть не может:
Рассмотрим, как определяется величина и знак ЭДС. Полезная работа обратимого процесса (в данном случае электрическая) равна убыли энергии Гиббса, то есть Для реакций, самопроизвольно протекающих в гальваническом элементе, (∆G < 0), ЭДС - положительна. Этому соответствует запись гальванического элемента так, чтобы правый электрод был более электроположителен, чем левый, движение электронов при этом происходит от левого электрода к правому, на котором и идет реакция восстановления. На положительном электроде идет реакция восстановления, на отрицательном - окисления. Электрод, на котором идет восстановление, называется катодом, а на котором идет окисление – анодом. В гальваническом элементе катод имеет положительный знак (в отличие от электролиза, где восстановление идет на отрицательном электроде, то есть катод будет отрицательным, см. раздел 2.4). ЭДС гальванического элемента можно рассчитывать по формуле Нернста: где Е0 - стандартная ЭДС цепи при активностях всех компонентов, равных единице; n - число электронов, участвующих в реакции; Так, для приведенной выше гальванической цепи, где протекает реакция
CuS04 + Zn →ZnS04 + Сu,
ЭДС можно рассчитать по уравнению (2.13):
Комбинируя различные электроды между собой, можно получить множество электрохимических цепей. Поскольку измерить гальвани-потенциал невозможно, то за величину, характеризующую процесс на отдельном электроде, принимают электродный потенциал. Электродным потенциалом называют ЭДС электрохимической цепи, построенной из стандартного водородного электрода и электрода окислительно - восстановительной полуреакции. Стандартный водородный электрод представляет собой платинированный платиновый электрод в растворе кислоты с активностью, равной единице, который омывается током водорода под давлением 1 атм. (1,013·105 Па), то есть a Н+ = 1;
При обозначении электрода водородный электрод не записывается, а подразумевается, и запись электрода выглядит так: CuSO4 | Cu, ZnSO4 | Zn. Знак электродного потенциала определяется знаком ЭДС при движении электронов от левого электрода (водородного) к правому. Если этот процесс самопроизволен, ∆G < 0, то Электродный потенциал нередко обозначается знаком Е. Мы принимаем обозначение Величины электродных потенциалов зависят от концентрации всех компонентов, участвующих в окислительно-восстановительной полуреакции. Зависимость эта выражается уравнением Нернста. Так, величина электродного потенциала Сu2+ |Сu равна ЭДС цепи, где протекает реакция: Н2 + Сu2+ → Сu + 2Н+. Учитывая, что
В общем случае уравнение Нернста для электродного потенциала имеет вид:
где аокисл, авосст - активности окисленных и восстановленных форм участников реакции. Если активности участников полуреакции равны единице, то ЭДС цепи типа (А) и (В) будет называться стандартным электродным потенциалом. Величина потенциала стандартного водородного электрода равна нулю. Классификация электродов В зависимости от природы веществ, участвующих в электродной реакции, электроды делятся на две группы: 1. Электроды, образованные электрохимически активными металлами, участвующими в токообразующей реакции. 2. Электроды с инертными металлами, не участвующими в токообразующей реакции. К первой группе относятся электроды первого и второго рода. Электроды первого рода - системы, состоящие из металла, опущенного в раствор соли этого металла. Например: Ag+ | Ag; Sn2+ | Sn. Реакции, протекающие на электродах: Ag+ + e
Sn2+ + 2e Потенциал рассчитывается по уравнению (2.14)
К электродам первого рода также относятся амальгамные электроды и электроды, образованные сплавами, в которых меняется активность металла. Амальгама – металлическая система, одним компонентом которой является ртуть. Это, в основном, твердые растворы, химические соединения, жидкие растворы. Например:
Здесь электродный потенциал зависит также и от активности металла в амальгаме. К электродам второго рода относят металлические электроды, покрытые труднорастворимым соединением этого металла (солью, гидроксидом или оксидом), погруженные в раствор, содержащий анионы этой соли или ионы ОН- или Н+ (в случае гидроксида или оксида). Восстановление металла в этом случае идет из соли, оксида или гидроксида. При записи электрода вещества, из которых состоит электрод, записываются через запятую. Раствор отделяется вертикальной чертой, показывающей наличие скачка потенциала.
В случае оксидно - металлических электродов (б, в, г) электродный потенциал зависит от рН раствора. Ко второй группе относятся окислительно - восстановительные и газовые электроды. Газовые электроды состоят из инертного металла (часто платины), к которому подводится электрохимически активный газ. Молекулы газа адсорбируются на поверхности металла, распадаясь на атомы, которые и участвуют в электродном процессе. Платина с адсорбированным газом частично погружена в раствор, содержащий ионы этого газа. Примерами таких электродов могут служить водородный, хлорный, кислородный. Водородный электрод в кислой среде:
Н+ | H2, Pt; Н+ + е
Водородный электрод в щелочной среде: ОН-│H2, Pt 2Н2О + 2е
Кислородный электрод, в отличие от водородного электрода, является необратимым. Кислородный электрод в кислом растворе:
Кислородный электрод в нейтральном или щелочном растворах
Уравнения для Окислительно-восстановительные (редокс) электроды. Это электроды, составленные из инертного металла (обычно платины), погруженного в раствор, где присутствуют ионы какого-либо вещества, имеющие различную степень окисления. В этом случае реакции окисления – восстановления идут без образования новой фазы. Множество разнообразных редокс-электродов можно разделить на два класса: а) не зависящие от рН раствора. К ним относятся некоторые неорганические окислительно – восстановительные системы: Fe3+, Fe2+ | Pt Fe3+ + e → Fe2+
б) зависящие от рН раствора. К этой группе относятся часть неорганических и все органические системы. Н+, MnO4-, Mn2+ | Pt MnO4- + 8H+ + 5e → Mn2+ + 4H2O H+, HCOOH, HCOH | Pt HCOOH+2H+ + 2e → HCOH + H2O
|
|||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 1377; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.102.104 (0.011 с.) |

 , тогда из уравнения (2.7) получаем:
, тогда из уравнения (2.7) получаем: . (2.12)
. (2.12)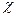 воды, поэтому:
воды, поэтому: .
. .
. 2Ag+ + S2-,
2Ag+ + S2-,
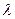 наносят на график в виде функции от
наносят на график в виде функции от 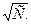 Полученная прямая экстраполируется до С = 0, и отрезок на оси ординат даст
Полученная прямая экстраполируется до С = 0, и отрезок на оси ординат даст 
 определяются методом экстраполяции.
определяются методом экстраполяции.





 ).
). >
>  . Если же
. Если же 
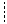 CuS04 | Cu
CuS04 | Cu

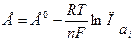 , (2.13)
, (2.13)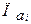 - произведение активностей всех участников окислительно-восстановительной реакции в гальваническом элементе с учетом стехиометрических коэффициентов, которые для исходных веществ берутся со знаком «минус», а для продуктов со знаком «плюс».
- произведение активностей всех участников окислительно-восстановительной реакции в гальваническом элементе с учетом стехиометрических коэффициентов, которые для исходных веществ берутся со знаком «минус», а для продуктов со знаком «плюс». .
. . При записи cхемы гальванического элемента стандартный водородный электрод всегда располагается слева.
. При записи cхемы гальванического элемента стандартный водородный электрод всегда располагается слева.

 > 0, значит и
> 0, значит и  > 0.
> 0. , чтобы различать электродный потенциал и ЭДС суммарной цепи.
, чтобы различать электродный потенциал и ЭДС суммарной цепи. а
а  = 1; а
= 1; а  = 1, получим:
= 1, получим:
 , (2.14)
, (2.14)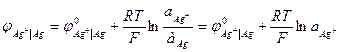 , так как активность чистого твердого вещества равна единице.
, так как активность чистого твердого вещества равна единице.


 ;
;


 .
.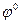 = 0 при а Н+ = 1 и рН = 0.
= 0 при а Н+ = 1 и рН = 0.
 В при а ОН- = 1 и рН = 14.
В при а ОН- = 1 и рН = 14.
 (при РО2 = 1)
(при РО2 = 1) В при а Н+ = 1 и рН = 0
В при а Н+ = 1 и рН = 0

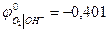 В при а ОН- = 1 и рН = 14
В при а ОН- = 1 и рН = 14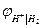 и
и  термодинамически идентичны. Идентичны и уравнения для
термодинамически идентичны. Идентичны и уравнения для 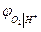 и
и  . Это объясняется термодинамической зависимостью активностей
. Это объясняется термодинамической зависимостью активностей  и
и  через константу диссоциации воды
через константу диссоциации воды  (ионное произведение воды).
(ионное произведение воды).