
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типы гальванических элементовСодержание книги
Поиск на нашем сайте
Электрохимические цепи обычно классифицируют по двум признакам: 1) по источнику электрической энергии они делятся на химические и концентрационные; 2) по наличию или отсутствию в цепи границы двух различных растворов (а значит и диффузионного потенциала) делятся на цепи с переносом или без переноса, соответственно. В химических цепях источником электрической энергии является химическая реакция, протекающая в электрохимической системе. Химические цепи могут быть с переносом (имеется граница двух растворов или соединение через солевой мостик) и без переноса, где такой границы нет. Химические цепи построены из электродов, различных по химической природе. Знаки электродов в данной цепи определяются по величине Примером химической цепи с переносом является следующая цепь: (-) Cu | CuSO4 | AgNO3 | Ag (+)
В данной цепи серебряный электрод является более положительным, и ему приписывается знак «+», а медному электроду «-». Реакции, идущие на электродах: Cu – 2e Суммарная реакция: Cu + 2Ag+
Примеры цепей без переноса: Pt, H2 | HCl | Cl2, Pt Ag, AgClТВ | KCl | Cl2 ,Pt В концентрационных цепях источником энергии является величина ∆G, обусловленная различными активностями одних и тех же химических компонентов. В концентрационных цепях оба электрода идентичны как по физической природе, так и по химической природе участников окислительно–восстановительных процессов. Они отличаются только концентрациями компонентов. Знаки электродов определяются по реакциям на электродах, приводящим к выравниванию концентраций (активностей) веществ электродов. Различают концентрационные цепи с переносом и без переноса. Цепи без переноса строят из двух амальгамных электродов с разной концентрацией амальгам, сплавов или двух газовых электродов с разными давлениями газов, погруженных в один и тот же раствор. В этих цепях на электроде с бóльшей концентрацией амальгамы, сплава или с большим давлением газа происходит ионизация атомов металла или газа, активность металла или газа уменьшается. На электроде с меньшей концентрацией будет происходить образование свободных атомов металла или молекул газа, их активность возрастает. Таким образом, в результате работы концентрационной цепи происходит выравнивание активностей компонентов на обоих электродах. Как и в химических цепях, электрод, на котором идет восстановление (присоединение электронов), будет положительным, где окисление – отрицательным. В качестве примера рассмотрим амальгамную цепь: (-) Zn(Hg) | ZnSO4 | Zn(Hg) (+) a 1 a 2 a 1 > a 2 В процессе выравнивания концентраций на левом электроде будет происходить растворение цинка по реакции: Zn – 2e На правом – образование цинка: Zn2+ +2е Значение ЭДС такой цепи:
Концентрационные цепи с переносом – это электрохимические цепи с различной концентрацией растворов, в которые погружены электроды. Например, (-) Pt, H2 | HCl || HCl | H2, Pt (+) a 1 < a 2 В ходе работы этого элемента активности HCl должны выравниваться, то есть а 1 возрастать, а а 2 убывать за счет реакций: 1/2Н2 – е Следовательно, правый электрод будет положительным, а левый – отрицательным.
Диффузионный потенциал На границе двух растворов электролитов произвольного состава возникает скачок потенциала, называемый диффузионным потенциалом. Причиной его возникновения является различная подвижность ионов в растворах. Рассмотрим два наиболее простых случая. 1) Граница растворов одного и того же электролита с различной концентрацией.
2) Граница растворов различных электролитов с одинаковой концентрацией.
где По этим формулам рассчитывается численное значение φдифф, но не его знак. Выбор знака φдифф зависит от взаимного направления полей: 1) на границе двух растворов; 2) электродов. Если направление полей совпадает, то φдифф > 0; если не совпадает, то φдифф < 0 (смотри раздел 2.5 задачи 4, 5). На практике для того, чтобы снизить величину φдифф до пренебрежимо малой величины, граничащие растворы соединяют солевым мостиком с насыщенным раствором KCl или NH4NO3. Катионы и анионы этих солей обладают примерно равными подвижностями. В цепи наличие мостика обозначается двумя вертикальными чертами: Zn │ ZnSO4 || CuSO4 │ Cu
|
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 1823; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.86.58 (0.006 с.) |

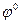 (из справочника).
(из справочника).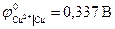

 Cu2+ 2Ag+ + 2e
Cu2+ 2Ag+ + 2e 

 ,
,  ,
, .
.
 , где a 1 > a 2;
, где a 1 > a 2; ,
,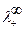 и
и  - предельные подвижности ионов одного электролита;
- предельные подвижности ионов одного электролита; 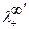 и
и  - предельные подвижности ионов другого электролита.
- предельные подвижности ионов другого электролита.


