
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон распределения Нернста. ЭкстракцияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Если взять две несмешивающиеся жидкости и добавить третий компонент, то он будет растворяться в разной степени в том и другом растворителе. «При установлении равновесия отношение концентраций полученных растворов постоянно при данной температуре» - закон распределения Нернста (1.13).
где Если растворенное вещество диссоциирует или ассоциирует в одном из растворителей, то уравнение Нернста имеет вид:
Для нахождения Кип логарифмируем уравнение (1.14) и получаем уравнение прямой:
Построив прямую в координатах InK можно найти из уравнения, подставив в него значения любой точки, находящейся на прямой. Закон распределения Нернста лежит в основе процесса экстракции. Экстракция это извлечение компонента из одной фазы в другую. Экстракция бывает твердофазная - извлечение веществ из твердой фазы в жидкую (например, заваривание чая, кофе, приготовление настоек, экстрактов трав и так далее) и жидкофазная - извлечение растворенного вещества из жидкого раствора экстрагентом. Раствор извлеченного вещества в экстрагенте называется экстрактом, а исходный раствор после извлечения из него вещества называется рафинатом. Для расчета эффективности жидкофазной экстракции используют уравнение (1.15):
где х - доля неизвлеченного вещества в рафинате; V - объем исходного раствора;
К - коэффициент распределения
п - число экстракций. Как видно из уравнения (1.15), чем больше экстракций, тем меньше остается вещества в рафинате, то есть неизвлеченным, тем больше вещества извлекается экстрагентом. Эффективность экстракции в большой степени определяется величиной коэффициента распределения: чем больше коэффициент в пользу экстрагента, тем эффективнее экстракция. Часто в справочнике дается коэффициент распределения как отношение концентраций в рафинате к экстракту, то есть величина, обратная той, что должна быть в уравнении (1.14). В этом случае следует взять величину обратную справочной и использовать в уравнении (1.15), или использовать другое уравнение, где
Примеры решения задач Задача 1 50 г водного раствора FeCl2 с моляльностью 1,97 моль/кг с плотностью 1,332 г/см3 смешали со 150 мл 5 масс. % раствора FeCl2 с плотностью 1,038 г/см. Выразить состав полученного раствора всеми возможными способами. Дано: Раствор 1: Раствор 2:
b
b3 =? W 3 =? Х 3 =? Решение: Для каждого раствора найдем массу FeCl2 и Н20. Раствор 1: b
1251 г (р-ра) - 251г FeCl2; 50 г р-ра -
Итак, в растворе 1:
Раствор 2: m р.ра =r∙V = 1,038 ∙ 50 =156 г;
Раствор 3: m р-pa = 50 + 156 = 206 г; mH2O =40+ 148 = 188 г
b
Рассчитать молярную концентрацию нет возможности, поскольку неизвестна плотность полученного раствора.
Задача 2 При 100 °С тетрахлорэтилен имеет давление насыщенного пара 400 мм.рт.ст., а бромбензол - 196 мм.рт.ст.. Найти состав раствора, кипящего при 100 °С под давлением 360 мм.рт.ст., и состав насыщенного пара над раствором. Считать раствор идеальным. Дано:
t = 100 °С Pобщ = 360 мм.рт.ст.
Решение: Кипение наступает тогда, когда внешнее давление и давление насыщенного пара равны. Следовательно, 360 мм.рт.ст. - это и внешнее давление и общее давление насыщенного пара над раствором.
Задача 3 При 25 °С константа распределения иода между водой и амиловым спиртом равна 0,00435. Сколько граммов иода останется в трех литрах водного раствора (С = 1,3 г/л) после двухкратной экстракции амиловым спиртом, если всего израсходовано 400 мл спирта? Дано: К = 0,00435 =
п = 2 V = 3 л
Решение: Экстрагентом является амиловый спирт. Следовательно, данная константа распределения является обратной, требуемой в уравнении для расчета эффективности экстракции:
Рассчитываем константу распределения:
Масса растворенного иода в исходном растворе:
m = m0×x = 3,9 . 0,0037 = 0,014 г - масса иода, оставшегося в рафинате
Задача 4 Закрытый сосуд объемом 5,0 л содержит газ Н2S при температуре 20 0С и давлении равном 740 мм. рт. ст. Какой объем воды должен быть добавлен, чтобы парциальное давление Н2S понизилось до 500 мм. рт. ст.? Коэффициент абсорбции Н2S (α) равен 2,58.
Дано:
t1 = 20 0C T1 = T2 = 293 K P = 740 мм.рт.ст.= 0,984∙105 Па α = 2,58
Решение: Понижение давления происходит за счет растворения части Н2S в воде. Рассчитаем исходное количество Н2S и остаточное количество Н2S после растворения его в воде.
Пренебрежем изменением объема газа за счет добавления воды, то есть V2 = V1.
Рассчитаем количество Н2S, растворенное в воде:
Рассчитаем V0 – объем Н2S, приведенный к нормальным условиям (Р = 1,0133∙105 Па, Т = 273,15 К), который растворен в воде:
Задача 5 Метан плавится при температуре 90,5 К, его теплота плавления равна 70,7 Дж/моль. Определить растворимость метана в жидком азоте при температуре 50 К.
Дано:
Решение: Обычно мы знаем метан как газ, но в данном случае речь идет о твердом метане при температуре ниже его температуры плавления. Следовательно, надо найти растворимость твердого вещества в жидкости, что можно выполнить по уравнению Шредера:
Вопросы для самоконтроля 1. Смешение двух жидкостей сопровождается выделением теплоты и уменьшением объема. Какой тип отклонения от закона Рауля в данной системе? 2. Растворимость твердого вещества в жидкости является идеальной. Как изменится растворимость при понижении температуры? 3. Одинаковы ли величины осмотического давления КСl и сахара в воде, если их моляльности равны? 4. Изобразить диаграмму двух жидкостей в координатах (Ткип.- состав) для системы с положительным отклонением от закона Рауля, имеющей азеотроп состава х А = 0,5; причем 5. Система, состоящая из жидкостей А и В, имеет максимум на диаграмме (Ткип.- состав). Провести перегонку растворов с х А = 0,8 и х В = 0,8. Что отгоняется и что остается в кубе? 6. В какой воде – дистиллированной или морской – больше растворяется кислорода? 7. Какие из перечисленных веществ можно перегонять с водяным паром: С6Н6, NaCl,С2Н5ОН, СН3СООН, С6Н5NН2, С10Н8? 8. Коэффициент распределения иода между: водой и четыреххлористым углеродом - 0,0117; водой и сероуглеродом - 0,0017; водой и хлороформом - 0,0074. Каким из перечисленных экстрагентов наиболее эффективно извлекать иод из водного раствора? 9. Что называется термодинамической активностью?
ЭЛЕКТРОХИМИЯ
|
||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 1984; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.007 с.) |

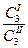 = К, (1.13)
= К, (1.13)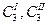 - концентрации третьего компонента в I и II фазах; К - коэффициент распределения.
- концентрации третьего компонента в I и II фазах; К - коэффициент распределения.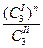 = К, (1.14)
= К, (1.14)
 , найдем «п» как тангенс угла наклона прямой (по любым двум точкам, лежащим на прямой) tga =
, найдем «п» как тангенс угла наклона прямой (по любым двум точкам, лежащим на прямой) tga = 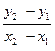 .
. , (1.15)
, (1.15)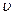 - объем экстрагента;
- объем экстрагента;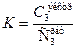 ;
;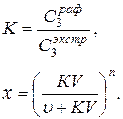
 =50r
=50r  = 150 мл
= 150 мл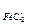 =1,97моль/кг
=1,97моль/кг 
 = 1,332 г/см3
= 1,332 г/см3  = 1,038 г/см3
= 1,038 г/см3 = l,97×M FeCl2 = 1,97∙127,5 =251 г;
= l,97×M FeCl2 = 1,97∙127,5 =251 г; 
 = 1000 г; mp.pa= 1251 г
= 1000 г; mp.pa= 1251 г г.
г.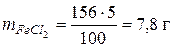



 =400 мм.рт.ст.
=400 мм.рт.ст.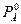 = 196 мм.рт.ст.
= 196 мм.рт.ст.


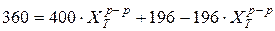
 ;
; 


 =1,3г/л
=1,3г/л = 400/2 = 200 мл = 0,2 л
= 400/2 = 200 мл = 0,2 л =?
=?

 - доля иода, оставшегося в рафинате.
- доля иода, оставшегося в рафинате.
 = 5,0 л = 5,0∙10-3 м3
= 5,0 л = 5,0∙10-3 м3 -?
-?




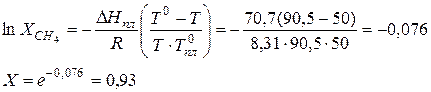
 >
>  .
.


