
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молярная и эквивалентная электрические проводимостиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Чтобы выделить эффекты ионного взаимодействия, удельную электрическую проводимость
Единицей измерения
Произведение
Соотношение (2.9) установлено Кольраушем и называется законом независимого движения ионов. Предельная подвижность является специфической величиной для данного вида ионов и зависит только от природы растворителя и температуры. Уравнение для молярной электрической проводимости принимает вид (2.10):
где Пример: В случае одновалентного электролита, например, HCl,
Рисунок 2.2 – Зависимость эквивалентной электропроводности от концентрации для сильных (а) и слабых (б) электролитов
Для растворов слабых электролитов эквивалентная электрическая проводимость остается небольшой вплоть до очень низких концентраций, по достижении которых она резко поднимается до значений, сравнимых с
Степень диссоциации можно выразить, разделив уравнение (2.7) на (2.8):
С увеличением концентрации
где А – постоянная, зависящая от природы растворителя, температуры и валентного типа электролита. По теории Дебая – Онзагера снижение эквивалентной электрической проводимости растворов сильных электролитов связано с уменьшением скоростей движения ионов за счет двух эффектов торможения движения ионов, возникающих из-за электростатистического взаимодействия между ионом и его ионной атмосферой. Каждый ион стремится окружить себя ионами противоположного заряда. Облако заряда называют ионной атмосферой, в среднем оно сферически симметрично. Первый эффект – эффект электрофоретического торможения. При наложении электрического поля ион движется в одну сторону, а его ионная атмосфера – в противоположную. Но с ионной атмосферой за счет гидратации ионов атмосферы увлекается часть растворителя, и центральный ион при движении встречает поток растворителя, движущегося в противоположном направлении, что создает дополнительное вязкостное торможение иона. Второй эффект – релаксационного торможения. При движении иона во внешнем поле атмосфера должна исчезать позади иона и образовываться впереди него. Оба эти процесса происходят не мгновенно. Поэтому впереди иона количество ионов противоположного знака меньше, чем позади, то есть облако становится несимметричным, центр заряда атмосферы смещается назад, и поскольку заряды иона и атмосферы противоположны, движение иона замедляется. Силы релаксационного и электрофоретического торможения определяются ионной силой раствора, природой растворителя и температурой. Для одного и того же электролита, при прочих постоянных условиях, эти силы возрастают с увеличением концентрации раствора.
Числа переноса При прохождении электрического тока через раствор электролита катионы движутся к катоду, а анионы – к аноду. Благодаря разной подвижности катионы и анионы будут переносить неодинаковую часть тока. Доля электричества, перенесенная ионами одного вида, называется числом переноса иона. Обозначается t+ и t- - для катионов и анионов соответственно. Количество электричества, перенесенное ионами данного вида через единицу времени поверхности за 1 секунду, равно: для катионов q+ = z+ν+ CU+F, для анионов q- = z-ν- CU-F, где z+, z- - заряд ионов; ν+, ν- - число ионов; U+, U- - абсолютная скорость движения ионов; С – молярная концентрация электролита. Общее количество электричества равно сумме (q+ + q-). Тогда, согласно определению чисел переноса с учетом равенства z+ν+ = z-ν- (вследствие электронейтральности раствора), получаем выражение для чисел переноса:
Практически удобно рассматривать не целые ионы, а их части с зарядом, равным единице (например, Na +, ½ SО 42-). Тогда z+ и z- = 1; ν+ и ν- = 1; U+F = λ +; U-F = λ- - эквивалентные электропроводности катионов и анионов или подвижности ионов Очевидно, что t+ + t- = 1.
Кондуктометрия Измерение электрической проводимости – кондуктометрия широко применяется в лабораторной практике для определения физико-химических характеристик электролитов и растворов.
|
||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 1498; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.221.113 (0.012 с.) |

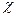 делят на молярную концентрацию (С, моль/м3), и получают молярную электрическую проводимость
делят на молярную концентрацию (С, моль/м3), и получают молярную электрическую проводимость  ; или делят на молярную концентрацию эквивалента и получают эквивалентную проводимость.
; или делят на молярную концентрацию эквивалента и получают эквивалентную проводимость.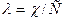 . (2.6)
. (2.6)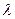 является м2См/моль. Физический смысл эквивалентной проводимости состоит в следующем: эквивалентная проводимость численно равна электрической проводимости раствора, заключенного между двумя параллельными электродами, расположенными на расстоянии 1 м и имеющими такую площадь, что объем раствора между электродами содержит один моль эквивалента растворенного вещества (в случае молярной электрической проводимости – один моль растворенного вещества). Таким образом, в случае эквивалентной электрической проводимости в этом объеме будет NА положительных и NА отрицательных зарядов для раствора любого электролита при условии его полной диссоциации (NА – число Авогадро). Поэтому, если бы ионы не взаимодействовали друг с другом, то
является м2См/моль. Физический смысл эквивалентной проводимости состоит в следующем: эквивалентная проводимость численно равна электрической проводимости раствора, заключенного между двумя параллельными электродами, расположенными на расстоянии 1 м и имеющими такую площадь, что объем раствора между электродами содержит один моль эквивалента растворенного вещества (в случае молярной электрической проводимости – один моль растворенного вещества). Таким образом, в случае эквивалентной электрической проводимости в этом объеме будет NА положительных и NА отрицательных зарядов для раствора любого электролита при условии его полной диссоциации (NА – число Авогадро). Поэтому, если бы ионы не взаимодействовали друг с другом, то 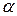 → 1, величина
→ 1, величина  , отвечающей отсутствию ионного взаимодействия. Из уравнений (2.5 и 2.6) следует:
, отвечающей отсутствию ионного взаимодействия. Из уравнений (2.5 и 2.6) следует:
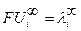 называют предельной эквивалентной электрической проводимостью ионов, или предельной подвижностью ионов:
называют предельной эквивалентной электрической проводимостью ионов, или предельной подвижностью ионов: . (2.9)
. (2.9) , (2.10)
, (2.10) - число эквивалентов катионов и анионов, необходимых для образования 1 моль соли.
- число эквивалентов катионов и анионов, необходимых для образования 1 моль соли.
 , то есть молярная и эквивалентная электрические проводимости совпадают.
, то есть молярная и эквивалентная электрические проводимости совпадают.
 .
. , (2.11)
, (2.11)

 ;
;  .
.


