
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скорость электрохимической реакцииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте В отличие от обычной гомогенной химической реакции, протекающей во всех точках объема раствора, где есть реагирующие вещества, электрохимическая реакция идет на границе раздела между электродом и раствором, то есть является гетерогенной реакцией. Как и всякая гетерогенная реакция, она является многостадийной. Из множества последовательных стадий выделим три главные стадии: 1) подвод вещества к электроду; 2) собственно электрохимическая стадия, связанная с переносом электронов или ионов через границу раздела фаз (стадия разряда - ионизации); 3) образование конечного продукта процесса (образование и удаление молекул газа, образование кристаллической решетки твердого тела, отвод иона от поверхности в глубь раствора). Первая и третья стадии имеют одинаковые закономерности и называются стадиями массопереноса. Скорость многостадийного процесса определяется скоростью самой медленной стадии, которая называется лимитирующей. В данном разделе будем рассматривать электродный процесс, где лимитирующей стадией является вторая стадия, то есть стадия разряда – ионизации. Рассмотрим сначала скорость электрохимической реакции, протекающей на металлическом электроде, погруженном в раствор его собственной соли. При установлении равновесия при равновесном потенциале протекание реакций окисления (анодный процесс) и восстановления (катодный процесс) не прекращается, но скорости этих реакций равны. При этом не происходит макроскопических изменений состава и массы отдельных фаз системы. Протекание процесса, приводящего к макроскопическим изменениям, возможно лишь при потенциале отличном от равновесного, когда скорости окисления и восстановления не равны друг другу. Разность этих скоростей и будет общей скоростью процесса, которая тем больше, чем больше смещен потенциал от равновесного. Скорость гетерогенной реакции на единице поверхности может быть выражена уравнением
где К – константа скорости; Е – энергия активации; С – концентрация реагирующего вещества в слое жидкости, прилегающем к поверхности. Скорость процесса измеряется числом ионов, переходящих из фазы в фазу с единицы поверхности в единицу времени. Поэтому скорость окисления (υа ) и восстановления (υk) можно измерять плотностью тока. Скорость восстановления, катодный процесс:
Скорость окисления, анодный процесс:
В уравнение (2.16) в явном виде не входит концентрация раствора, так как активность твердого металла равна единице и во времени не меняется (в случае растворения металла).
Поляризационные кривые В уравнениях (2.15 и 2.16) энергия активации электрохимических реакций зависит от сдвига потенциала от равновесного. В этом заключается важнейшая особенность электродных реакций по сравнению с обычными химическими. Изменяя потенциал, можно плавно изменить энергию активации и скорость реакции. В обычных же химических реакциях невозможно непосредственно влиять на энергию активации. Учитывая связь энергии активации и сдвига потенциала, можно получить уравнения зависимости скорости реакции от сдвига потенциала от равновесного:
Эти величины можно представить графически в виде, так называемых, частных поляризационных кривых. По оси абсцисс отложен потенциал, отсчитанный от водородного нуля. По оси ординат - плотность тока анодного и катодного, то есть скорости анодного и катодного процессов.
Рисунок 2.6 - Поляризационные кривые: частные (сплошные линии) и суммарная (пунктирная линия)
При φ = φравн. ik = ia = io (ток обмена). Суммарная скорость равна 0. При сдвиге потенциала от равновесного в положительную сторону ia > ik, суммарный процесс будет анодным со скоростью iA = ia - ik. При сдвиге потенциала в отрицательную сторону от равновесного преобладать будет катодный процесс, и суммарная скорость будет iK = ik - ia. Суммарные скорости дают суммарную поляризационную кривую (пунктир на рисунке 2.6). Замерить катодный и анодный токи ik и ia невозможно. Амперметр замеряет суммарный анодный, iA, или катодный, iK, ток. При φ = φравн . амперметр покажет отсутствие тока.
Перенапряжение Суммарная поляризационная кривая показывает, что скорость электродной реакции зависит от сдвига потенциала. Смещение потенциала от равновесного, необходимое, чтобы вызвать электродную реакцию, протекающую с некоторой заданной скоростью (i), называется перенапряжением этой реакции, или поляризацией (η). Перенапряжение, и катодное и анодное, всегда величина положительная ηк = φравн. - φ ηа = φ - φравн. Перенапряжение для данной реакции зависит от плотности тока (скорость реакции), поэтому сравнение перенапряжений двух реакций возможно при одной и той же величине i. Катодное и анодное перенапряжения не равны друг другу. На рисунке 2.7 изображены две суммарные поляризационные кривые, отвечающие реакциям с малым (а) и большим (б) перенапряжением.
Рисунок 2.7 - Поляризационные кривые, отвечающие малому перенапряжению (а) и большому перенапряжению (б) электродной реакции
Скорость обеих реакций взята одинаковой: iА= iК. = i. Чтобы реакция шла со скоростью, равной iК, в случае (а) перенапряжение равно ηк и ηа, а в случае (б) Перенапряжение зависит от величины тока обмена, iо. Реакции, проходящие с большим перенапряжением (малой скоростью), имеют малый ток обмена. Это реакции окисления-восстановления с участием ионов Н3О+, ОН-, Fe 2+, Ni2+. Токи обмена этих реакций на много порядков меньше, чем у большинства других металлов (Ag+, Cu2+, Cd2+, Zn2+, Pb2+, Sn2 +), для которых перенапряжение мало. Особый интерес представляет реакция катодного восстановления водорода, протекающая на поверхности некоторых металлов с очень большим перенапряжением. Существование перенапряжения связано с малой скоростью электрохимического процесса, который является сложным многостадийным процессом. Было найдено, что в зависимости от природы металла лимитирующими стадиями могут быть стадии разряда – ионизации: Н3О+ + e → H + Н2О или рекомбинации: 2H → H2. Величина перенапряжения водорода зависит от природы металла. Высокое перенапряжение наблюдается на Hg, Ag, Cu, Cd, Zn, Bi, Pb, Au. Исключение составляет платина, на которой перенапряжение близко к нулю. Перенапряжение водорода зависит от плотности тока по уравнению И. Таффеля
где а – величина, зависящая от материала катода; b - величина, зависящая от типа электродной реакции. Зная, как протекают процессы на отдельных электродах, то есть располагая данными, позволяющими построить анодную и катодную ветви суммарных поляризационных кривых для каждого из электродов, можно рассмотреть протекание электролиза и определить продукты электролиза.
Электролиз Электролиз – это процессы, протекающие на электродах при пропускании электрического тока через растворы или расплавы электролитов. При электролизе важным является выбор анода. Аноды бывают растворимые, то есть участвующие в электродной реакции, и нерастворимые, инертные, не участвующие в электродной реакции. К растворимым относятся: цветные металлы (Hg, Cu, Al, Zn, Pb, Sn), углеродистая сталь, некоторые сплавы. К нерастворимым относятся: Pt, Ni, графит, нержавеющая сталь, PbO2, MnO2, Fe3O4. Рассмотрим некоторые типичные случаи электролиза, пользуясь поляризационными кривыми.
2.4.3.1 Электролиз водного раствора CuCl2 а) с использованием медных анодов. Пусть два медных электрода погружены в водный раствор CuCl 2. На каждом электроде устанавливается равновесие при определенном скачке потенциала, определенном токе обмена, выражающем скорость перехода ионов меди в раствор, равную скорости их восстановления: Cu Пока цепь электролизера разомкнута, тока нет и потенциалы обоих электродов одинаковы и равны φравн. Кроме ионов Cu 2+ и На катоде: Cu2+ + 2e → Cu0 2Н+ + 2e → H2
На аноде: Cu0 - 2e → Cu2 + 4 2 Изобразим схематически участки суммарных поляризационных кривых, отвечающих этим реакциям (рисунок 2.8). Примем во внимание, что реакции с участием Н+ и ОН- идут с большим перенапряжением (малой скоростью), кривые идут более полого, в отличие от других, идущих с большей крутизной. Относительное расположение φравн . отвечает нейтральному раствору.
Рисунок 2.8 - Схематические поляризационные кривые при электролизе водного раствора CuCl2
Если подключить электроды к какому-либо источнику ЭДС, то потенциалы электродов будут сдвинуты от равновесных в отрицательную сторону (катод) и положительную сторону (анод), то есть произойдет поляризация электродов. Это вызовет протекание электродных процессов: на аноде единственно возможной реакцией будет окисление меди Cu0 - 2e → Cu2 +, для этой реакции нужна наименьшая величина поляризации анода. Для других реакций (окисление Cl- и OH -) нужна более высокая поляризация. На катоде единственной реакцией будет восстановление меди, а для восстановления ионов водорода необходим более высокий отрицательный потенциал катода. Таким образом, достаточен малый сдвиг потенциала от равновесного, чтобы оба эти процесса начались с достаточной скоростью. Так, при подаче на электроды ЭДС, равной E = φa – φк (рисунок 2.8) скорости окисления и восстановления равны iА= iК. при сдвиге потенциалов Δφa и Δφк (не равных друг другу). б) с использованием инертных анодов. Поместим в электролизер два электрода, один из которых (анод) состоит из инертного металла, то есть не способного растворяться при подведении к нему положительного заряда. Воспользуемся поляризационными кривыми на рисунке (2.8). В нашем случае будет отсутствовать кривая растворения медного анода Cu0 – 2e → Cu2 +. Все остальные кривые остаются. Подведем к электродам внешнюю ЭДС и будем поляризовать электроды. При поляризации катода, как и в случае (а), первой (и единственной) реакцией на катоде будет восстановление меди Cu2+ + 2e → Cu0. Возьмем скорость окисления и восстановления равной iА и iК, как в случае (а). Восстановление водорода возможно при гораздо более высоком потенциале электрода и после восстановления всех ионов Cu2+ из раствора. При поляризации анода первым достигается равновесный потенциал окисления ОН -, но поскольку окисление ОН - протекает с большим перенапряжением, то участок его поляризационной кривой вблизи от равновесного потенциала стелется вдоль абсциссы, и для возникновения тока значительной силы (протекания реакции окисления ОН - со скоростью iА) требуется ЭДС заметно большая, чем разность между равновесными потенциалами (Е´, рисунок 2.8). При повышении ЭДС достигается равновесный потенциал реакции окисления Cl -, не требующий большого перенапряжения, и начинает выделяться Cl 2 при потенциале φ´а. При этом некоторое количество О 2 все же может образоваться. Выделение Cl 2 при меньшем потенциале можно достичь уменьшением значения равновесного потенциала хлора за счет увеличения концентрации ионов Cl - в электролизере (пунктирная кривая на рисунке 2.8). В этом случае О 2 не образуется вовсе.
2.4.3.2 Электролиз водного раствора К2SО4 с использованием инертных анодов В этом растворе имеются катионы К+ и Н+ анионы SО 42- и ОН -. Изобразим схематически отрезки суммарных поляризационных кривых реакций на катоде и аноде в нейтральной среде, исходя из значений их равновесных потенциалов (рисунок 2.9).
Рисунок 2.9 - Схематические поляризационные кривые реакций электролиза водного раствора К2SО 4
Из рисунка 2.9 видно, что наименьшего отрицательного потенциала на катоде требует восстановление водорода: 2 Н+ + 2e → H2. Восстановление ионов калия возможно при столь высоком отрицательном потенциале, что он практически недостижим в водном растворе. Наименьшего положительного потенциала требует окисление ионов ОН - с образованием кислорода 4ОН- - 4e → O2 + 2H2O.
Окисление же аниона SО 42- 2 SО42- - 2e → S2О82-, при котором образуется анион надсерной кислоты, требует значительно большего сдвига потенциала и в обычных условиях электролиза не наблюдается. Таким образом, при электролизе водного раствора К2SО 4 на электродах выделяется водород и кислород, то есть происходит разложение воды. Раствор в прикатодном пространстве называется католитом, в прианодном – анолитом. Из прикатодного пространства исчезают ионы Н+ за счет восстановления и уходят к аноду ионы SО 42-, таким образом в католите накапливаются ионы К+ и ОН -, то есть щелочь КОН. Из прианодного пространства исчезают за счет окисления ионы ОН -, в анолите накапливаются Н+ и SО 42-, то есть Н2SО 4. Если в электролизере установить пористые диафрагмы, отделяющие католит и анолит от средней части объема раствора, то можем получить эти вещества. При отсутствии диафрагмы они перемешиваются с образованием соли. Обратимся к рисунку 2.9. Если внешняя ЭДС равна разности потенциалов равновесных электродов Законы Фарадея Фарадеем установлены количественные законы электролиза. Первый закон: «количество прореагировавшего при электролизе вещества пропорционально количеству прошедшего через раствор электричества»:
где m – масса вещества; Q - количество электричества; К – электрохимический эквивалент.
где i - плотность тока; S – площадь; t – время, с; М – молярная масса; F – число Фарадея, 96485 Кл; n – число электронов участвующих в электродной реакции. Тогда первый закон Фарадея примет вид:
Следует иметь в виду, что масса вещества, рассчитанная по уравнению (2.15) является теоретической. На практике эта величина бывает больше или меньше рассчитанной, то есть m факт. (масса фактическая). В связи с этим вводится понятие – выход по току, анодный или катодный,
При умножении на 100 выход по току будет представлен в процентах, %. Электрохимический эквивалент для сплавов рассчитывается по формуле:
где К1, К2 - электрохимические эквиваленты компонентов сплава; W1, W2, …- массовые доли компонентов сплава.
Второй закон: «при определенном количестве прошедшего электричества отношение масс прореагировавших веществ равно отношению их химических эквивалентов, Э»:
Примеры решения задач
При решении задач мы используем справочные значения констант диссоциации, Кдисс; произведения растворимости солей, ПР; водородный показатель, рН; ионное произведение воды, Кw. При расчете этих величин были взяты концентрации, единицей измерения которых является моль/л, а не моль/м3 (не в системе СИ). Поэтому концентрации, полученные из этих значений, следует, если это необходимо, перевести в систему СИ.
Задача 1 Константа диссоциации уксусной кислоты равна 1,8·10-5. Чему равен рН раствора, если к 1 л раствора кислоты (С = 1 моль/л) добавить 8,2·10-3 кг ацетата натрия? Считать, что объем раствора не изменится при добавлении соли. Дано: Кд = 1,8·10-5 Vраствора= 1 л Скислоты = 1 моль/л mсоли =8,2·10-3 кг рН -? Решение В системе имеется кислота, которая диссоциирует частично, и соль, которая диссоциирует нацело.
СН3СООН С до реакции 1 0 0 С при равновесии 1-х х х
СН3СООNa С до реакции 0,10 0 0 С после диссоциации 0 0,10 0,10
В условии дана константа диссоциации термодинамическая, то есть Ка. Без большой погрешности можно считать а = с и Ка = Кс.
Ацетат ион, СН3СОО-, образуется за счет диссоциации как кислоты так и соли, то есть
Поскольку электролит является слабым, то количество продиссоциированного электролита, х, мало, и в алгебраических суммах им с небольшой погрешностью можно пренебречь. Тогда:
Задача 2 Предельная электрическая проводимость водного раствора NH4Cl равна 130·10-4 Дано:
Решение: Согласно закону Кольрауша: Для нахождения
Откуда Таким образом,
Задача 3 Определить теплоту диссоциации уксусной кислоты, если удельное сопротивление раствора кислоты (С = 0,01 моль/л) при 298 К равно 61,0 Ом·м, а при 288 К равно 83,7 Ом·м.
Дано:
Решение: Теплота реакции диссоциации кислоты определяется из уравнения изобары Вант Гоффа в интегральном виде:
Для решения надо рассчитать константы диссоциации при двух температурах, используя уравнения:
Аналогично рассчитываем для 288 К:
Задача 4 Вычислить ЭДС элемента, составленного из хлорсеребряного электрода в растворе НСl (С = 0,01 моль/л) и водородного электрода в растворе НСl (С = 0,50 моль/л), с учетом диффузионного потенциала при 25 0С. Дано:
Решение: Составляем гальваническую цепь из газового электрода, и электрода второго рода. Определяем знаки электродов из сравнения значений
С2 =0,50 С1=0,01 Н2 – 2е → 2Н+ 2AgCl + 2e → 2Ag+ + 2Cl-
Это значение ЭДС без учета диффузионного потенциала. В данном случае φдифф возникает на границе двух растворов электролитов одинаковых по химической природе, но с различными концентрациями.
Полученная величина - значение φдифф по модулю. Для определения знака φдифф рассмотрим направление электрического поля на границе растворов (см. гальваническую цепь). Поскольку С2 > С1, диффузия HCl будет идти слева направо, при этом ионы Н+, имеющие большую подвижность,
Задача 5 Рассчитать диффузионный потенциал гальванической цепи и определить его знак.
если СКСl = 0,01, CCuSO4 = 0,01 моль/л. Справочные данные:
Решение: Поскольку граничащие растворы различаются по химической природе, а их концентрации одинаковы, то расчет φдифф производится по формуле:
Определим знак φдифф. Так как концентрация обоих электролитов одинакова, то диффузия ионов будет происходить и слева направо и справа налево. Движение К+ и Сu2 + происходит в противоположных направлениях, но у К + подвижность больше на
Задача 6 При электролизе раствора, содержащего Pb2+, через 70 минут на поверхности 1,2 дм2 получено покрытие толщиной 108 мкм при плотности тока 3,0 А/дм2. При этом выделилось некоторое количество водорода. Рассчитать выход по току для свинца и объем выделившегося водорода при н.у., Дано: t = 70 мин = 4200 с S = 1,2 дм2 h = 108 мкм = 108·10-5 дм i = 3,0 А/дм2
ВТ (Pb)-?
Решение
По первому закону Фарадея:
Фактическая масса свинца меньше теоретической за счет того, что часть количества электричества расходуется на восстановление водорода. Недополученное количество свинца равно 16,2 – 14,7 = 1,5 г. Вместо него выделился водород, масса которого может быть рассчитана по второму закону Фарадея:
Объем водорода при нормальных условиях (Р = 1 атм., Т = 273 К) определяется по уравнению идеального газового состояния:
Задача 7 В цианистую ванну исправления брака завешены бракованные омедненные стальные детали с общей поверхностью 522 дм2 и средней толщиной медного покрытия 17 мкм. Сколько времени необходимо для полного снятия медного слоя с деталей, если плотность тока 0,96 А/дм2, выход по току 95 %? Плотность меди 8,9 г/см3. Дано: S = 522 дм2 h = 17 мкм = 17∙10-5 дм i = 0,96 А/дм2 ρ(Cu) = 8,9 г/см3= 8,9∙103 г/дм3
t -?
Решение Медь в цианистом растворе одновалентна, Сu +, n = 1. Запишем развернутое уравнение Фарадея:
где m – теоретическая масса меди, которая может быть найдена через выход по току: Подсчитаем массу фактически осажденной меди.
Задача 8 Определить выход по току для щелочи, если при работе хлорного электролизера нагрузкой 22 кА за 24 часа получено 5450 л электролитической щелочи, содержащей 138 г/л NaOH. Дано: I = 22 кА = 22∙103 А t = 24 час = 86,4∙103 с Vр-ра = 5450 л СNaOH = 138 г/л
Решение В хлорном электролизере электролизу подвергается водный раствор NaCl. Изобразим схематично поляризационные кривые всех возможных процессов окисления и восстановления в процессе электролиза:
Из рисунка видно, что повышение катодного потенциала приводит к единственно возможной катодной реакции – восстановлению водорода. На аноде первым достигается потенциал разряда ОН -, но из-за малой скорости реакции (большого перенапряжения) кислород не образуется, и возможно дальнейшее увеличение потенциала анода и достижение потенциала разряда Cl - с образованием хлора. Таким образом, продуктами электролиза будут Н2 и Cl2. Однако, в прикатодном пространстве при расходовании Н + образуется избыточное количество ионов ОН -, которые образуют с имеющимися в растворе ионами Nа + щелочь NаОН. Рассчитаем фактическое количество NаОН:
Вопросы для самоконтроля 1. Зависит ли константа диссоциации от концентрации электролита? 2. Рассчитать а ± для Na2SO4 (С = 0,01 моль/л). 3. Объяснить ход зависимости 4. Изобразить кривую титрования соляной кислоты кондуктометрическим методом. 5. Составить электрод второго рода, в растворе которого содержится ион Cl -. Записать реакцию на электроде и уравнение для электродного потенциала. 6. Составить химический гальванический элемент с переносом из электродов первого рода. Определить знаки. Записать реакции на электродах, значения φ электродов. 7. Составить концентрационный гальванический элемент с переносом из газовых электродов. Определить знаки электродов, записать уравнения для φ электродов. 8. Провести потенциометрическое титрование Аg+. Выбрать индикаторный электрод и электрод сравнения, составить гальваническую цепь. Выбрать реакцию титрования. Изобразить зависимость φ индикаторного электрода от объема титранта. 9. Провести электролиз водного раствора NaCl. Изобразить поляризационные кривые, записать реакции на катоде и аноде. 10. Законы Фарадея.
КИНЕТИКА Химическая кинетика – учение о химическом процессе, закономерностях протекания его во времени, механизме. Химическая кинетика открывает возможность сознательного управления промышленными процессами, позволяет ставить и решать вопросы интенсификации существующих и создания новых технологических процессов. Задачи кинетики и термодинамики различны. Термодинамика ставит и решает задачи определения состояния равновесия, константы равновесия, выхода продуктов, но не может определить время достижения равновесия, скорость процесса, концентрации веществ в любой момент времени. Эти задачи решает химическая кинетика. Но химическая кинетика может увеличить скорость только той реакции, которая является термодинамически возможной. Ниже приведены реакции получения из простых веществ водородных соединений неметаллов.
Термодинамический анализ показывает, что все реакции (кроме четвертой, где Если реакция протекает в одной фазе (газообразной или жидкой), то их изучением занимается кинетика гомогенных процессов. Если реакции совершаются на поверхности раздела фаз, то изучение их скоростей относится к кинетике гетерогенных процессов.
Скорость химической реакции Скорость химической реакции может быть дана через степень превращения. В реакции
Во второй строчке показано количество прореагировавших веществ ко времени t. Эта величина разная для различных веществ и по значению, и по знаку. Но если каждую из них поделить на соответствующий стехиометрический коэффициент, то все отношения будут одинаковыми и иметь положительный знак, поскольку а, в < 0, с, d > 0. Полученная величина называется химической переменной (или степенью протекания реакции),
Скорость реакции – это скорость изменения химической переменной (степени превращения, степени протекания реакции) во времени:
где dni – изменение количества i -го компонента, νi – стехиометрический коэффициент i -го компонента. Для большей наглядности определяют скорость в единице объема, то есть вводят величину,
На практике часто используют в качестве скорости реакции изменение концентрации в единицу времени:
Величина Графическое изображение С от времени называется кинетической кривой (рисунок 3.1). Проводя графическое дифференцирование можно найти величину производной dC/dt в любой момент времени, которая и будет характеризовать скорость реакции,
Рисунок 3.1 – Пример кинетической кривой
Необходимым условием, определяющим возможность взаимодействия между двумя молекулами, является их взаимное столкновение. Поэтому при заданных внешних условиях (Т, Р, среда) скорость является функцией концентраций реагирующих веществ, так как число столкновений при большей концентрации будет увеличиваться. Если химическая реакция протекает в одну стадию, то есть является элементарной, то непосредственно по ее стехиометрическому уравнению можно записать математическое выражение для скорости реакции в виде:
Для реакции aA + bB
|
||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 1471; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.017 с.) |

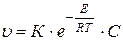 ,
,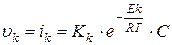 (2.15)
(2.15)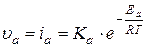 (2.16)
(2.16)
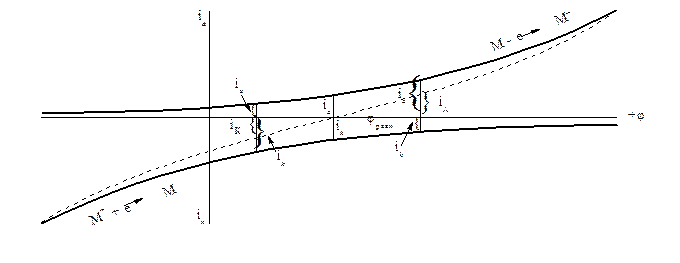
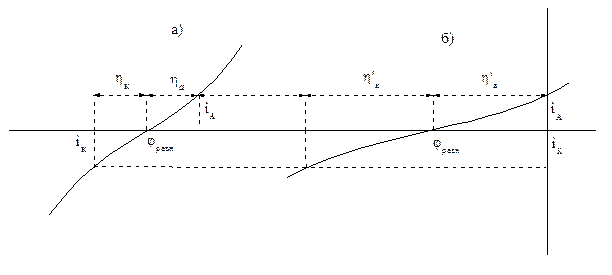
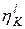 и
и 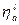
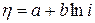 ,
, Cu2+ + 2e.
Cu2+ + 2e. в растворе есть ионы Н+ и
в растворе есть ионы Н+ и  . Запишем реакции, которые принципиально возможны на катоде и аноде.
. Запишем реакции, которые принципиально возможны на катоде и аноде.
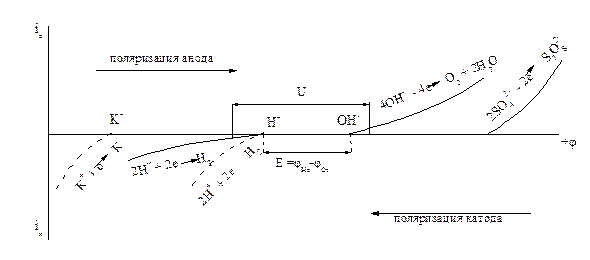
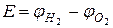 , то на электродах не смогут протекать реакции с образованием Н 2 и О 2. Для этого нужно чтобы ЭДС стала несколько больше разности
, то на электродах не смогут протекать реакции с образованием Н 2 и О 2. Для этого нужно чтобы ЭДС стала несколько больше разности 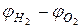 , то есть U (рисунок 2.9). Величина U называется напряжением разложения. На рисунке даны две кривые для восстановления Н+: сплошная – с большим перенапряжением реакции, пунктирная – с малым перенапряжением. Это зависит от выбора материала катода. Как уже было отмечено выше, на Pt реакция восстановления Н+ идет с малым перенапряжением, на других анодах – с большим.
, то есть U (рисунок 2.9). Величина U называется напряжением разложения. На рисунке даны две кривые для восстановления Н+: сплошная – с большим перенапряжением реакции, пунктирная – с малым перенапряжением. Это зависит от выбора материала катода. Как уже было отмечено выше, на Pt реакция восстановления Н+ идет с малым перенапряжением, на других анодах – с большим.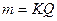 ,
,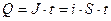 ,
, 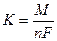 .
.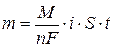 . (2.15)
. (2.15)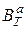 или
или 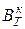 .
.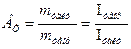 .
.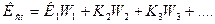 ,
,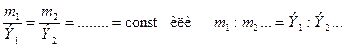 ,
,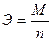 .
.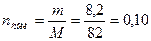 моль
моль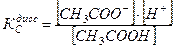
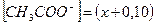 ,
,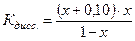 .
.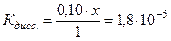
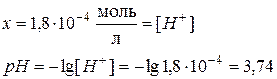
 . Подвижности ионов ОН- и Cl- соответственно равны 174·10-4 и 65,4·10-4
. Подвижности ионов ОН- и Cl- соответственно равны 174·10-4 и 65,4·10-4  . Вычислить предельную электрическую проводимость NH4ОН и число переноса иона NH4 + в растворе NH4Cl при бесконечном разведении.
. Вычислить предельную электрическую проводимость NH4ОН и число переноса иона NH4 + в растворе NH4Cl при бесконечном разведении.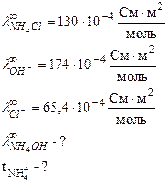
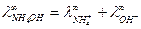 .
.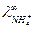 запишем закон Кольрауша для NH4Cl:
запишем закон Кольрауша для NH4Cl: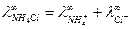 .
.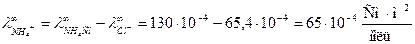 .
.
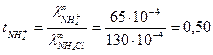 .
.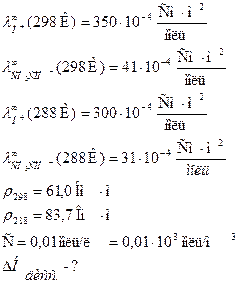
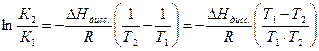
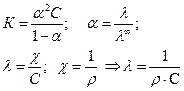
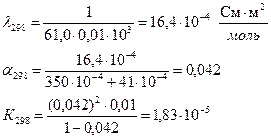
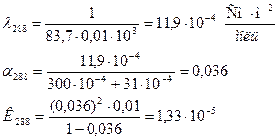
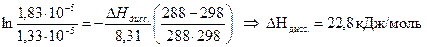
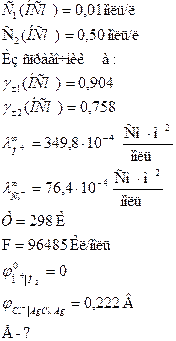
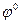 . Записываем реакции на электродах согласно их знакам:
. Записываем реакции на электродах согласно их знакам:

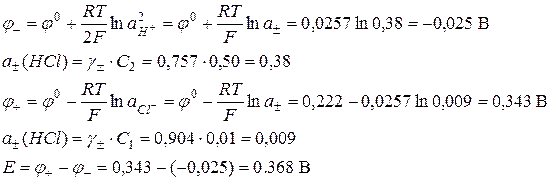
 , будут опережать ионы Сl-, образуя двойной электрический слой (ДЭС) на границе растворов с положительной правой обкладкой (см. цепь) и отрицательной левой. Таким образом, направление поля ДЭС и направление поля электродов совпадает и φдифф > 0.
, будут опережать ионы Сl-, образуя двойной электрический слой (ДЭС) на границе растворов с положительной правой обкладкой (см. цепь) и отрицательной левой. Таким образом, направление поля ДЭС и направление поля электродов совпадает и φдифф > 0.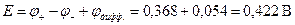
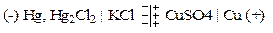
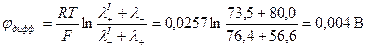
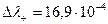 и с правой стороны границы накапливается положительный заряд. При движении Сl - и SO42 -
и с правой стороны границы накапливается положительный заряд. При движении Сl - и SO42 - 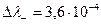 , то есть за счет большей подвижности SO42 -, слева накапливается отрицательный заряд, но
, то есть за счет большей подвижности SO42 -, слева накапливается отрицательный заряд, но 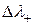 >
> 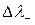 , что дает в итоге положительный потенциал
, что дает в итоге положительный потенциал 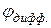 > 0.
> 0.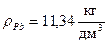 .
.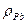 = 11,34 кг/дм3
= 11,34 кг/дм3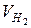 -?
-?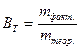
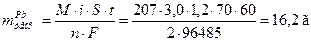
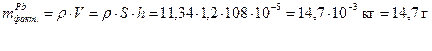
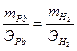 ;
;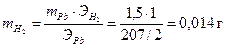
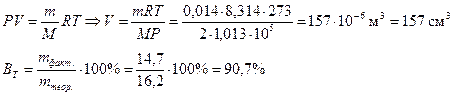
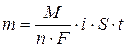 , откуда
, откуда 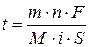 ,
,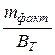 .
.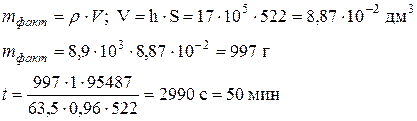
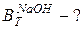
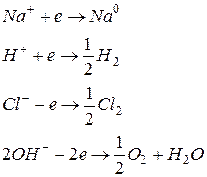
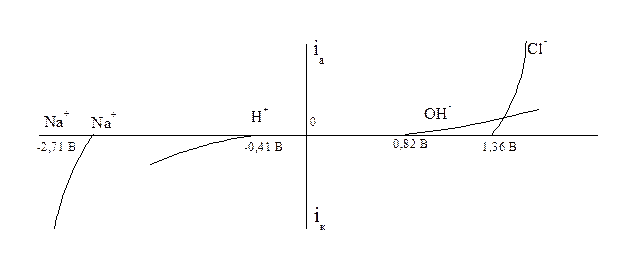
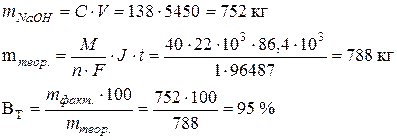
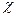 = f(C) для сильных и слабых электролитов.
= f(C) для сильных и слабых электролитов.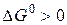 ) возможны. Но, например, реакция 3 имеет при обычных условиях очень низкую скорость и аммиак практически не образуется. И здесь уже задача кинетики – превратить возможность в действительность, что на практике достигается повышением температуры до 500 0С и применением катализатора.
) возможны. Но, например, реакция 3 имеет при обычных условиях очень низкую скорость и аммиак практически не образуется. И здесь уже задача кинетики – превратить возможность в действительность, что на практике достигается повышением температуры до 500 0С и применением катализатора.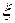 (кси).
(кси).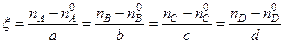 .
.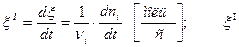 >0,
>0,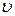 , если объем постоянен:
, если объем постоянен: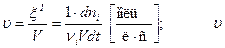 >0.
>0.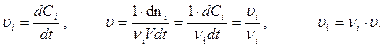
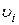 может быть положительной (для продуктов) и отрицательной (для исходных веществ); для разных веществ она различна, в то время как величины
может быть положительной (для продуктов) и отрицательной (для исходных веществ); для разных веществ она различна, в то время как величины 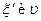 не зависят от выбора вещества и всегда положительны.
не зависят от выбора вещества и всегда положительны.
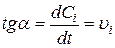
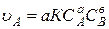
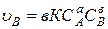 или
или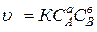 (3.1)
(3.1)


