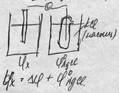Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ОВР.Осн. окисл-ли. и восст. Сост-е реакций.Содержание книги Поиск на нашем сайте
Сколько соли Сн=mсоли/(mэ*V(л))
mэ = M/(n*B) =M/(2*3)=400/6 n-число атомов\ионов B-валентность(заряд)
mсоли = Сн*mэ*V(л)=2*400/6*3=400г Сколько воды mH2O=mp-pa-mcoли = pV-400г=1,05г/см3*3000см3 – 400г=2750г (2,75 литра) \_ (pV)
Билет №1. ОВР.Осн. окисл-ли. и восст. Сост-е реакций. ОВР – реакции в результате которых изменяется степень окисления элементов. Элемент, который отдаёт e, окисляется и является восстановителем, а эл.кот.принимает e – восстанавливается и является окислителем. Уравнение ОВР: Определить элементы, имеющие степень окисления. Составить уравнение электронного баланса, указать ок-ль и вос-ль. Расставить коэф.в соед.,содержащих ок-ль или восс-ль. Уравнять металл, неметалл, водород. Проверить правильность коэф.: число кислорода в левой части должно равняться его числу в правой. Основные ок-ли: HNO3, H2SO4, HClO4, KMnO4 Основные вос-ли: NH3, H2S, Na2S2O3
Энтропия активации. Благ.соуд.молекул. Конст.ск-ти р-ции. Энергия активации (E*) – минимальное кол-во w, которую требуется сообщить системе, чтобы благоприятные соударения – соуд-я активных молекул, обладающих определённым избытком w по сравнению со средой w. Константа скор.хим.р-ции: Ур-е Аррениуса: K=A e-E*/2T Nакт = N0 e-E*/2T e-E*/2T = 9,718 Чем больше Е*, тем < υр-ции Если Е*>60-70 ккал/моль – р-ция не идёт E*<3-4 – р-ция идёт мгновенно.
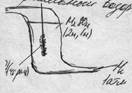
Норм.водородный электрод. Pt H2→2H H2SO4→H+HSO4 H →← H + e
Электроды сравнения. Измерение Эл-х потенциалов.
Билет №2. Основные хим. понятия. Основные законы химии. Атом – микроскопическая электронейтральная частица вещества, наименьшая часть хим.элемента, являющаяся носителем его св-в Молекула – наименьшая частица хим.в-ва,обладающая всеми его хим.св-вами Эквивалент – условная частица,в целое число раз меньшая (или равная) соответствующей ей формульной единицы – атома,мол-лы,иона Моль – единица кол-ва вещ-ва,т.е.величина,оцениваемой кол-вом содерж.в физической системе тождественных структурных элементов Валентность – способность атома присоединять или замещать опр.число других атомов или атомных групп с образованием хим.связи Хим.законы: 1) закон постоянства состава: в каждом опред. Хим.соединении независимо от способа его получения, соотношения масс, составляющих элементов постоянны
2) з-н кратных отношений: если 2 элемента образуют несколько соединений, то массы одного эл-та, приходящиеся на единицу массы другого,относятся как целые 3) з-н эквивалентов: отношения масс вступающих в хим взаимодействие в-в равны или кратны их хим эквивалентам 4) з-н Авагадро: в равных объемах идеальных газов при одинаковых давлении и температуре содержится одинаковое число мол-л. 2.Обратимые реакции. Химическое равновесие. Константа равновесия. Смещение равновесия.Принцип Ле-Шателье. Обратимые р-ции – р-ции, чье направление зависит от концентраций в-в – участников р-ции. Хим. равновесие – термодинамическое равновесие в системе, между компонентами которой происходят хим. реакции. К=Спрод / Сисх.в-в Смещение равновесия – принцип Ле-Шателье: при изменении любого из условий равновесия преимущественно протекает р-ция, восстанавливающая исх. условия При Т↑ - эндо…, при Т↓ - экзо…, при Р↓ - в сторону большего кол-ва газа, при Р↑ - наоборот.
Коррозия металлов. Химическая и электрохимическая к-я. Методы защиты. Разрушение металлов под действием хим.р-ций: 1) Химическая (газовая) - агрессивные газы (О2,СО2,SО2) 2) Электрохимическая -контактная Fe/Zn – коррозирует Zn Fe/sn-коррозирует Sn -в кислоте -в воде -в морской воде (NaCl: MgCl2 = 1: 3) -атмосферная (начинается как аэрированная, но имеет продолжение) -почвенная – сочетание различных типов коррозии с преобладанием коррозии при неравномерной аэрации -под действием "блуждающих токов" Защита от коррозии: 2) хим защита: -"танкерная" – "щелочной душ" – 30 мин,80С, 2%NaOH -ингибиторы – замедлители коррозии, "пирогенные смолы" 3) электрохимич. защита: протекторы (жертвенные аноды) 4) электрофизическая (анодная, катодная) Билет №3. Химическая теория 1) однородность 2) эффекты при растворении -изменение окраски -изменение объема -тепловые эффекты Концентрированные р-ры
Равновесие: хз
Билет №4.. Коррозия контактная, почвенная, под влиянием блуждающих токов.
Билет №5. 1.Законы разбавл. растворов: Закон Дальтона. Общее давление равное сумме первоначальных, если компоненты не взаимодействуют.
p=p1+p2+p3 p1,p2,p3 – парциальное давление 1й закон Рауля (о давлении пара над р-ром нелетучего вещ-ва). p=p1N1+p2N2 p1=0 – по условию p1N1 – вещество p2N2 – растворитель p2=p2N2=p2(1-N1)=p2 - p2N1 Δp=p2N1 2й закон Рауля (о t кипения и замерзании р-ров) Р-ры закипают при более высокой t и замерзают при более низкой по сравнению с растворителем.
2.Электролиз – совокупность процессов, протекающих на электродах, при пропускании эл.тока через расплав или раствор. Анодные процессы: 1) 2Br- – 2e = Br2 2) 2SO4 – 2e = S2O82- 3) 4OH- – 4e = O2 + 2H2O 4) 2H2O – 4e = O2 + 4H Легко: Cl, Br, I, S, CN Труднее: OH, H2O Оч.трудно: SO4, NO3 Катодные процессы: 1) Mn+ + ne = M0 2) 2H++2e=H2 3) 2H2O+2e=H2+2OH-
Билет №6.. Щелочные аккумул. Наиболее распространенные: никель-кармиевые и никель- железные аккумул. «+» электрод содержит гидроксид N: «-» - кадмий или железо 2NiOOH+Cd+2H2O →← 2No(OH)2+Cd(OH)2 2NiOOH+Fe+2H2O →← 2No(OH)2+Fe(OH)2 «+» большой срок службы, высокая механ. прочность «-» невысокий КПД напряжения Электролиз (зарядка): А(-) Pb+SO4=PbSO4+2e K(+) PbO2+4H+SO4+2e=PbSO4+2H2O ___________________________________________ Pb+PbO2+4H+2SO4=2PbSO4+2H2O \2H2SO4/ Зарядка: К(-) PbSO4+2e=Pb+SO4 A(+) PbSO4+2H2O-2e=PbO2+4H+SO4 ___________________________________________ 2PbSO4+2H2O=Pb+PbO2+2H2SO4 Способы очистки металлов. 1) Ваакумная перегонка (самый энергоемкий)
Билет №7. Билет №8. Закон Оствальда. Kg = α2/(1-α)*V α – степень диссоциации V – 1/c
Законы электролиза. 1) М.Фарадей m= э*i*t / F m – масса вещ-ва э – эквивалент вещ-ва i – ток, A t – время, с F = 96500 кл 2) равные кол-ва электричества разлагают, выделяют, образуют эквивалентые кол-ва в-в 2CuSO4+2H2O=2Cu↓+O2↑+2H2SO4 разлаг-ся выдел-ся образ-ся
Билет№9. Билет№ 10. Ур.- е Нернста φ=φ0+RT*lnCMn+/nF, где φ- электродный потенциал, φ0 – стандартный Э.П., F- число Фарадея. Стандартный Э.П.- это потенциал Ме в одномолярном р.- ре своей соли, измеренный в стандартных условиях по отношению к нормальному водородному электроду. Билет №11. 1.Химич. источники электрич. энергии (гальвонические элементы) – устройство для преобразования химической энергии окислительно-восстановительной реакции в электрическую. Электродвижущая сила (ЭДС) – физическая величина, характеризующая работу непотенциальных (сторонних) сил в источниках постоянного или переменного тока. ε = ε0 + 0,059/n * lg * Cкатод/Cанод Концентрационный элемент: ЭДС создаётся за счёт различия концентраций одной и той же соли на аноде и катоде A(-)Zn|ZnSO4||ZnSO4|Zn(+)K C1<C2
2.Диссоциация воды: H2O →← H+ + OH- H+ * 2H2O = H5O2+ OH- * 3H 2 O = H 7 O 4- 6H2O →← H5O2+ + H7O4
Kдис=CH+*COH-/CH2O=1,8*10-16 CH2O=1000/18 моль/л Ионное произведение воды: Сh+*COH-=1000/18*1,8*10-16=110-14=KH2O CH + COH - = 10 -14 lgCH+ + lgCOH- = -14 Водородный показатель: pH= -lgCH+ Гидроксильный показатель: pOH = -lgCOH- pH + pOH = 14 нейтр.: pH=pOH=7 кисл.: pH<7; pOH>7 щелочн.: pH>7; pOH<7
3.Алюминий: 13Al Al2O3*nH2O – боксит Al2O3*H2O(AlOOH) – белит Al2O3*2SiO*2H2O – каолинит Получение: электролиз: Na3AlF6+Al2O3; K(-)Al; A(+)O2 Применение: 1.Al – электротехника, упаковочный материал; 2.AL2O3 – важнейший катализатор, нефтехимия; 3.Al – в виде сплавов Свойства: р=2,70 г/см3; toпл = 660оС; Al0 – типичный полуметалл Al0 все неметаллы --> Al (III) Al + H2O = Al(OH)3↓ + H2↑ Магний: 12Mg MgCO3 – магнезий MgCl2 * 6H2O – бишофит Mg(OH)2 – брусит 3MgO*4SiO2*H2O - тальк Получение: электролиз карналлита или MgCl (из морской H2O) Применение: "электрон" Свойства: р=1,74 г/см3; toпл = 651оС;
Mg – активный металл Mg все неметаллы --> Mg (II) Mg воздух --> MgO, MgN2, i Металлотермия на основе Mg: U, Zn, V U3O8, ZnO2, V2O2 + Mg → металлы + MgO
Билет №12. 1.ОВС - сис-ма в которой происходит обмен электронами. Любая ОВС характеризуется ОВП (окислительно-восст. потенциал). ОВП для систем одного типа измеряется по отношению к нормальному водородному электроду или электроду сравнения, а для систем 2-х других типов – с помощью платинового измерительного электрода.
2.Зависимость скорости реакции от to: Правило Вант-Гоффа: повышение температуры ускоряет большинство хим. реакций V2=V1* γ (T2-T1)/10 Теория активных молекул: Реакция происходит при соударении не любых молекул, а только активных, обладающих определенным избытком энергии по сравнению со средней энергией (т.н «энергия активации»). 3.Жесткость воды - совокупность свойств, придаваемых воде ионами Ca2+, Mg2+, Fe2+ Виды жесткости: 1.временная (карбонатная) - Сa(HCO3)2, Mg(HCO3)2, Fe(HCO3)2 2.постоянная (некарбонатная) - все простые соли Сa2+, Mg2+, Fe2+ 3.общая (Жврем+Жпост.) Классификация: -очень мягкая (0-1,5 ммоль/л) -мягкая (1,5-3,5 ммоль/л) -средне-жесткая (3,5-6,0 ммоль/л) -жесткая (6,0-10 ммоль/л) -очень жесткая (>10 ммоль/л)
Билет №13. 1.Зависимость скорости реакции от to: Правило Вант-Гоффа: повышение температуры ускоряет большинство хим. реакций V2=V1* γ (T2-T1)/10 Теория активных молекул: Реакция происходит при соударении не любых молекул, а только активных, обладающих определенным избытком энергии по сравнению со средней энергией (т.н «энергия активации»). Сколько соли Сн=mсоли/(mэ*V(л))
mэ = M/(n*B) =M/(2*3)=400/6 n-число атомов\ионов B-валентность(заряд)
mсоли = Сн*mэ*V(л)=2*400/6*3=400г Сколько воды mH2O=mp-pa-mcoли = pV-400г=1,05г/см3*3000см3 – 400г=2750г (2,75 литра) \_ (pV)
Билет №1. ОВР.Осн. окисл-ли. и восст. Сост-е реакций. ОВР – реакции в результате которых изменяется степень окисления элементов. Элемент, который отдаёт e, окисляется и является восстановителем, а эл.кот.принимает e – восстанавливается и является окислителем. Уравнение ОВР: Определить элементы, имеющие степень окисления. Составить уравнение электронного баланса, указать ок-ль и вос-ль. Расставить коэф.в соед.,содержащих ок-ль или восс-ль. Уравнять металл, неметалл, водород. Проверить правильность коэф.: число кислорода в левой части должно равняться его числу в правой. Основные ок-ли: HNO3, H2SO4, HClO4, KMnO4 Основные вос-ли: NH3, H2S, Na2S2O3
|
|||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 282; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.252.243 (0.01 с.) |