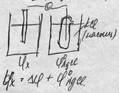Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энтропия активации. Благ.соуд.молекул. Конст.ск-ти р-ции.Содержание книги
Поиск на нашем сайте
Энергия активации (E*) – минимальное кол-во w, которую требуется сообщить системе, чтобы благоприятные соударения – соуд-я активных молекул, обладающих определённым избытком w по сравнению со средой w. Константа скор.хим.р-ции: Ур-е Аррениуса: K=A e-E*/2T Nакт = N0 e-E*/2T e-E*/2T = 9,718 Чем больше Е*, тем < υр-ции Если Е*>60-70 ккал/моль – р-ция не идёт E*<3-4 – р-ция идёт мгновенно.
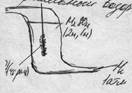
Норм.водородный электрод. Pt H2→2H H2SO4→H+HSO4 H →← H + e
Электроды сравнения. Измерение Эл-х потенциалов.
Билет №2. Основные хим. понятия. Основные законы химии. Атом – микроскопическая электронейтральная частица вещества, наименьшая часть хим.элемента, являющаяся носителем его св-в Молекула – наименьшая частица хим.в-ва,обладающая всеми его хим.св-вами Эквивалент – условная частица,в целое число раз меньшая (или равная) соответствующей ей формульной единицы – атома,мол-лы,иона Моль – единица кол-ва вещ-ва,т.е.величина,оцениваемой кол-вом содерж.в физической системе тождественных структурных элементов Валентность – способность атома присоединять или замещать опр.число других атомов или атомных групп с образованием хим.связи Хим.законы: 1) закон постоянства состава: в каждом опред. Хим.соединении независимо от способа его получения, соотношения масс, составляющих элементов постоянны 2) з-н кратных отношений: если 2 элемента образуют несколько соединений, то массы одного эл-та, приходящиеся на единицу массы другого,относятся как целые 3) з-н эквивалентов: отношения масс вступающих в хим взаимодействие в-в равны или кратны их хим эквивалентам 4) з-н Авагадро: в равных объемах идеальных газов при одинаковых давлении и температуре содержится одинаковое число мол-л. 2.Обратимые реакции. Химическое равновесие. Константа равновесия. Смещение равновесия.Принцип Ле-Шателье. Обратимые р-ции – р-ции, чье направление зависит от концентраций в-в – участников р-ции. Хим. равновесие – термодинамическое равновесие в системе, между компонентами которой происходят хим. реакции. К=Спрод / Сисх.в-в Смещение равновесия – принцип Ле-Шателье: при изменении любого из условий равновесия преимущественно протекает р-ция, восстанавливающая исх. условия При Т↑ - эндо…, при Т↓ - экзо…, при Р↓ - в сторону большего кол-ва газа, при Р↑ - наоборот.
Коррозия металлов. Химическая и электрохимическая к-я. Методы защиты. Разрушение металлов под действием хим.р-ций: 1) Химическая (газовая) - агрессивные газы (О2,СО2,SО2) 2) Электрохимическая -контактная Fe/Zn – коррозирует Zn Fe/sn-коррозирует Sn -в кислоте -в воде -в морской воде (NaCl: MgCl2 = 1: 3) -атмосферная (начинается как аэрированная, но имеет продолжение) -почвенная – сочетание различных типов коррозии с преобладанием коррозии при неравномерной аэрации -под действием "блуждающих токов" Защита от коррозии: 2) хим защита: -"танкерная" – "щелочной душ" – 30 мин,80С, 2%NaOH -ингибиторы – замедлители коррозии, "пирогенные смолы" 3) электрохимич. защита: протекторы (жертвенные аноды) 4) электрофизическая (анодная, катодная) Билет №3. Общие понятия о растворах. Физ и хим теория растворов. Эффекты при растворении. Общие понятия о растворах: Растворы – гомогенные системы переменного состава р-р состоит из растворителя и растворенного Rра - Газообразного (воздух) - Жидкие - Твердые (сплавы) Физическая теория (р-ры-механические смеси) 1) переменный состав 2) проявление свойств компонентов разбавленные растворы – мех смеси Химическая теория 1) однородность 2) эффекты при растворении -изменение окраски -изменение объема -тепловые эффекты Концентрированные р-ры
Кинетика и равновесие в гетерогенных системах. Скоростью гетерогенных реакций назыв. кол.-во вещ.-ва, вступ. в реак. или обр.- ся при реакции за единицу времени на единице поверхности фазы. ν=δn / S*δt, где n- число молей одного из получ. Вещ.- в,S- площадь пов.- ти фазы, t- время Скорость реакции зависит от: -концентрации -температуры -природы вещ.-в Равновесие: хз
|
||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 174; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.41.200 (0.009 с.) |