
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрохимические свойства белков как основа методов их исследования. Электрофорез белков крови.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Электрохимические свойства белков как основа методов их исследования. Электрофорез белков крови. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. 1. Молекулярная масса белков определяет многие свойства белков: седиментация, диффузия, плотность белковых растворов, коллоидные свойства белков и др. характеристики. Молекулярная масса: инсулин (5700), МИОГЛОБИН (17000), ПЕПСИН (35000), ГЕМОГЛОБИН (65000). Молекулярную массу белка можно определить по скорости седиментации (осаждения) при УЛЬТРАЦЕНТРИФУГИРОВАНИИ, т.е. при ускорении 100000-500000 дальтон. На основании этого определяют коэффициент седиментации, который обозначают S (в честь СВЕДБЕРГА) Он предложил за единицу коэффициента седиментации величину 10-13 степени. У большинства белков колеблется в пределах 1-2 СВЕДБЕРГОВ. Др. методом определения молекулярной массы является метод ГЕЛЬФИЛЬТРАЦИИ (молекулярное просеивание). Используется искусственно созданные гранулы, имеющие поры (гранулы СЕФАДЕКСА). Внутрь гранулы могут проникать только соединения определённого размера: молекулы небольшого размера входят в гранулы, а большие быстрее вымываются. Молекулярная масса рассчитывается ориентировочно. Буфер не задерживается, а белок движется тем медленнее, чем меньше молекулярная масса. 2. Способность белков связываться с ЛИГАНДАМИ. Белки способны связываться с определенными веществами. Белки специфично узнают свои ЛИГАНДЫ, что обусловлено комплиментарным строением определённого участка белка и ЛИГАНДЫ. Fe2+О2. ИЗБИРАТЕЛЬНОСТЬ обеспечивается белковой частью гемоглобина. Центр связывания ЛИГАНДА называется активным центром. Это свойство лежит в основе др. метод разделения белков – АФФИНАЯ ХРОМАТОГРАФИЯ (разделение по сродству). 3. Электрохимические свойства белков. А. АМФОТЕРНОСТЬ. Белки - АМФОТЕРНЫЕ ЭЛЕКТРОЛИТЫ СООН — кислотные свойства, R NN2 - (основные свойства) АМФОТЕРНОСТЬ обусловлена: 1. Концевыми СООН и NN2 группами. 2. Боковым и группами: ГЛУ, АСП – дополнительные кислотные свойства АРГ, ЛИЗ, ГИС - основные свойства. Т.к. белковые молекулы имеют много ИОИОГЕННЫХ групп, следовательно, они ПОЛИЭЛЕКТРОЛИТЫ, БЕЛКИ являются АМФОЛИТАМИ. Б. Буферные свойства - способность поддерживать РН среды. Наиболее мощным буфером крови является ГЕМОГЛОБИНОВЫЙ буфер, т.к. в большом количестве содержит гистидин.
В. Белки содержат заряд, который зависит от соотношения кислотных и основных групп, а оно в свою очередь зависит от их диссоциации, определяющейся РН среды. Изоэлектрическое состояние - это состояние молекулы белка, при котором её заряд равен 0. Значение РН, при котором белок находится в изоэлектрическом состоянии, называется изоэлектрической точкой. РI кислые белки<7 (белки протоплазмы) РI основные белки >7 (ядерные белки). В изоэлектрическом состоянии белок менее устойчив. Это свойство белков используется при их ФРАКЦИВАНИИ: ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ. Для неё используется ИОНООБМЕННИКИ, которые изготавливаются из чистой целлюлозы: ДЭАЭ - целлюлоза (содержит катионные группы); КМ - целлюлоза (содержит анионные группы). На ДЭАЭ разделяют отрицательно заряженные белки, на КМ - положительно заряженные. Чем больше в белке СООН групп, тем прочнее он связывается с ДЭАЭ целлюлозой Разделение белков на основании величины заряда - электрофорез белков. С помощью электрофореза в сыворотке крови выделяют как минимум 5 фракций: АЛЬБУМИНЫ альфа, альфа-2, гамма, бета - глобулины. Углевод-белковые комплексы. Строение углеводных компонентов. Гликопротеины и протеогликаны. Белки, связанные с углеводными группами, составляют обширный класс соединений, в котором выделяют две большие группы: 1. Гликопротеины — белки, содержащие в качестве простетической группы небольшое количество углеводов (до 15%), присоединенных к аминокислотным радикалам ковалентными связями. В составе углеводной части определяются гексозы (галактоза, манноза, редко глюкоза), пентозы (ксилоза, арабиноза), дезоксисахара (фукоза, рамноза), аминосахара (ацетилгалактозамин, ацетилглюкозамин), нейраминовая кислота и ее уксуснокислые эфиры (сиаловые кислоты). Большинство этих белков обладает слабовыраженными кислыми свойствами. В группе гликопротеинов выделяют серомукоиды (серогликоиды), обладающие выраженными кислыми свойствами и растворимых в хлорной, трихлоруксусной и сульфосалициловой кислотах. Эта фракция, составляя 1% всех белков сыворотки, включает 12% всех углеводов плазмы. 2. Протеогликаны (мукополисахариды) — гидрофильные соединения, в состав которых входит 20‑80% углеводов. Углеводные компоненты протеогликанов называют гликозаминогликанами. Выделяют 7 типов гликозаминогликанов, из них 5 типов содержат в своем составе глюкуроновую кислоту (к ним относятся гиалуроновая кислота, хондроитин-4‑сульфат и хондроитин-6‑сульфат, гепарин и гепарансульфат), шестой тип (дерматансульфат) содержит идуроновую (галактуроновую) кислоту, седьмой (кератансульфат) — галактозу. Сиаловые кислоты, манноза, ксилоза присутствуют в минимальном количестве. Протеогликаны имеют сильно выраженные кислотные свойства благодаря наличию большого числа карбоксильных групп и остатков серной кислоты.
Липид-белковые комплексы. Строение липидных компонентов. Структурные протеолипиды и липопротеины, их функции. Все фракции липидов циркулируют в плазме крови в виде белково-липидных комплексов (хиломикроны, липопротеины очень низкой, низкой и высокой плотности), свободные жирные кислоты находятся в комплексе с альбуминами. Для клинической практики наиболее важным является определение количества общих липидов, триацилглицеринов, общего холестерина и его фракций, отдельных классов липопротеинов. Протеолипиды – это белково-липидные соединения, экстрагируемые органическим растворителями изткани мозга. Отличаются от водорастворимых липопротеинов тем, что они нерастворимы в воде, но растворимы в смеси хлороформ–метанол. Белки, освобожденные от липидов, растворимы в воде, а тж (благодаря высокому содержанию гидрофобных аминокислот) в смеси хлороформ–метанол. Наибольшее количество про-теолипидов сосредоточено в миелине, в небольших количествах они входят в состав синаптических мембран и синаптических пузырьков. Липопротеины плазмы подразделяются на две группы: белки, связанные с липидами ковалентно, и белки, связанные с липидами нековалентными связями. Липид, ковалентно связанный с липопротеином, служит якорем, с помощью которого белки прикрепляются к мембране. Липопротеины второй группы не имеют строго определенного состава. Они скорее представляют собой агрегаты липидов с белками. Эти липопротеиновые комплексы имеют переменные размеры и состав. В плазме крови они обеспечивают транспорт водонерастворимых липидов. Коферменты и их функции в ферментативных реакциях. Витаминные коферменты. Примеры реакций с участием витаминных коферментов. Для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента. Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат. Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+.
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот. Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие впроявлении каталитической функции ферментов. К коферментам относят следующие соединения: производные витаминов; гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов; нуклеотиды - доноры и акцепторы остатка фосфорной кислоты; убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ; фосфоаденозилфосфосульфат, участвующий в переносе сульфата; S-аденозилметионин (SAM) - донор метильной группы; глутатион, участвующий в окислительно-восстановительных реакциях. Витаминные коферменты: тиаминдифосфат (тиамин) – декарбоксилирование альфа-кетокислот; Флавинмононуклеотид (ФМН, ФАН, рибофлавин) – ОВР; НАД, НАДФ (никотиновая кислота) – ОВР; КоА (пантотеновая кислота) – перенос ацильных групп; перидоксальфосфат (перидоксин) – перенос аминогрупп; биотицин (биотин) – перенос СО2. 13. Свойства ферментов. Лабильность конформации, влияние температуры и рН среды. Специфичность действия ферментов, примеры реакций. Свойства: высокая эффективность действия (повышают скорость реакции в 108-12 раз); · Ферменты являются белками, проявляют термолабильные свойства (чувствительны к изменениям температуры); · Изменение рН приводит к изменениям степени ионозации кислых и основных групп в активном центре фермента; · Высокая специфичность действия фермента (субстратная специфичность) – способность фермента катализировать превращения только одного субстрата/сходных по структуре. Она определяется структурой адсорбированного участка активного центра фермента. Выделяют 3 типа специфичности: 1) абсолютная – способность фермента катализировать определенный субстрат (уриаза →мочевина); 2) относительная – способность фермента катализировать превращение нескольких сходных по строению субстратов; 3) стереоспецифичность – способность фермента катализировать превращения определенных стереоизомеров.
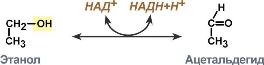
Номенклатура и классификация ферментов. Характеристика класса оксидоредуктаз. Примеры реакций с участием оксидоредуктаз. В 1961 г в Москве V Международный биохимический союз принял современную классификацию ферментов. В соответствии с этой классификацией все ферменты делятся: на классы – по типу катализируемой реакции, каждый класс подразделяется на подклассы – по природе атакуемой химической группы, подклассы делятся на подподклассы – по характеру атакуемой связи или по природе акцептора. Выделяют 6 классов ферментов: I класс – Оксидоредуктазы (подробно) II класс – Трансферазы (подробно) III класс – Гидролазы (подробно) IV класс – Лиазы (подробно) V класс – Изомеразы (подробно) VI класс – Лигазы (подробно) Каждому ферменту присвоен четырехзначный классификационный номер, включающий класс, подкласс, подподкласс и порядковый номер в подподклассе. Чтобы дать ферменту название существует два способа: 1. Систематическое название – согласно современной классификации. Часто такое название длинно и сложно для использования, поэтому как производное систематического названия у многих ферментов имеется одно или несколько рабочих названий. 2. Тривиальное название – название, сложившееся исторически. Например, пепсин, трипсин. Для некоторых ферментов (чаще для гидролаз) к названию субстрата добавляется окончание "-аза" – уреаза, амилаза, липаза. Тем не менее и у таких ферментов имеется систематическое название. Оксидоредуктазы - Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота. Примером подклассов могут служить ферменты, действующие на СН-ОН-группу доноров, на СH-СН-группу доноров, на СН-NН2-группу доноров, на гемсодержащие доноры.
1. Дегидрогеназы – оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода. 2. Если перенос водорода от молекулы донора трудно доказуем, то такие оксидоредуктазы называют редуктазами. 3. Оксидазы – оксидоредуктазы, катализирующие окисление субстратов с молекулярным кислородом в качестве акцептора электронов без включения кислорода в молекулу субстрата. 4. Монооксигеназы – оксидоредуктазы, катализирующие внедрение одного атома кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода. 5. Диоксигеназы – оксидоредуктазы, катализирующие внедрение 2 атомов кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода. 6. Пероксидазы – оксидоредуктазы, катализирующие реакции с пероксидом водорода в качестве акцептора электронов. 15. Характеристика класса лиаз, изомераз и лигаз (синтетаз), примеры реакций.
Примером подклассов являются ферменты, действующие на углерод-углеродные связи, углерод-кислородные связи, углерод-азотные связи.
Примером подклассов служат группы ферментов по виду образуемой связи: углерод-кислород, углерод-сера, углерод-азот, углерод-углерод. Характеристика классов ферментов трансфераз и гидролаз. Примеры реакций с участием данных ферментов. Трансферазы катализируют реакции переноса различных групп от одного субстрата (донор) к другому (акцептор), участвуют в реакциях взаимопревращения различных веществ, обезвреживания природных и чужеродных соединений. Коферментами являютсяпиридоксальфосфат, коэнзим А, тетрагидрофолиевая кислота, метилкобаламин. Класс подразделяется на 9 подклассов в зависимости от строения переносимых групп.Примером подклассов являются ферменты, переносящие одноуглеродные фрагменты, альдегидные или кетоостатки, ацильные остатки, азотсодержащие группы, фосфорсодержащие группы.На подподклассы деление производится в зависимости от вида переносимой группы – метил (2.1.1.), карбоксиметил или формил (2.1.2.), амино-группы (2.6.1.). Часто встречается рабочее название трансфераз – киназы. Это трансферазы, катализирующие перенос фосфата от АТФ на субстрат (моносахариды, белки и др), т.е.фосфотрансферазы. Гидролазы – ферменты, осуществляющие разрыв внутримолекулярных связей в субстрате (за исключением С-С связей) путем присоединения элементов Н2О, подразделяются на 13 подклассов. Ввиду сложности многих субстратов у ряда ферментов сохранены тривиальные названия, например, пепсин, трипсин. Коферменты отсутствуют. Гидролазы широко представлены ферментами желудочно-кишечного тракта (пепсин, трипсин, липаза, амилаза и другие) и лизосомальными ферментами. Осуществляют распад макромолекул, образуя легко адсорбируемые мономеры. Примером подклассов служат группы ферментов, действующие на сложные эфиры, на простые эфиры, на пептиды, на углерод-углеродные связи. 1. Эстеразы – гидролиз сложноэфирных связей. 2. Липазы – гидролиз нейтральных жиров (триацилглицеролов). 3. Фосфатазы – гидролиз моноэфиров фосфорной кислоты. 4. Гликозидазы – гидролизуют О- и S-гликозидные связи. 5. Протеазы, пептидазы – гидролиз белков и пептидов. 6. Нуклеазы – гидролиз нуклеиновых кислот. 17. Современные представления о механизме действия ферментов. Стадии ферментативного катализа, молекулярные эффекты, примеры. Ферменты обладают очень высокой специфичностью. Фишер в 1890 г. высказал предположение, что эта специфичность обусловливается особой формой молекулы фермента, точно соответствующей форме молекулы субстрата (или субстратов). Эту гипотезу часто называют гипотезой «ключа и замка»: субстрат сравнивается в ней с «ключом», который точно подходит по форме к «замку», т. е. к ферменту. В схематическом виде это представлено на рисунке. Часть молекулы фермента, вступающую в контакт с субстратом, называют активным центром фермента, и именно активный центр фермента имеет особую форму. Молекулы большей части ферментов во много раз крупнее, чем молекулы тех субстратов, которые атакует данный фермент. Активный же центр фермента составляет лишь очень небольшую часть его молекулы, обычно от 3 до 12 аминокислотных остатков. Роль остальных аминокислот, составляющих основную массу фермента, заключается в том, чтобы обеспечить его молекуле правильную глобулярную форму, которая, как мы увидим далее, очень важна для наиболее эффективной работы активного центра фермента. Образовавшиеся продукты по форме уже не соответствуют активному центру фермента. Они отделяются от него (поступают в окружающую среду), после чего освободившийся активный центр может принимать новые молекулы субстрата. В 1959 г. Кошланд предложил новую интерпретацию гипотезы «ключа и замка», получившую название гипотезы «индуцированного соответствия». На основе данных, позволяющих считать ферменты и их активные центры физически более гибкими, чем это казалось вначале, он заключил, что субстрат, соединяясь с ферментом, вызывает какие-то изменения в структуре его активного центра. Аминокислотные остатки, составляющие активный центр фермента, принимают определенную форму, которая дает возможность ферменту наиболее эффективным образом выполнять свою функцию.Подходящей аналогией в этом случае может служить перчатка, которая при надевании на руку соответствующим образом изменяет свою форму. По мере выяснения отдельных деталей механизма различных реакций в эту гипотезу вносятся уточнения. Любая ферментативная реакция протекает через ряд промежуточных стадий. Различают три основных этапа ферментативного катализа. 1 этап: Ориентировочная сорбция субстрата на активном центре фермента с образованием обратимого E-S комплекса (фермент-субстратного). На этом этапе происходит взаимодействие адсорбционного центра фермента с молекулой субстрата. При этом и субстрат подвергается конформационной перестройке. Все это происходит за счет возникновения слабых типов связей между субстратом и адсорбционным центром фермента. В результате этого молекула субстрата подается на каталитический центр в наиболее удобном для него положении. Этот этап является легко обратимым, потому что здесь участвуют только слабые типы связей. Кинетическая характеристика 1-го этапа ферментативного катализа - константа Михаэлиса (Км). 2 этап: Химические превращения молекулы субстрата в составе фермент-субстратного комплекса с образованием комплекса фермента с химически преобразованным субстратом. На этом этапе разрываются одни ковалентные связи и возникают новые. Поэтому этот этап протекает значительно медленнее, чем 1-й и 3-й этапы. Именно скорость второго этапа определяет скорость всей ферментативной реакции в целом. Значит, скорость ферментативного процесса в целом характеризуется величиной k+2, которая является почти всегда самой маленькой из всех частных констант скоростей. Кинетическая характеристика 2-го этапа - максимальная скорость (Vmax). 3 этап:Десорбция готового продукта из его комплекса с ферментом. Этот этап протекает легче, чем 2-й. Он, как и 2-й этап, тоже необратим. Исключение - обратимые ферментативные реакции. Молекулярные эффекты: 1) эффект концентрирования – в растворе субстрата находятся далеко друг от друга, фермент концентрирует субстрат в активном центре. 2) эф-кт ориентации – в активном центре ориентируют друг к другу группы субстрата. 3) принудительного соответствия – две точки зрения: гипотеза Фишера – имеется строгое соответствие субстрата и активного центра фермента; фермент – это жёсткая структура, а субстрат является слепком его активного центра; абсолютная специфичность – относительная специфичность. Теория Кошланда: фермент – гибкая структура; после связывания фермента с субстратом изменяется конформация активного центра фермента и всей молекулы субстрата. 4) деформация субстрата. 5) кислотно-основный катализ – в активном центре располагается группа кислого и основного типов. Одни группы присоединяют протоны Н, другие его отщепляют. 6) ковалентный катализ (сериновые протеазы) – ковалентные связи между группами активного центра и субстратом. Промежуточный Е-S комплекс легче распадается. 7) натяжение «дыбы» - после связывания молекула субстрата растягивается и принимает напряжённую деформационную конфигурацию. При этом увеличивается длинна межатомных связей. 18. Ингибирование ферментов. Конкурентное и неконкурентное ингибирование, примеры реакций. Лекарственные вещества как ингибиторы ферментов. Для регуляции некоторых клеточных функций наряду с генетическими используются ферментативные механизмы, основанные на прямом действии ингибиторов или активаторов тех или иных внутриклеточных ферментов. Таким образом, ферментативная регуляция представляет собой второй способ, используемый клеткой для контроля над течением биохимических процессов. Ингибирование ферментов. Некоторые внутриклеточные вещества непосредственно действуют на участвующие в их синтезе ферменты по механизму обратной связи. Синтезируемые в клетке вещества чаще всего действуют на первый фермент метаболической цепочки, а не на последующие, обычно связываясь с ним напрямую и вызывая аллостерические конформационные изменения, которые и приводят к инактивации фермента. Нетрудно догадаться, почему инактивируется первый фермент — это предотвращает накопление ненужных промежуточных метаболитов. Ингибирование ферментов — еще один пример механизма отрицательной обратной связи. Он отвечает за регуляцию внутриклеточной концентрации множества аминокислот, пуринов, пиримидинов, витаминов и других веществ. Конкурентное ингибирование. В этом случае вещество, близкое по своей структуре к обычному субстрату фермента, соединяется с активным центром фермента, но не может прореагировать с ним. Находясь здесь, оно преграждает доступ к активному центру любой молекуле настоящего субстрата.Поскольку в этом случае ингибитор и субстрат конкурируют за место на активном центре фермента, эту форму ингибирования называют конкурентным ингиЖированием. Для конкурентного ингибирования характерно, что, если концентрация субстрата увеличивается, то скорость реакции возрастает, т. е. это ингибирование обратимо. Явление конкурентного ингибирования помогает понять механизм действия некоторых лекарственных препаратов, в частности сульфаниламидов. Цель химиотерапии — уничтожить при помощи тех или иных химических препаратов возбудителя болезни, не повреждая при этом ткани организма-хозяина. Первыми такими препаратами были сульфаниламиды, антибактериальное действие которых было обнаружено в 30-е годы XX в. Во время второй мировой войны их широко применяли для борьбы с раневыми инфекциями. Сульфаниламиды по своей химической природе близки к парааминобензойной кислоте (ПАБК) — необходимому фактору роста многих патогенных бактерий. ПАБК требуется бактериям для синтеза фолиевой кислоты, которая служит у них одним из кофакторов ферментов. Сульфаниламиды ингибируют один из ферментов, участвующих в синтезе фолиевой кислоты из ПАБК. Животные клетки нечувствительны к сульфаниламидам, хотя им для некоторых реакций и требуется фолиевая кислота. Объясняется это тем, что они используют уже образованную фолиевую кислоту; метаболический путь, который бы обеспечивал ее синтез, у них отсутствует. Неконкурентное обратимое ингибирование. Ингибиторы этого типа не родственны по своей структуре субстрату данного фермента; в образовании комплекса с ингибитором участвует в этом случае не активный центр фермента, а какая-нибудь другая часть его молекулы. Это не препятствует соединению субстрата с ферментом, но делает невозможным катализ.С повышением концентрации ингибитора скорость реакции все более снижается. К моменту насыщения ингибитором она оказывается практически равной нулю. В отличие от конкурентного инги-бирования в этом случае повышение концентрации субстрата на скорость реакции не влияет. 19. Понятие об изоферментах. Характеристика изоферментов лактатдегидрогеназы (ЛДГ) и креатинкиназы (КК). Использование ферментов в медицине. Энзимодиагностика и энзимотерапия. Энзимопатология, примеры. Изоферменты – молекулярные формы одного и того же фермента, возникшее в результате небольших генетических различий в первичной структуре фермента. ЛДГ – имеет 4 субъединицы: 2 типа Н и М. Имеет несколько форм: НННН-ЛДГ-1 (сердечная мышца), НННМ-ЛДГ-2 (сердечная мышца), ННММ-ЛДГ-3, НМММ-ЛДГ-4 (скелетная мышца, печень), ММММ-ЛЛДГ-5 (скелетная мышца, печень). КК – 2 субъединицы: М и В. ММ (мышца), МВ (сердечная мышца), ВВ (мозг). Энзимодиагностика – диагностика пораженных органов и тканей, заболевания человека по изменению активности ферментов в сыворотке крови. Энзимотерапия – использование препаратов ферментов с лечебной целью. Энзимопатологии (энзимопатии) – состояния, связанные с патологическим изменением активности ферментов. Наиболее часто встречается снижение активности и нарушение каких-либо метаболических процессов. В результате энзимопатологии клиническое значение может иметь: накопление субстрата реакции, например: фенилаланина при фенилкетонурии, свободного билирубина при желтухах новорожденных, некоторых жиров при болезнях лизосомального накопления (липидозы); недостаток продукта, например: меланина при альбинизме, катехоламинов припаркинсонизме; обе особенности одновременно, как при гликогенозах, сопровождающихся гипогликемией при избытке гликогена в печени. Цитохромы электронтранспортной цепи. Их функционирование. Образование воды как конечного продукта обмена. КоQ-цитохром с-оксидоредуктаза - Данный комплекс включает цитохромы b и c1. Кроме цитохромов в нем имеются 2 железо-серных белка. Всего насчитывается 11 полипептидных цепей общей молекулярной массой около 250 кDа. Функция: Принимает электроны от коэнзима Q и передает их на цитохром с; Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. Цитохром с-кислород-оксидоредуктаза - В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, всего содержит 6 полипептидных цепей. В комплексе также имеется 2 иона меди. Функция: Принимает электроны от цитохрома с и передает их на кислород с образованием воды; Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 27. Пути синтеза АТФ. Субстратное фосфорилирование (примеры). Молекулярные механизмы окислительного фосфорилирования (теория Митчелла). Разобщение окисления и фосфорилирования. На основании строения и функций компонентов дыхательной цепи предложен механизм окислительного фосфорилирования: 1. Ферменты дыхательной цепи расположены в строго определенной последовательности: каждый последующий белок обладает большим сродством к электронам, чем предыдущий (он более электроположителен, т.е. обладает более положительным окислительно-восстановительным потенциалом). Это обеспечивает однонаправленное движение электронов. 2. Все атомы водорода, отщепленные дегидрогеназами от субстратов в аэробных условиях, достигают внутренней мембраны митохондрий в составе НАДН или ФАДН2. 3. Здесь атомы водорода (от НАДН и ФАДН2) передают свои электроны в дыхательную ферментативную цепь, по которой электроны движутся (50-200 шт/сек) к своему конечному акцептору – кислороду. В результате образуется вода. 4. Поступающие в дыхательную цепь электроны богаты свободной энергией. По мере их продвижения по цепи они теряют энергию. 5. Перенос ионов водорода через мембрану (выкачивание) происходит не случайно, а встрого определенных участках мембраны. Эти участки называются участки сопряжения(или, не совсем точно, пункты фосфорилирования). Они представлены I, III, IV комплексами дыхательных ферментов. В результате работы этих комплексов формируется градиент ионов водорода между внутренней и наружной поверхностями внутренней митохондриальной мембраны. Такой градиент обладает потенциальной энергией. 6. Как завершение всех предыдущих событий и необходимый их результат происходит наработка АТФ: ионы H+ теряют свою энергию, проходя через АТФ-синтазу (Н+-транспортирующая АТФ-аза, КФ 3.6.3.14.). Часть этой энергии тратится на синтез АТФ. Другая часть рассеивается в виде тепла. Разобщители окисления и фосфорилирования Поскольку при окислительном фосфорилировании не вся энергия субстратов тратится на совершение работы, а существенная часть рассеивается в виде тепла, то особые клетки организма умеют изменять это соотношение с целью наработки тепла.Такими клетками являются клетки бурой жировой ткани. В отличие от белой жировой ткани бурые жировые клетки содержат большое количество митохондрий, которые и придают клеткам буро-красный цвет. Во внутренней мембране митохондрий этих клеток имеется белок термогенин (до 15% от всех белков митохондрий). При охлаждении организма бурые адипоциты получают сигналы по симпатическим нервам, и в них активируется расщепление жира – липолиз. Окисление жиров приводит к получению большого количества НАДН и ФАДН2, активизации работы дыхательной цепи и возрастанию электрохимического градиента. Однако АТФ-синтазы в мембранах митохондрий этих клетокмало, зато много термогенина. Термогенин является "каналом" в внутренней мембране через который снаружи внутрь проходит основная часть ионов Н+ и снижается протонный градиент. Но АТФ при этом не синтезируется, несмотря на непрерывно возрастающий (по закону дыхательного контроля) катаболизм. Благодаря термогенину большая часть энергии ионов водорода рассеивается в виде тепла, подогревая протекающую через ткань кровь и обеспечивая поддержание температуры тела при охлаждении. Вещества, которые снижают величину электрохимического градиента, приводя к увеличению скорости движения электронов по ферментам дыхательной цепи, уменьшению синтеза АТФ и возрастанию катаболизма называются разобщители. Они разобщают (разъединяют) процессы окисления и фосфорилирования внутренней мембраны митохондрий. К разобщителям в первую очередь относят "протонофоры" – вещества переносящие ионы водорода. При этом одновременно уменьшаются оба компонента электрохимического градиента – электрический и химический, и энергия градиента рассеивается в виде тепла. Следствием эффекта протонофоров является возрастание катаболизма жиров и углеводов в клетке и во всем организме. Классическим протонофором является динитрофенол, жирорастворимое соединение, присоединяющие ионы водорода на внешней поверхности внутренней митохондриальной мембраны и отдающие их на внутренней поверхности. Белок термогенин является физиологическим протонофором. Переаминирование и декарбоксилирование аминокислот. Химизм процессов, характеристика ферментов и коферментов. Образование амидов. Механизм реакции трансаминирования (переаминирования) непрост и протекает по типу "пинг-понг". Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6).В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию.
Чаще всего аминокислоты взаимодействуют со следующими кетокислотами:пировиноградной с образованием аланина; щавелевоуксусной с образованием аспартата; α-кетоглутаровой с образованием глутамата. Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты. Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование. Аммиак непрерывно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов – нервная тк
|
|||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 773; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.234.56 (0.023 с.) |

 Подклассы:
Подклассы: Лиазы – ферменты, катализирующие разрыв С-О, С-С, C-N и других связей, а также обратимые реакции отщепления различных групп негидролитическим путем. Выделяют 7 подклассов. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи. Лиазы являются сложными ферментами. Коферментами служат пиридоксальфосфат, тиаминдифосфат, участвует магний, кобальт.
Лиазы – ферменты, катализирующие разрыв С-О, С-С, C-N и других связей, а также обратимые реакции отщепления различных групп негидролитическим путем. Выделяют 7 подклассов. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи. Лиазы являются сложными ферментами. Коферментами служат пиридоксальфосфат, тиаминдифосфат, участвует магний, кобальт.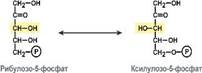 Изомеразы – ферменты, катализирующие изомерные превращения в пределах одной молекулы. Изомеразы – сложные ферменты. К их коферментам относятсяпиридоксальфосфат, дезоксиаденозилкобаламин, глутатион, фосфаты моносахаридов(глюкозо-1,6-дифосфат) и др.Выделяют 6 подклассов изомераз в зависимости от типа реакции. Например, в первый подкласс выделяют рацемазы (обратимое превращение L- и D-стереоизомеров) эпимеразы (превращения изомеров, имеющих более одного центра асимметрии, например, α-D-глюкозу в β-D-глюкозу).Если рассматривать весь класс целиком, то изомеразы делятся по типу изомеризации на: рацемазы и эпимеразы. Рацемазы отвечают за взаимопревращения L- и D-изомеров, S- и R-изомеров. Эпимеразы изменяют конфигурацию при одном из хиральных атомов углерода, например: взаимопревращение α- и β-изомеров, превращения рибулоза↔ксилулоза, галактоза↔глюкоза, манноза↔галактоза.
Изомеразы – ферменты, катализирующие изомерные превращения в пределах одной молекулы. Изомеразы – сложные ферменты. К их коферментам относятсяпиридоксальфосфат, дезоксиаденозилкобаламин, глутатион, фосфаты моносахаридов(глюкозо-1,6-дифосфат) и др.Выделяют 6 подклассов изомераз в зависимости от типа реакции. Например, в первый подкласс выделяют рацемазы (обратимое превращение L- и D-стереоизомеров) эпимеразы (превращения изомеров, имеющих более одного центра асимметрии, например, α-D-глюкозу в β-D-глюкозу).Если рассматривать весь класс целиком, то изомеразы делятся по типу изомеризации на: рацемазы и эпимеразы. Рацемазы отвечают за взаимопревращения L- и D-изомеров, S- и R-изомеров. Эпимеразы изменяют конфигурацию при одном из хиральных атомов углерода, например: взаимопревращение α- и β-изомеров, превращения рибулоза↔ксилулоза, галактоза↔глюкоза, манноза↔галактоза.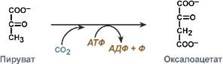 Лигазы (синтетазы) – ферменты, катализирующие присоединение друг к другу двух молекул с использованием энергии высокоэнергетических связей АТФ (или других макроэргов). Лигазы – сложные ферменты. Они содержат нуклеотидные (УТФ), биотиновые (витамин Н),фолиевые коферменты. Выделяют 6 подклассов.
Лигазы (синтетазы) – ферменты, катализирующие присоединение друг к другу двух молекул с использованием энергии высокоэнергетических связей АТФ (или других макроэргов). Лигазы – сложные ферменты. Они содержат нуклеотидные (УТФ), биотиновые (витамин Н),фолиевые коферменты. Выделяют 6 подклассов. Весь перенос аминогруппы совершается в две стадии:к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат. На второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфатрегенерирует.
Весь перенос аминогруппы совершается в две стадии:к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат. На второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфатрегенерирует. Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота.
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота.


