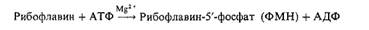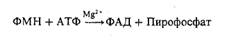Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Связи, участвующие в формировании третичной структуры белковСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Вторичная структура белков Вторичная структура белков - пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов:?-спираль и?-структура. ?- Спираль В данном типе структуры пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали (рис. 1-5). На один виток?-спирали приходится 3,6 аминокислотных остатка. В образовании водородных связей участвуют практически все атомы кислорода и водорода пептидных групп. В результате?-спираль "стягивается" множеством водородных связей. Несмотря на то, что данные связи относят к разряду слабых, их количество обеспечивает максимально возможную стабильность?-спирали. Так как все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность (т.е. способность образовывать водородные связи с водой)?-спиралей уменьшается, а их гидрофобность увеличивается. ?-Спиральная структура - наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии. В результате образования?-спиралей полипептидная цепь укорачивается, но если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится. Когда водородные связи образуются между атомами пептидного остова различных полипептидных цепей, их называют межцепочечными связями. Водородные связи, возникающие между линейными участками внутри одной полипептидной цепи, называют внутрицепочечными. В?-структурах водородные связи расположены перпендикулярно полипептидной цепи. 2. Третичная структура белков Третичная структура белков - трёхмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи. Суммарный заряд белков Белки имеют в своём составе радикалы лизина, аргинина, гистидина, глутаминовой и аспарагиновой кислот, содержащие функциональные группы, способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α-амино- и α-карбоксильная группы, также способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apr и Гис. Степень ионизации функциональных групп этих радикалов зависит от рН среды. При рН раствора около 7 все ионогенные группы белка находятся в ионизированном состоянии. В кислой среде увеличение концентрации протонов (Н+) приводит к подавлению диссоциации карбоксильных групп и уменьшению отрицательного заряда белков: -СОО- + Н+ → -СООН. В щелочной среде связывание избытка ОН" с протонами, образующимися при диссоциации NH3+с образованием воды, приводит к уменьшению положительного заряда белков: -NH3+ +ОН- → -NH2 + H2O. Значение рН, при котором белок приобретает суммарный нулевой заряд, называют "изоэлектрическая точка" и обозначают как pI. В изоэлектрической точке количество положительно и отрицательно заряженных групп белка одинаково, т.е. белок находится в изоэлектрическом состоянии. Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО-), то изоэлектрическая точка этих белков лежит в слабокислой среде. Изоэлектрическая точка белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, - гистоны, входящие в состав хроматина. Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем белки, находящиеся в изоэлектрической точке. Суммарный заряд увеличивает количество диполей воды, способных связываться с белковой молекулой, и препятствует контакту одноимённо заряженных молекул, в результате растворимость белков увеличивается. Заряженные белки могут двигаться в электрическом поле: анионные белки, имеющие отрицательный заряд, будут двигаться к положительно заряженному аноду (+), а катионные белки - к отрицательно заряженному катоду (-). Белки, находящиеся в изоэлектрическом состоянии, не перемещаются в электрическом поле. 4. Соотношение полярных и неполярных На поверхности большинства внутриклеточных белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Так, протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде. 5. Растворимость белков Растворимость белков в воде зависит от всех перечисленных выше свойств белков: формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать вьшадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.
Методы выделения и очистки белков Получение индивидуальных белков из биологического материала (тканей, органов, клеточных культур) требует проведения последовательных операций, включающих:
1. Методы разрушения тканей Для разрушения биологического материала используют методы: гомогенизации ткани, метод попеременного замораживания и оттаивания, а также обработку клеток ультразвуком. Гомогенизация биологического материала Ткань, находящуюся в буферном растворе с определённым значением рН и концентрацией солей, помещают в стеклянный сосуд (гомогенизатор) с пестиком. Вращающийся пестик измельчает и растирает ткань о притёртые стенки сосуда. Метод замораживания и оттаивания ткани В результате попеременного замораживания и оттаивания образующиеся кристаллы льда разрушают оболочки клеток. После разрушения ткани нерастворимые части осаждают центрифугированием. Последующее центрифугирование гомогената с разной скоростью позволяет получить отдельные фракции, содержащие клеточные ядра, митохондрии и другие органеллы, а также надосадочную жидкость, в которой находятся растворимые белки цитозоля клетки. Искомый белок будет содержаться в одной из этих фракций. Экстракция белков, связанных с мембранами, и разрушение олигомерных белков на протомеры Если искомый белок прочно связан с какими-либо структурами клетки, его необходимо перевести в раствор. Так, для разрушения гидрофобных взаимодействий между белками и липидами мембран в раствор добавляют детергенты; чаще всего используют тритон Х-100 или додецилсульфат натрия. Механизм действия детергентов описан в разделе "Денатурация белков" (см. рис. 1-15). При действии детергентов обычно разрушаются и гидрофобные взаимодействия между протомерами в олигомерных белках. Денатурация белков Разрыв большого количества слабых связей в молекуле белка приводит к разрушению её на-тивной конформации. Так как разрыв связей под действием различных факторов носит случайный характер, то молекулы одного индивидуального белка приобретают в растворе форму случайно сформировавшихся беспорядочных клубков, отличающихся друг от друга трёхмерной структурой. Потеря нативной конформации сопровождается утратой специфической функции белков. Этот процесс носит название денатурации белков. При денатурации белков не происходит разрыва пептидных связей, т.е. первичная структура белка не нарушается. В денатурированном белке гидрофобные радикалы, которые в нативной структуре молекулы спрятаны внутри гидрофобного ядра, оказываются на поверхности. При достаточно высокой концентрации белка и отсутствии сильного отталкивающего заряда молекулы могут объединяться друг с другом гидрофобными взаимодействиями, при этом растворимость белка снижается и происходит образование осадка. Компактная, плотная пространственная структура нативного белка при денатурации резко увеличивается в размерах и становится легко доступной для расщепления пептидных связей протеолитическими ферментами (рис. 1-14). Термическая обработка мясной пищи перед употреблением не только улучшает её вкусовые качества, но и облегчает её ферментативное переваривание в пищеварительной системе. Кроме того, денатурирующим действием на пищевые белки обладает и кислая среда желудка, вызывающая денатурацию тех белков, которые не подвергались предварительной температурной обработке, а также оказывает денатурирующее действие на белки микроорганизмов, попавших в желудок с пищей. В медицине денатурирующие агенты часто используют для стерилизации медицинских инструментов и материала, а также в качестве антисептиков. Например, в автоклавах при высокой температуре стерилизуют медицинские инструменты и материалы. Фенол и его производные (крезол, резорцин) относят к известным антисептикам ароматического ряда. Обладающие высокой гидрофобностью, они эффективно действуют на вегетативные формы бактерий и грибы, вызывая денатурацию их белков. Эффективность антисептических свойств уменьшается с увеличением растворимости препарата в воде. Раствор крезола в калийном мыле известен как препарат лизол, применяемый в качестве дезинфицирующего средства. Берёзовый дёготь - одна из основных составных частей мази Вишневского, содержит в своем составе фенол. Препарат, используемый для лечения ран, обладает высоким антимикробным действием. Значительное количество антисептиков представлено солями тяжёлых металлов. Их антимикробное действие связано с тем, что уже в довольно низких концентрациях они взаимодействуют с белками микроорганизмов, блокируют их SH-группы и изменяют их конформа-цию. Из-за высокой токсичности большинство лекарств, содержащих соли тяжёлых металлов, применяют в качестве поверхностных антисептиков. Так, высокой антимикробной активностью обладает сулема - дихлорид ртути (HgCl2). Её используют для обработки рук и дезинфекции помещений. Случайное или преднамеренное отравление препаратами ртути вызывает тяжёлые некротические поражения слизистой оболочки пищеварительного тракта и некротические изменения в почках. Антимикробными свойствами обладают и препараты серебра, такие как ляпис (AgNO3), колларгол (серебро коллоидальное), применяемые для обработки слизистых оболочек при инфекционных заболеваниях. Шаперо́ны (англ. chaperones) — класс белков, главная функция которых состоит в восстановлении правильной третичной структуры повреждённых белков, а также образование и диссоциация белковых комплексов. Многие шапероны являются белками теплового шока, то есть белками, экспрессия которых начинается в ответ на рост температуры или другие клеточные стрессы.
3. Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от bqcx остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций. Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют "лиганд". Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандом высокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром. Активный центр белков -определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга. Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда. Активный центр белка - относительно изолированный от окружающей белок среды участок, сформированный аминокислотными остатками. В этом участке каждый остаток благодаря своему индивидуальному размеру и функциональным группам формирует "рельеф" активного центра. Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности. Основное свойство белков, лежащее в основе их функций, - избирательность присоединения к определённым участкам белковой молекулы специфических лигандов.
Скорость взаимодействия белка с лигандом определяется концентрациями белка и лиганда в растворе, а также степенью комплементарности белка и лиганда. Константа диссоциации -характеристика сродства активного центра лиганду. лекарственные препараты Передача сигнала от нерва к нерву или от нерва к эффекторному органу осуществляется через синапсы с помощью химических молекул, называемых нейромедиаторами. Нейромедиатор, выделяемый при прохождении импульса нервными окончаниями, должен высокоспецифично взаимодействовать с белками-рецепторами на постсинаптической мембране. Однако, модифицируя химическую структуру нейромедиатора, можно получить вещества, которые также связывались бы с рецептором, но при этом менялся физиологический эффект: уменьшался или усиливался. В фармакологии такие вещества называют "антагонисты" и "агонисты" соответственно. Наиболее известный специфический ингибитор М-холинорецепторов - атропин. Атропин - алкалоид, содержащийся в некоторых растениях: красавке, белене, дурмане. Он присоединяется к М-холинорецепторам, находящимся на мембране эффекторных клеток, в области окончаний парасимпатических нервов. Атропин препятствует их взаимодействию с ацетилхолином (антагонист природного лиганда), тем самым устраняя эффекты раздражения парасимпатических нервов. Так как ацетилхолин, связываясь с М-холи-норецепторами, вызывает сокращение многих гладких мышц, атропин (как лекарственный препарат) снимает мышечные спазмы (спазмолитик). Кроме того, он снижает стимулируемую ацетилхолином секрецию желёз (бронхиальных, пищеварительных, потовых). Некоторые яды, попадая в организм человека, прочно связываются с определёнными белками, ингибируют их и тем самым вызывают нарушения биологических функций. Например,?-нейротоксины кобры и крайта специфически взаимодействуют с холинергическими рецепторами постсинаптических мембран, блокируя их работу, и оказывают курареподобное действие.?-Нейротоксины - небольшие белки с молекулярной массой около 7000 Д.
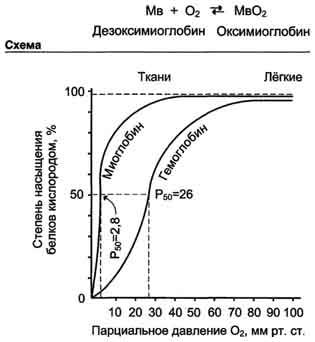
4. Олигомерные белки проявляют свойства, отсутствующие у мономерных белков. Влияние четвертичной структуры на функциональные свойства белка можно рассмотреть, сравнивая строение и функции двух родственных гемсодержащих белков: миоглобина и гемоглобина. Оба белка имеют общее эволюционное происхождение, сходную конформацию отдельных полипептидных цепей и сходную функцию (участвуют в транспорте кислорода), но миоглобин - мономерный белок, а гемоглобин - тетрамер. Наличие четвертичной структуры у гемоглобина придаёт этому белку свойства, отсутствующие у миоглобина. Гемоглобины - родственные белки, находящиеся в эритроцитах человека и позвоночных животных. Эти белки выполняют 2 важные функции:
Кровь ежедневно должна переносить из лёгких в ткани около 600 л,О2. Так как О2 плохо растворим в воде, то практически весь кислород в крови связан с гемоглобином эритроцитов. От способности гемоглобина насыщаться О2 в лёгких и относительно легко отдавать его в капиллярах тканей зависят количество получаемого тканями О2 и интенсивность метаболизма Гемоглобины, так же как миоглобин, относят к гемопротеинам, но они имеют четвертичную структуру (состоят из 4 полипептидных цепей), благодаря которой возникает возможность регуляции их функций. Конформация отдельных протомеров гемоглобина удивительно напоминает конформацию миоглобина, несмотря на то, что в первичной структуре их полипептидных цепей идентичны только 24 аминокислотных остатка. Протомеры гемоглобина, так же как и апомиоглобин, состоят из 8 спиралей, свёрнутых в плотную глобулярную структуру, содержащую внутреннее гидрофобное ядро и "карман" для связывания гема. Соединение гема с глобином (белковой частью) аналогично таковому у миоглобина - гидрофобное окружение гема, за исключением 2 остатков Гис Е7 и Гис F8 (рис. 1-31). Однако тетрамерная структура гемоглобина представляет собой более сложный структурно-функциональный комплекс, чем миоглобин. Гем имеет высокое сродство к оксиду углерода (СО). Четвертичная структура гемоглобина Четыре полипептидные цепи, соединённые вместе, образуют почти правильную форму шара, где каждая?-цепь контактирует с двумя?-цепями (рис. 1-32). Так как в области контакта между?1- и?1-, а также между?2- и?2-цепями находится много гидрофобных радикалов, то между этими полипептидными цепями формируется сильное соединение за счёт возникновения в первую очередь гидрофобных, а также ионных и водородных связей. В результате образуются димеры?1?1, и?2?2. Между этими димерами в тетрамерной молекуле гемоглобина возникают в основном полярные (ионные и водородные) связи, поэтому при изменении рН среды в кислую или щелочную сторону в первую очередь разрушаются связи между димерами. Кроме того, димеры способны легко перемещаться относительно друг друга. Так как поверхность протомеров неровная, полипептидные цепи в центральной области не могут плотно прилегать друг к другу, в результате в центре формируется "центральная полость", проходящая сквозь всю молекулу гемоглобина. Кривая диссоциации О2 для миоглобина имеет вид простой гиперболы. Это указывает на то, что миоглобин обратимо связывается с лигандом, и на это не оказывают влияние никакие посторонние факторы
Окисление органических веществ с целью получения энергии происходит в митохондриях клеток с использованием О2, доставляемого гемоглобином из лёгких. В результате окисления веществ образуются конечные продукты распада - СО2 и Н2О, количество которых пропорционально интенсивности процессов окисления. СО2, образовавшийся в тканях, транспортируется в эритроциты. Там под действием фермента карбангидразы происходит увеличение скорости образования Н2СО3. Слабая угольная кислота может диссоциировать на Н+ и НСО3- СО2 + Н2О - H2CO 3 - H+ + HCO3-. Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух?-цепей, радикалам Гис122 и концевым?-аминогруппам двух?-цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот). Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нём (рис. 1-36, А). Увеличение освобождения О2 гемоглобином в зависимости от концентрации Н+ называют эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект). Таким образом, олигомерный белок гемоглобин, в отличие от мономерного родственного белка миоглобина, способен присоединять к специфическим участкам 4 различных лиган-да: О2, Н+, СО2 и БФГ. Все эти лиганды присоединяются к пространственно разобщённым участкам, но конформационные изменения белка в месте присоединения одного лиганда передаются на весь олигомерный белок и изменяют сродство к нему других лигандов. Так, количество поступающего в ткани О2 зависит не только от парциального давления О2, но и концентрации аллостерических лигандов, что увеличивает возможность регуляции функций гемоглобина. Как мы уже рассматривали выше, в капиллярах работающей мышцы увеличение концентрации СО2 и Н+ уменьшает сродство гемоглобина к О2 и увеличивает отдачу его в ткани. При длительной гипоксии усиливается синтез 2,3-БФГ в эритроцитах, что также снижает сродство гемоглобина к О2 и при том же парциальном давлении О2 увеличивает его транспорт в ткани. Следовательно, благодаря воздействию регуляторных лигандов олигомерные белки способны приспосабливать свою конформацию и фунцию к изменениям, происходящим в окружающей среде. 5. В организме человека содержится свыше 50 000 индивидуальных белков, отличающихся первичной структурой, конформацией, строением активного центра и функциями. Белки построены из 20 химически различных аминокислот, каждая из которых может занимать любое положение в полипептидной цепи. Кроме того, белки различаются количеством аминокислот, из которых они построены. До настоящего времен нет единой и стройной классификации, учитывающей различные параметры белков. В основе имеющихся классификаций обычно лежит один признак. Так, белки можно классифицировать:
. Классификация белков по форме молекул Это одна из самых старых классификаций, которая делит белки на 2 группы: глобулярные и фибриллярные. К глобулярным относят белки, соотношение продольной и поперечной осей которых не превышает 1:10, а чаще составляет 1:3 или 1:4, т.е. белковая молекула имеет форму эллипса. Большинство индивидуальных белков человека относят к глобулярным белкам. Они имеют компактную структуру и многие из них, за счёт удаления гидрофобных радикалов внутрь молекулы, хорошо растворимы в воде. Наглядные примеры строения и функционирования глобулярных белков - рассмотренные выше миоглобин и гемоглобины. Фибриллярные белки имеют вытянутую, нитевидную структуру, в которой соотношение продольной и поперечной осей составляет более 1:10. К фибриллярным белкам относят коллагены, эластин, кератин, выполняющие в организме человека структурную функцию, а также миозин, участвующий в мышечном сокращении, и фибрин - белок свёртывающей системы крови. На примере коллагенов и эластина рассмотрим особенности строения этих белков и связь их строения с функцией. Витамин В2 (Рибофлавин) В основе молекулы рибофлавина лежит гетероциклическое соединение — изоаллоксазин (сочетание бензольного, пиразинового и пиримидинового колец), к которому в положении 9 присоединен пятиатомный спирт рибитол. Химическое название «рибофлавин» отражает наличие рибитола и желтой окраски препарата; рациональное название его 6,7-диметил-9-В-ри6итилизоаллоксазин:
Рибофлавин входит в состав флавиновых коферментов, в частности ФМН и ФАД1, являющихся в свою очередь простетическими группами ферментов-флавопротеинов. Различают два типа химических реакций, катализируемых этими ферментами. К первому относятся реакции, в которых фермент осуществляет прямое окисление с участием кислорода, т. е. дегидрирование (отщепление электронов и протонов) исходного субстрата или промежуточного метаболита. К ферментам этой группы относятся оксидазы L- и D-аминокислот, глициноксидаза, альдегидоксидаза, ксантиноксидаза и др. Вторая группа реакций, катализируемых флавопротеинами, характеризуется переносом электронов и протонов не от исходного субстрата, а от восстановленных пиридиновых коферментов. Ферменты этой группы играют главную роль в биологическом окислении. В каталитическом цикле изоаллоксазиновый остаток ФАД и ФМН подвергается обратимому восстановлению с присоединением атомов водорода к N1 и N10. ФМН синтезируется в организме животных из свободного рибофлавина и АТФ при участии специфического фермента - рибофлавинкиназы:
Образование ФАД в тканях также протекает при участии специфического АТФ-зависимого фермента ФМН-аденилилтрансферазы. Исходным веществом для синтеза является ФМН:
Витамин РР (Никотиновая кислота) Никотиновая кислота представляет собой соединение пиридинового ряда, содержащее карбоксильную группу (никотинамид отличается наличием амидной группы). Витамин РР входит в состав НАД и НАДФ, являющихся коферментами большого числа обратимо действующих в окислительно-восстановительных реакциях дегидрогеназ Показано, что ряд дегидрогеназ используют только НАД или НАДФ, другие могут катализировать окислительно-восстановительные реакции в присутствии любого из них. В процессе биологического окисления НАД и НАДФ выполняют роль промежуточных переносчиков электронов и протонов между окисляемым субстратом и флавиновыми ферментами. Вторичная структура белков Вторичная структура белков - пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов:?-спираль и?-структура. ?- Спираль В данном типе структуры пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали (рис. 1-5). На один виток?-спирали приходится 3,6 аминокислотных остатка. В образовании водородных связей участвуют практически все атомы кислорода и водорода пептидных групп. В результате?-спираль "стягивается" множеством водородных связей. Несмотря на то, что данные связи относят к разряду слабых, их количество обеспечивает максимально возможную стабильность?-спирали. Так как все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность (т.е. способность образовывать водородные связи с водой)?-спиралей уменьшается, а их гидрофобность увеличивается. ?-Спиральная структура - наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии. В результате образования?-спиралей полипептидная цепь укорачивается, но если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится. Когда водородные связи образуются между атомами пептидного остова различных полипептидных цепей, их называют межцепочечными связями. Водородные связи, возникающие между линейными участками внутри одной полипептидной цепи, называют внутрицепочечными. В?-структурах водородные связи расположены перпендикулярно полипептидной цепи. 2. Третичная структура белков Третичная структура белков - трёхмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи. Связи, участвующие в формировании третичной структуры белков Гидрофобные взаимодействия При укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом свободной энергии. Поэтому гидрофобные радикалы аминокислот стремятся к объединению внутри глобулярной структуры растворимых в воде белков. Между ними возникают так называемые гидрофобные взаимодействия, а также силы ван дер Ваальса между близко прилегающими друг к другу атомами. В результате внутри белковой глобулы формируется гидрофобное ядро. Гидрофильные группы пептидного остова при формировании вторичной структуры образуют множество водородных связей, благодаря чему исключается связывание с ними воды и разрушение внутренней, плотной структуры белка. Ионные и водородные связи Гидрофильные радикалы аминокислот стремятся образовать водородные связи с водой и поэтому в основном располагаются на поверхности белковой молекулы. Все гидрофильные группы радикалов аминокислот, оказавшиеся внутри гидрофобного ядра, взаимодействуют друг с другом с помощью ионных и водородных связей (рис. 1-11).
Ковалентные связи Третичную структуру некоторых белков стабилизируют дисульфидные связи, образующиеся за счёт взаимодействия SH-групп двух остатков цистеина. Эти два остатка цистеина могут находиться далеко друг от друга в линейной первичной структуре белка, но при формировании третичной структуры они сближаются и образуют прочное ковалентное связывание радикалов. Четвертичная структура белков Многие белки содержат в своём составе только одну полипептидную цепь. Такие белки называют мономерами. К мономерным относят и белки, состоящие из нескольких цепей, но соединённых ковалентно, например дисульфидными связями (поэтому инсулин следует рассматривать как мономерный белок). В то же время существуют белки, состоящие из двух и более полипептидных цепей. После формирования трёхмерной структуры каждой полипептидной цепи они объединяются с помощью тех же слабых взаимодействий, которые участвовали в образовании третичной структуры: гидрофобных, ионных, водородных. Количество и взаиморасположение полипептидных цепей в пространстве называют "четвертичная структура белков". Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным.
Все белки с одинаковой первичной структурой, находящиеся в одинаковых условиях, приобретают одинаковую, характерную для данного индивидуального белка конформацию, определяющую его специфическую функцию. Функционально активную конформацию белка называют "нативная структура". При различных заболеваниях происходит изменение белкового состава тканей. Эти изменения называются протеинопатиями. Различают наследственные и приобретённые протеинопатии. Наследственные протеинопатии развиваются в результате повреждений в генетическом аппарате данного индивидуума. Какой-либо белок не синтезируется вовсе или синтезируется, но его первичная структура изменена. Примеры наследственных протеинопатии - гемоглобинопатии, рассмотренные выше. В зависимости от роли дефектного белка в жизнедеятельности организма, от степени нарушения конформации и функции белков, от гомо- или гетерозиготности индивидуума по этому белку наследственные протеинопатии могут вызывать болезни, протекающие с различной степенью тяжести, вплоть до летального исхода ещё до рождения или в первые месяцы после рождения. полиморфизм белков — существование разных форм белка, выполняющих одинаковые или очень сходные функции (изобелки). Чаще всего изучают полиморфизм ферментов (т. е. наличие изофер-ментов), поскольку их гораздо легче обнаружить, чем другие белки, по катализируемой ими реакции.
2. Физико-химические свойства белков Индивидуальные белки различаются по свои
|
||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 1001; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.42.61 (0.02 с.) |