Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биологические функции белковСодержание книги
Поиск на нашем сайте Биохимия Лекции 2 курс 2013-2014 уч.год Трубицына Виктория Владимировна, 03011208 ТЕМА 1. 3 ВВЕДЕНИЕ В БИОХИМИЮ. БЕЛКИ.. 3 ТЕМА 2. 6 ФЕРМЕНТЫ.. 6 ТЕМА 3. 16 СТРОЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ. 16 ТЕМА 4. 17 МАТРИЧНЫЕ БИОСИНТЕЗЫ.. 17 ТЕМА 5. 25 ЭНЕРГЕТИЧЕСКИЙ ОБМЕН. ОБЩИЙ ПУТЬ КАТАБОЛИЗМА. 25 СИНТЕЗ АТФ. 25 ТЕМА 6. 33 ОБМЕН ВЕЩЕСТВ: ОБМЕН УГЛЕВОДОВ.. 33 ТЕМА 7. 44 ОБМЕН ВЕЩЕСТВ: ОБМЕН ЛИПИДОВ.. 44 ТЕМА 8. 57 ОБМЕН ВЕЩЕСТВ: ОБМЕН БЕЛКОВ.. 57 ТЕМА 9. 62 РЕГУЛЯЦИЯ ОБМЕНА ВЕЩЕСТВ: ГОРМОНЫ. 62 ТЕМА 10. 81 ПЕЧЕНЬ. 81 ТЕМА 11. 87 ГЕМОСТАЗ. 87 ТЕМА 12. 95 СОЕДИНИТЕЛЬНАЯ ТКАНЬ. 95
ТЕМА 1 ВВЕДЕНИЕ В БИОХИМИЮ. БЕЛКИ
Биохимия – это наука о молекулярных основах жизни. · Статическая – химические формулы строения веществ · Динамическая – последовательность реакций и процессов · Функциональная – биохимия тканей и органов.
Белки – это биополимеры, состоящие из α-аминокислотных остатков, которые соединены между собой пептидной связью. · Пептиды – цепочка до 10 аминокислотных остатков · Полипептиды – более 10 аминокислотных остатков · Протеины = белки – от 6 000 аминокислотных остатков
Строение белковой молекулы
Начинается со свободной аминогруппы (N-конец), завершается свободной карбоксильной группой (С – конец).
Наличие С = С придает пептидной связи планарный характер, т. е. вращение между N и О затруднено, что делает первичную структуру белков более жесткой.
NB!: Первичная структура белка имеет важное значение для индивидуальных (нативных) свойств пептида, полипептида и белков, Т. Е. последовательность аминокислот в любом белке строго специфична и детерминирована генами. Такая последовательность аминокислот формирует уникальную для каждого белка вторичную, третичную и четвертичную структуру. К первичной структуре можно отнести дисульфидные мостики, образованные остатками цистеина. – S – S – Следовательно, первичная структура стабилизируется ковалентными связями между аминокислотными остатками. Вторичная структура 1) α – спираль– поддерживается водородными связями между пептидными связями (рис.1) Водородные связи играют роль во взаимодействии между молекулами Н2О, поддержании структуры белков, нуклеиновых кислот. Они всегда возникают между электроотрицательным атомом (N или О) и Н, который связан ковалентной связью с электроотрицательным атомом. 2) β –складчатая структура – параллельно идущие полипептидные цепи, которые связаны водородными связями (рис. 2).
3) Смешанная вторичная структура – чередование α –спирали и β –складчатой структуры. 4) * Вторичная структура молекулы коллагена В основе - стерическое взаимодействие между кольцами остатков пролина (водородных связей в первичной структуре нет). Отличие тройной спирали предшественника коллагена состоит в том, что водородные связи образованы гидроксигруппами остатков гидроксипролина.
Третичная - специфичная для каждого белка пространственная упаковка молекулы. Имеющие гидрофобный характер радикалы аминокислотных остатков ориентированы внутрь молекулы, а гидрофильные (О+, NН3+, СОО-) – на поверхности молекулы. Структуру поддерживают гидрофобные взаимодействия межу углеводородными радикалами аминокислот. Находящиеся на поверхности функциональные группы могут давать сложноэфирные связи, водно-солевые мостики и т. д. Эти функциональные группы способствуют связыванию молекул воды и образованию гидратной оболочки. Каждый белок имеет собственную третичную структуру. Небольшое изменение ее может привести к потере физиологических функций белка.
Четвертичная – нежесткое соединение отдельных третичных образований, которые называются субъединицами. Поддерживается водородными связями. Классический пример – гемоглобин, состоит из 4 субъединиц.
В организме обнаружены более сложные структурные образования (некоторые ферментные комплексы, которые состоят из нескольких связанных четвертичных образований – пируватдекарбоксилазный комплекс).
Сложные белки · Гликопротеины · Нуклеопротеины · Липопротеины · Хромопротеины · Металлопротеины · Фосфопротеины
ТЕМА 2 ФЕРМЕНТЫ Ферменты (Е) – биологически активные вещества, ускоряющие химические реакции в организме (в 1000 раз) за счет снижения энергии активации веществ. Энергия активации – энергия, которую необходимо придать веществу, чтобы оно вступило в реакцию. Все ферменты взаимодействуют с субстратами (S). Субстраты – любые вещества, которые при взаимодействии с ферментами претерпевают химические превращения и превращаются в продукт (Р).
Количество ферментов в ходе реакции не изменяется.
Свойства ферментов (отличие от неорганических катализаторов) 1) Превращают один субстрат 2) Все ферменты – белки, которые функционируют в третичной структуре
- схематичное изображение ферментов (третичная структура) 3) В ходе реакции не расходуются 4) Термолабильны (активность зависит от температуры) 5) Активность ферментов может регулироваться. Ингибиторы – вещества, подавляющие активность ферментов. Активаторы – вещества, повышающие активность ферментов. 6) Специфичность действия · Абсолютная специфичность – фермент превращает только один субстрат · Групповая – фермент превращает похожие субстраты (пепсин действует на многие белки) · Стереоспецифичность – превращает только один изомер · Специфичность путей превращения – один субстрат превращают в несколько ферментов
Строение ферментов 1) Активный центр (АЦ) 2) Аллостерический центр (АлЦ) 3) Кофакторы
1 – АЦ имеют все ферменты Активный центр – небольшой участок фермента, который образован радикалами аминокислотных остатков, которые на уровне третичной структуры формируют центр взаимодействия с субстратом (центр, комплементарный субстрату). Комплементарность – геометрическое (пространственное) и электростатическое (по заряду) соответствие между активным центром и субстратом. Радикалы аминокислот, которые участвуют в образовании активного центра, могут находиться на расстоянии друг от друга в полипептидной цепи, но при формировании активного центра они сближаются.
Активный центр состоит из двух участков: · Якорный – в который прикрепляется субстрат · Каталитический – для химического превращения субстрата. В момент взаимодействия активного центра и субстрата между ними возникают слабые нековалентные связи.
2 - АлЦ – (есть не у всех ферментов) = регуляторный центр, т.к. к нему могут присоединяться активаторы и ингибиторы и регулировать активность ферментов. АлЦ и АЦ должны быть пространственно разделены: АЦ в одной субъединице, АлЦ - в другой. Следовательно, аллостерические ферменты – олигомерные белки (четвертичная структура)
Субъединица с АлЦ – регуляторная. Субъединица с АЦ – каталитическая.
NB!: Аллостерические ферменты катализируют ключевые реакции метаболических путей.
3 – Кофакторы – вещества небелковой природы, необходимые для проявления активности ферментов (есть не у всех ферментов) · Ионы металлов · Коферменты
А) Ионы металлов: · Прочно связываются с ферментом, участвуют в формировании АЦ → металлоферменты (алкогольдегидрогеназы - Zn) · Непрочно связаны с ферментом, не участвуют в образовании АЦ. Но в присутствии металлов активность ферментов повышается → ферменты, активируемые металлами (α-амилаза слюны – Са2+).
Б) Коферменты · Производные витаминов · Участвуют в ферментативных реакциях · Переносят различные группы · В ходе ферментативных реакций претерпевают изменения, противоположные изменениям в субстрате.
Если в реакции субстрат будет окисляться (т.е. от него отщепляется 2Н), то кофермент будет восстанавливаться.
-
Механизм действия ферментов Описывается уравнением ферментативного катализа E+S ↔ ES → ES* → EP → E+P 1) E+S – фермент подходит к своему субстрату, который ориентируется к АЦ определенным образом, … 2) ES – … взаимодействует с АЦ фермента, образуя фермент-субстратный комплекс (нестабильный), который может распадаться на фермент и субстрат. 3) ES* – происходит образование стабильного фермент-субстратного комплекса, перераспределение связей в субстрате … 4) EP – … и он превращается в продукт. 5) E+P – т.к. продукт не комплементарен АЦ, он выходит из него. Количество фермента не меняется.
Существует множество теорий ферментативного катализа. Основные: · Теория Фишера «ключ-замок»: АЦ и субстрат должны быть строго комплементарны до взаимодействия. Соответствие по заряду не учитывается
· Теория Кошланда «Теория индуцированного (вынужденного) соответствия» («рука-перчатка»): АЦ и субстрат геометрически приблизительно похожи до взаимодействия. Строгое соответствие возникает в момент взаимодействия. Электростатическое соответствие учитывается.
Классификация ферментов В основе – тип катализируемой реакции (то, как фермент действует на субстрат). Выделяют 6 классов ферментов: I класс – оксидоредуктазы: осуществляют ОВР, т.е. реакции с участием кислорода, отщеплением или присоединением 2Н с участием коферментов ФАД и НАД+, перемещающих электроны. II класс – трансферазы: осуществляют межмолекулярный перенос групп атомов (кроме 2Н) от одного субстрата к другому.
III класс – гидролазы: расщепляют связи в присутствии воды (ферменты ЖКТ).
IV класс – лиазы: отщепляют карбокси-, аминогруппы, воду (с образованием двойных связей) негидролитически.
V класс – изомеразы: внутримолекулярный перенос групп атомов или превращение изомеров.
VI класс – лигазы = синтетазы: участвуют в процессах синтеза с затратой АТФ и витамина Н (биотина).
АТФ может участвовать в реакциях: ·
· Как донор энергии – лигазы
Название ферментов Название субстрата + тип катализируемой реакции + -аза Например, пируват.декарбоксил.аза, малат.дегидроген.аза
Ингибирование ферментов Ингибиторы – низкомолекулярные вещества, уменьшающие активность ферментов. По степени связывания фермента и ингибитора: 1) Обратимое ингибирование 2) Необратимое ингибирование Обратимое ингибирование – ингибитор непрочно связывается с ферментом (нековалентные связи) и после отделения ингибитора активность фермента восстанавливается. · Конкурентное ·
Конкурентное – ингибитор похож на субстрат. · Субстрат конкурирует с ингибитором за присоединение в АЦ, т. к. они похожи. ·
Неконкурентное – ингибитор не похож на субстрат. · Субстрат не конкурирует с ингибитором за присоединение в АЦ, ингибитор присоединяется в другом (например, аллостерическом). · Тип ингибирования не зависит от концентрации субстрата (рис. 4): т. е. при максимальном увеличении концентрации субстрата скорость реакции в присутствии ингибитора будет меньше (это связано с уменьшение количества ферментов).
Необратимое ингибирование – ингибитор связан с ферментом прочными ковалентными связями и необратимо выводит фермент из реакции. · Специфическое · Неспецифическое
Спецефическое – ингибитор связан со спецефической группой в активном центре (например, с SН-группой серина связываются многие токсические вещества – делициды, зорин и т. п.). Неспецифическое – ингибитор связан с ферментом вне АЦ (тяжелые металлы). Например, аспирин необратимо ингибирует фермент циклооксигеназу, которая образует медиаторы воспаления – простагландины. Следовательно, аспирин является противовоспалительным жаропонижающим средством/ Изоферменты Изоферменты – м ножественные формы фермента, которые катализируют одну и ту же реакцию, но в разных органах.
· Строению · Молекулярной массе · Электрофоретической подвижности Например, ЛДГ (лактатдегидрогеназа) катализирует реакции ПВК ↔ лактат в разных органах. Фермент состоит из 4 субъединиц двух типов:
И существует 5 типов (изоформ) фермента
Методом электрофореза установлено, что ЛДГ 1 и меньше ЛДГ 2 присутствуют в сердечной мышце, в почках. ЛДГ 4 и ЛДГ 5 – в печени и мышцах.
ТЕМА 3 СТРОЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ (самостоятельное изучение)
1. Определение нуклеиновых кислот 2. Строение 3. Строение нуклеотидов, название 4. Отличие нуклеотидов от нуклеозидов 5. Соединение нуклеотидов между собой в полинуклеотидную цепь 6. Вторичная структура ДНК (модель Уотсона-Крика). Правило Чаргаффа 7. Строение и функции мРНК, тРНК, рРНК
Строение тРНК тРНК состовляет 5% от всех РНК
Функции: · Перенос аминокислот к месту синтеза белка · Адаптерная – помогает переводить информацию из последовательности нуклеотидов в последовательность аминокислот. Имеет вторичную структуру в виде клеверного листа, несколько петель (между азотистыми основаниями водородной связи).
На 3’ – конце последовательность ЦЦА – сюда присоединяется аминокислота. Антикодоновая петля – для присоединения с кодоном (3нуклеотида) на мРНК. Псевдоуридиловая петля (ψу) -для присоединения тРНК в А-участке рибосоме. Дигидроуридиловая петля – связывается со специфическим ферментом (аминоацил-тРНК-синтетаза) при активации аминокислоты.
ТЕМА 4 МАТРИЧНЫЕ БИОСИНТЕЗЫ Генетическая информация от материнского организма к дочернему передается благодаря трем матричным биосинтезам: 1) Репликация – биосинтез (удвоение) ДНК 2) Транскрипция – биосинтез всех видов РНК 3) Трансляция – биосинтез белков
РЕПЛИКАЦИЯ Общая характеристика: 1. Матрица – двуцепочечная молекула ДНК. 2. Субстрат (из чего синтезируется продукт) – дНТФ (дезоксирибонуклеозидтрифосфаты): дАТФ, дГТФ, дЦТФ, дТТФ. 3. Продукт – две дочерние ДНК, комплементарные друг другу (но не идентичные). 4. Источник энергии – дНТФ (дезоксирибонуклеозидтрифосфаты): дАТФ, дГТФ, дЦТФ, дТТФ. 5. Ферменты – топоизомераза I,II, ДНК-полимераза, ДНК-лигаза. 6. Локализация в клетке – ядро (S-фаза клеточного цикла).
Стадии: 1) Образование репликативной вилки 2) Синтез дочерних цепей ДНК 3) Удаление праймеров
Основной механизм – полуконсервативный, т.е. двойная спираль раскручивается, цепи расходятся и каждая затем достраивается до двуцепочечной по принципу комплементарности. Каждая новая двуцепочечная молекула ДНК = 1 цепь старой + 1 цепь дочерней ДНК.
1. Образование репликативной вилки Топоизомеразы I (II) находят на двуцепочечной молекуле ДНК определенную последовательность – точку начала репликации. Затем разрывают или одну цепь (топоизомераза I), или обе (топоизомераза II) и встраиваются в них. Происходит разрыв двуцепочечной молекулы с образованием репликативного «глаза» = участок инициации репликации = original. Т.к. молекула ДНК содержит около 150∙106 пар нуклеотидов, а репликация идет со скоростью 50 нуклеотидов/мин, то репликация занимала был 800 часов, а она идет 9. Следовательно, на молекуле ДНК несколько участков начала репликации, и репликация идет в двух направлениях.
Специфический фермент ДНК-геликаза (активность зависит от АТФ) встраивается между цепями и разъединяет их. Вдоль цепи расположены ДНК-раскручивающие белки = ДНК-дестабилизирующие белки = SSB-белки, которые не позволяют цепям ДНК образовать двуцепочную структуру, удерживают их в раскрученном виде, облегчают репликацию.
2.Синтез дочерних цепей.
ДНК-полимеразы: · Осуществляют синтез в направлении 5’→3’ дочерней цепи · Не могут начинать синтез, а могут только достраивать.
Следовательно, для синтеза дочерних цепей необходима «затравка» = праймер. Праймер строится из нуклеотидов, принадлежащих РНК (чтобы отличить его от дочерних цепей). Для этого используется фермент РНК-праймаза. После этого ДНК-полимераза-δ синтезирует дочернюю цепь быстро и непрерывно, т.к. направление синтеза совпадает с направлением репликации. Вторая дочерняя цепь синтезируется медленнее и фрагментами (фрагменты Оказаки), т.к. по принципу антипараллельности ДНК-полимераза достраивала бы в направлении 3’→ 5’, чего не может быть. Если бы мы строили в нужном направлении, то синтез дочерних цепей не совпадал бы с общим направлением репликации. Поэтому отстающая цепь синтезируется фрагментами. Для этого на материнской цепи строится несколько РНК-праймеров (около 200 нуклеотидов). ДНК-полимераза-ε узнает 3’-конец праймера и достраивает его в нужном 5’→3’ направлении до предыдущего праймера. Далее ДНК- полимераза-ε двигается в направлении репликации и находит 3’-конец следующего праймера и достраивает его (фрагменты Оказаки). И так далее.
РНК-аза (эндонуклеаза) вырезает праймеры. ДНК-полимераза-β достраивает недостающие участки. Одноцепочечные разрывы соединяют ДНК-лигазы.
ТРАНСКРИПЦИЯ Общая характеристика: 1. Матрица – одна цепь ДНК. 2. Субстрат (из чего синтезируется продукт) – НТФ (рибонуклеозидтрифосфаты): АТФ, ГТФ, ЦТФ, ТТФ. 3. Продукт –пре-тРНК, пре-мРНК, пре-рРНК. 4. Источник энергии - НТФ (рибонуклеозидтрифосфаты): АТФ, ГТФ, ЦТФ, ТТФ. 5. Ферменты – РНК-полимеразы (I – для рРНК, II – для мРНК, III – для тРНК), белковые факторы инициации, элонгации и терминации.. 6. Локализация в клетке – ядро (не зависит от фазы клеточного цикла). Биосинтез мРНК Этапы: 1) Инициация 2) Элонгация 3) Терминация
Механизм – одна цепь ДНК - матричная цепь, а вторая – кодирующая, которая перписывается в комплементарную ей последовательность нуклеотидов РНК.
1.Инициация На матрице существуют участки – транскриптоны: В начале – промотор (Pro) В конце - сайт терминации В области промотора – гормон-чувствительные участки, которые могут стимулировать транскрипцию (энхансеры) или подавлять ее (сайленсеры).
1 – к Pro присоединяются белковые факторы – ТАТА
2 – это облегчает присоединение к Pro РНК-полимеразы II. РНК-полимеразы II – большие олигомерные белки, которые состоят из 2α, β, β’ и δ субъединиц (δ – регуляторная субъединица). Под действием факторов инициации происходит раскручивание участка одного витка спирали впереди РНК-полимеразы
3 – от РНК-полимеразы II отделяется δ-субъединица и на ее место присоединяется факторы элонгации.
2.Элонгация
3а – после синтеза примерно 30 нуклеотидов РНК происходит кэпирование 5’-конца – присоединение к 5’-концу пре-мРНК метилированного ГТФ (связь 5’– 5’). 4 – когда РНК-полимераза достигает сайта терминации, факторы терминации отщепляют ее от матрицы. Синтезированная пре-мРнК подвергается процессингу (нет у пре-тРНК и пре-рРНК). Функции кэпа: · Инициирование биосинтеза белков · Полиаденилирование - после синтеза пре-мРНК на 3’-конце образуется множество последовательностей –А-А-А- (поли-А).
Функции поли-А: · Облегчает выход РНК в цитоплазму · Защищает РНК в цитоплазме от гидролиза ферментами.
После этого – сплайсинг – вырезание некодирующих участков – интронов, сшивание экзонов. Это осуществляют ферменты мя-РНП (малые ядерные нуклеопроетины), в составе которых есть мя-РНК. На ингибировании репликации и транскрипции основаны противоопухолевые препараты (токсин бледной поганки α-амоннитин ингибирует РНК-полимеразы).
КЭП
NB!: В процессе репликации спонтанно или под действием каких-либо факторов (УФ, яды, канцерогены) могут возникать ошибки в синтезированных дочерних цепях (например, при УФ в дочерней цепи ппроисходит дезаминирование цитозина с образование урацила). Если их не исправлять, то будут образовываться мутации. Следовательно, существуют ферменты репарации, которые исправляют ошибки. Это ферментный комплекс, который включает в себя: · Фермент, который находит ошибку · Фермент, который вырезает ошибку · Фермент, который исправляет ошибку · Фермент, сшивающий участки (лигазы).
ТРАНСЛЯЦИЯ Общая характеристика: 1. Матрица – мРНК. 2. Субстрат (из чего синтезируется продукт) – активированные аминокислоты. 3. Продукт –белок или ппц. 4. Источник энергии - АТФ, ГТФ, энергия макроэргических связей. 5. Ферменты, синтезирующие пептидную связь – пептидилтрансфераза (28S рРНК большой субъединицы рибосомы). 6. Локализация в клетке – цитоплазма. 7. Особенность: трансляция –единственный матричнй синтез, в котором матрица и продукт состоят из разных компонентов (матрица - нуклеотиды, продукт – аминокислоты). Следовательно, должна существовать адаптерная молекула, которой является тРНК. Этапы: 1) Инициация 2) Элонгация – синтез ппц 3) Терминация -конец синтеза
Механизм – в результате трансляции генетическая информация на матричной РНК переводится = транслируется в последовательность аминокислот в белке.
Прежде чем аминокислоты будут включены в синтез, они должны быть активированы.
Активация аминокислот Активация аминокислоты – присоединение аминокислоты к 3’-ОН концу тРНК макроэргической связью. Процесс идет с затратой АТФ (2 макроэргических связи). Для каждой аминокислоты - своя тРНК (согласно таблице кодов). Присоединение катализируется специфичным ферментом – аминоацил-тРНК-синтетаза.
Например, активация глицина: тРНК связывается со специфичным ферментом - гицилтранфераза- дигидроуридиловой петлей. Фермент, используя АТФ, переносит аминокислоту на тРНК (α-карбоксильная группа аминокислоты соединяется с 3’-ОН группой тРНК макроэргической связью). Образуется активированная аминокислота – глицил-тРНК (в общем случае – аминоацил-тРНК).
Упрощение тРНК
1.Инициация Сборка белоксинтезирующего аппарата.
1)
2)
3) 4) активированный метионин – метианил-тРНК - тРНКмет
5) факторы инициации - Fi 6) ГТФ, АТФ
А) К малой субъединице рибосомы присоединяется инициирующая аминоацил-тРНК (метионил-тРНК), факторы инициации и ГТФ. Б) Этот комплекс при использовании фактора инициации-«кэп-узнающего» - находит 5’-конец мРНК (где находится кэп) и присоединяется к нему. В) Комплекс передвигается по мРНК от 5’ к 3’ (затрачивается 1 АТФ), пока не достигнет стартового кодона Важно: кодирует метионин, с него всегда начинается биосинтез – АУГ на мРНК. Г) При достижении комплексом АУГ от него отщепляются факторы инициации, гидролизируется ГТФ, присоединяется большая субъединица. В рибосоме формируется Р-участок (для инициирующей аминоацил-тРНК) и А-участок.
2.Элонгация– синтез ппц (циклический) 1) Присоединение следующей аминоацил-тРНК в А-участок 2) Образование пептидной связи 3)
1 – в свободный А-участок присоединяется следующая аминоацил-тРНК согласно кодону мРНК. Затрачивается 1 ГТФ, принимают участие факторы элонгации. 2 – происходит разрыв макроэргических связей между аминокислотой и тРНК в Р-участке; при участии фермента пептидилтрансфераза (28S рРНК большой субъединицы рибосомы) остаток аминокислоты из Р-участка соединяется пептидной СО-концом с аминогруппой аминокислоты из А-участка. 3 – под действие фактора элонгации-2 и ГТФ рибосома перемещается на один кодон в направлении 5’→3’. При этом: · Свободная тРНК из Р-участка остается за рибосомой · В Р-участке оказывается тРНК с растущим пептидом, а А-участок свободный. И все сначала. Это продолжается, пока рибосома не встретит один из терминирующих или стоп-кодонов (УАА, УАГ, УГА) терминация не наступит. К терминирующему кодону присоединяется фактор терминации, разрываются макроэргические связи между тРНК и синтезированной ппц. Фермент пептидилтрансфераза присоединяет к свободному СО-концу воду. Так ппц освобождается из рибосомы, которая распадается.
ТЕМА 5 СИНТЕЗ АТФ.
Функции: · Донор энергии для биосинтеза веществ · Мышечное сокращение · Транспорт веществ через мембрану · Работа ионных насосов · Поддержание температуры тела
Обмен энергии связан с обменом веществ. Обмен веществ включает стадии: 1) Поступление пищевых веществ (белков, жиров, углеводов) в организм и их расщепление в ЖКТ 2) Метаболизм 3) Выделение конечных продуктов обмена из организма
Метаболизм: · Катаболизм – расщепление сложных пищевых веществ до конечных продуктов – СО2, Н2О, мочевина Конечные продукты – вещества, которые не подвергаются превращению в организме и выводятся из него. В результате катаболизма энергия, заключенная в пищевых веществах, трансформируется в энергию АТФ. Катаболизм сопровождается синтезом АТФ. · Анаболизм – синтез сложных веществ из простых с затратой АТФ, полученной при катаболизме
За сутки вырабатывается около 60 кг АТФ, но они не накапливаются, а сразу используются по мере необходимости. Время жизни одной молекулы АТФ – 1 минута, т.е. в организме постоянно происходит синтез АТФ.
Синтез АТФ можно представить как фосфорилирование АДФ. АДФ + Фн → АТФ Пути синтеза АТФ: 1) Субстратное фосфорилирование Может протекать в цитоплазме (гликолиз) или митохондриях (ЦТК). Протекает на уровне субстрата (без участия цепи переноса электронов) за счет энергии, которая выделяется при разрыве макроэргических связей в субстрате. 2) Окислительное фосфорилирование Протекает только в митохондриях. Протекает с окислением субстратов, с участием цепи переноса электронов за счет энергии протонного градиента. Окисление субстрата – отщепление от него электронов и протонов, т.е. атомов водорода. Ферменты – дегидрогеназы (I класс). Участие коферментов НАД+ и ФАД. Окисление субстрата и синтез АТФ протекают с участием кислорода (его требуется до 500 л в сутки). Тканевое дыхание – окисление веществ с участием кислорода до конечных продуктов (СО2 и Н2О). Всегда сопровождается синтезом АТФ путем ОФ.
Пищевые вещества (Б,Ж,У) подвергаются расщеплению в организме в 3 стадии: I и II стадии – специфические, III – общий путь катаболизма (ОПК), т.к. он одинаков для Б,Ж,У.
I стадия – специфическая – идет в ЖКТ. Пищевые вещества расщепляются до мономеров (У,Б) или до составляющих частей (Ж). Белки → аминокислоты Углеводы → глюкоза (в основном) Жиры → глицерол и жирные кислоты II стадия – специфическая – протекает внутриклеточно (или в цитоплазме, или в митохондриях) Заканчивается образованием двух продуктов: ПВК и ацетил-КоА III стадия – ОПК в митохондриях Включает 2 процесса: 1) Окислительное декарбоксилирование ПВК (ОДПВК) – ферментативное превращение ПВК в ацетил-КоА 2) ЦТК – общий конечный путь катаболизма Б, Ж, У
ОПК тесно связан с цепью переноса электронов (ЦПЭ). В результате функционирования ЦПЭ сопряжено синтезируется АТФ путем ОФ. Таким образом, все пищевые вещества расщепляются до СО2 и Н2О с выделение АТФ.
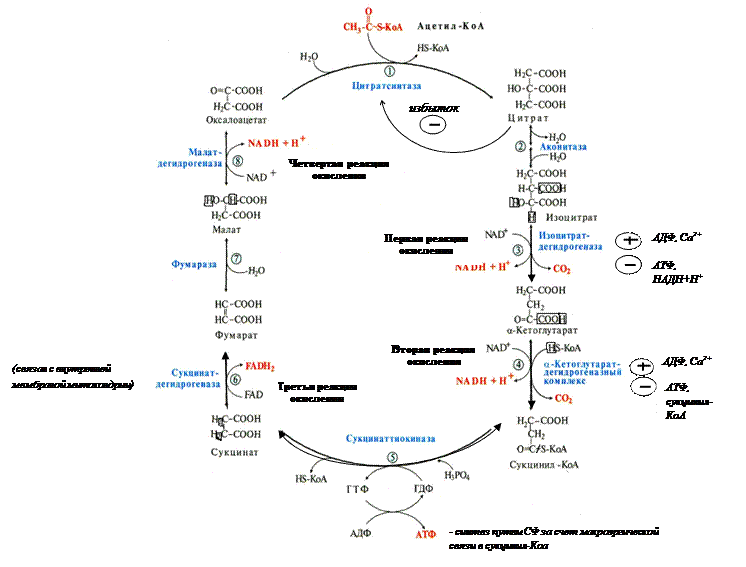
ЦТК ЦТК = цикл лимонной кислоты = цитратный цикл = цикл Кребса – открыт в 1937 г. ЦТК – общий конечный путь катаболизма Б, Ж, У. Функции ЦТК: · общий конечный путь катаболизма Б, Ж, У · основной, но не единственный поставщик атомов Н в ЦПЭ · анаболическая функция (синтетическая) – из промежуточных продуктов образуются аминокислоты, глюкоза, гем. Протекает в матриксе митохондрий. Все ферменты функционируют в матриксе, кроме сукцинатдегидрогеназы (связан с внутренней мембраной митохондрии). Существует 3 регуляторных реакции, т.е. регуляторных фермента: · цитратсинтаза · изоцитратдегидрогеназа (самая медленная реакция, определяет скорость) · α-Кетоглутаратдегидрогеназный комплекс (похож на ПДК) В цикле 8 реакций, 4 из них – реакции окисления (ферменты – дегидрогеназы, использующие НАД+ и ФАД). В цикл вступает двухуглеродная молекула ацетил-КоА, соединяющаяся с четырехуглеродным оксалоацетатом (ЩУК). Образуется шестиуглеродный цитрат. Далее – 4 реакции оксиления и 2 реакции декарбоксилирования. И оксалоацетат регенерирует.
Таким образом, в результате 4 реакций окисления в ЦТК и одной в ОДПВК отщепляются атомы Н (8 в ЦТК и 2 в ОДПВК). Эти Н поступают в ЦПЭ, где утилизируются с образованием конечного продукта – воды (метаболическая вода 400-500 мл).
ТЕМА 6 Синтез и распад гликогена Гликоген запасается в печени (6% от массы печени) -120 г, и мышцах (1% от массы мышц). В печени распад и синтез гликогена направлены на поддержание н
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 476; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.011 с.) |

 Первичная структура – последовательность аминокислотных остатков, соединенных пептидной связью.
Первичная структура – последовательность аминокислотных остатков, соединенных пептидной связью. При рН > 7 (кровь) пептидная связь енолизируется.
При рН > 7 (кровь) пептидная связь енолизируется.
 E + S → P + E
E + S → P + E











 Как донор фосфора – трансферазы
Как донор фосфора – трансферазы
 Неконкурентное
Неконкурентное Тип ингибирования зависит от концентрации субстрата (рис. 3): при увеличении концентрации субстрата он вытесняет ингибитор и АЦ, и максимальная скорость реакции не измениться, а константа Михаэлиса будет увеличиваться.
Тип ингибирования зависит от концентрации субстрата (рис. 3): при увеличении концентрации субстрата он вытесняет ингибитор и АЦ, и максимальная скорость реакции не измениться, а константа Михаэлиса будет увеличиваться.


 В репликативном глазе можно выделить 2 репликативные вилки.
В репликативном глазе можно выделить 2 репликативные вилки.



 РНК-полимераза II продвигается по цепи ДНК, достраивая комплементарную ей цепь РНК, которая спаривается с ней на протяжении 8-10 нуклеотидов.
РНК-полимераза II продвигается по цепи ДНК, достраивая комплементарную ей цепь РНК, которая спаривается с ней на протяжении 8-10 нуклеотидов.


 В цитоплазме в свободном виде находятся:
В цитоплазме в свободном виде находятся: Метионил-тРНК – инициирующая аминоацил-тРНК, т.к. с нее всегда начинается синтез белков у эукариот.
Метионил-тРНК – инициирующая аминоацил-тРНК, т.к. с нее всегда начинается синтез белков у эукариот. Транслокация (перемещение) рибосомы
Транслокация (перемещение) рибосомы АТФ – производное нуклеотида, у которого в 5’-положении находятся 3 остатка фосфорной кислоты, две концевые связаны макроэргическими связями. При их расщеплении выделяется энергия.
АТФ – производное нуклеотида, у которого в 5’-положении находятся 3 остатка фосфорной кислоты, две концевые связаны макроэргическими связями. При их расщеплении выделяется энергия. Следовательно, энергетический обмен тесно связан с метаболизмом и представляет собой цикл.
Следовательно, энергетический обмен тесно связан с метаболизмом и представляет собой цикл.