
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гормоны, регулирующие обмен белков, жиров, углеводовСодержание книги
Похожие статьи вашей тематики
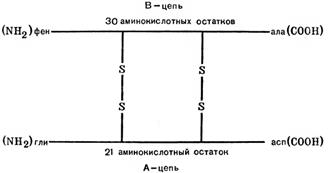
Поиск на нашем сайте Инсулин Белково-пептидной природы. Состоит из 2 ппц, соединенных дисульфидными связями.
Синтезируется в β-клетках островков Лангерганса (поджелудочная железа). Синтезируется в виде неактивного предшественника. Активируется частичным протеолизом. Действует через специфические инсулиновые рецепторы: может менять активность фермента путем фосфорилирования или дефосфорилирования и/или индуцировать транскрипцию и синтез новых белков-ферментов.
Влияние на обмен веществ Углеводный: ü Основное влияние - вместе с глюкагоном поддерживает нормальный уровень глюкозы в крови (артериальная кровь - 3,5-5,5 мМ/л, венозная кровь - 6,5). ü Активирует регуляторные ферменты синтеза гликогена (гликогенсинтаза), гликолиза (глюкокиназа, ФФК, пируваткиназа), ПФП (глюкоза-6Ф-дегидрогеназа). Липидный: ü Стимулирует депонирование жиров (увеличивает синтез ЛП-липазы) ü Стимулирует синтез жиров в печени и жировой ткани ü Способствует синтезу жиров из углеводов в жировой ткани (активирует ГЛЮТ-4) ü Активирует синтез жирных кислот (ацетил-КоА-карбоксилаза) ü Активирует синтез холестерола (ГМГ-редуктаза). Белковый: ü Стимулирует синтез белков (анаболический эффект) ü Увеличивает транспорт аминокислот в клетки ü Усиливает синтез ДНК и РНК. Стимулирует синтез глюкозы. С возрастом концентрация Са2+ снижается и нарушается секреция инсулина. В крови время полужизни - 3-5 минут. После действия разрушается в печени под действием инсулиназы (расщепляет цепи инсулина). При недостатке инсулина возникает сахарный диабет.
Сахарный диабет - заболевание, связанное с частичным или полным отсутствием инсулина.
Биохимические проявления сахарного диабета 1) Гипергликемия - нарушается потребление глюкозы инсулин-зависимыми тканями (жировая, мышцы). Даже при высокой концентрации глюкозы эти ткани находятся в состоянии энергетического голода. 2) Глюкозурия - при концентрации в крови >8,9 мМ/л глюкоза появляется в моче как патологический компонент. 3) Кетонемия - глюкоза не поступает в инсулин-зависимые ткани, то в них активируется β-окисление (жирные кислоты становятся основным источником энергии). Следовательно, образуется очень много ацетил-КоА, который не успевает утилизироваться в ЦТК и идет на синтез кетоновых тел (ацетон, ацетоацетат, β-гидроксибутират). 4) Кетонурия - появление кетоновых тел в моче. 5) Азотемия - при недостатке инсулина повышается катаболизм белков и аминокислот (дезаминирование), образуется много NH3. 6) Азотурия - из аммиака образуется мочевина, которой больше выводится с мочой. 7) Полиурия - выведение глюкозы с мочой приводит к увеличению выделения воды (при сахарном диабете - 5-6 л/сут). 8) Полидепсия - повышенная жажда. Осложнения сахарного диабета: · Острые · Поздние А: Острые осложнения проявляются в виде комы (нарушение обмена, потеря сознания). Виды комы, в основе которых ацидоз и дегидратация тканей: I - кето-ацидотическая кома - повышенный синтез кетоновых тел и ацидоз; II - лакто-ацидотическая кома - нарушение кровообращения, снижение функции гемоглобина, которое вызывает гипоксию. Следовательно, катаболизм глюкозы смещается в сторону "анаэробного" гликолиза до лактата. Образуется много молочной кислоты, возникает ацидоз; III - гиперосмолярная кома - из-за гипергликемии повышено осмотическое давление крови, и вода переносится из клеток в сосудистое русло, возникает дегидратация. В результате нарушается водно-электролитный обмен. Следовательно, происходит снижение периферического кровотока (мозга и почек) и гипоксия. Б: Поздние осложнения: основная причина - гипергликемия. В результате происходит неферментативное (спонтанное) гликозилирование белков, при этом нарушается их функция. Так возникают различные "-патии" (ангио-, нейро-, нейро-, ретино-). Например, в результате гликозилирования гемоглобина образуется гликозилированный ("гликированный") гемоглобин - HbA1c. В норме концентрация HbA1c - 5%. При сахарном диабете - до 50%. У него снижается сродство к кислороду → гипоксия. В хрусталике глюкоза присоединяется к кристаллину, что повышает агрегацию молекул. Следовательно, возникает помутнение хрусталика, приводящее к катаракте. При сахарном диабете нарушается синтез коллагена: из-за гликозилирования нарушается функция базальных мембран (например, кровеносных сосудов), следовательно, нарушается проницаемость сосудов и кровотока (в нижних конечностях). Это приводит к возникновению синдрома диабетической стопы и гангрене. Присоединение глюкозы к апо-белкам В100 ЛНП изменяет их строение, они захватываются макрофагами как чужеродные, проникают в поврежденный эндотелий сосудов, повышая риск атеросклероза. Лечение сахарного диабета: · диетотерапия, · инсулинотерапия (инъекции инсулина свиньи, отличающегося от человеческого одной аминокислотой), · прием сахароснижающих препаратов: o производные сульфанилмочевины - стимулируют синтез инсулина в поджелудочной железе (маннинил), o бигуаниды - замедляют всасывание глюкозы в кишечнике, улучшают потребление тканями глюкозы (активируют ГЛЮТ-4). Глюкагон Состоит из 39 аминокислотных остатков. Синтезируется в α-клетках островков Лангерганса (поджелудочная железа). Действует через цАМФ, рецепторы на поверхности мембраны. Гипергликемический фактор (повышает уровень глюкозы в крови). Влияние на обмен веществ: Углеводный: · стимулирует распад гликогена (гликогенфосфорилаза), · стимулирует глюконеогенез (фруктоза-1,6-бисфосфатаза); Липидный: усиливает мобилизацию жиров из жировой ткани (активирует ТАГ-липазу путем фосфорилирования), · усиливает β-окисление жирных кислот (КАТ-I), · индуцирует синтез кетоновых тел в митохондриях. Адреналин Производное тирозина. Катехоламин. Синтезируется в мозговом слое надпочечников, синтез и секреция под влиянием ЦНС. Действует через цАМФ, рецепторы находятся на поверхности мембраны (α- и β-адренергические). Гормон стресса. Повышает концентрацию глюкозы в крови, т.к. активирует гликогенфосфорилазу в печени. В экстренных ситуациях активирует мобилизацию гликогена в мышечной ткани с образованием глюкозы для мышц. Тормозит секрецию инсулина.
Кортизол Синтезируется из холестерола путем гидроксилирования через прегненолон и прогестерон. Синтезируется в корковом веществе надпочечников. Рецепторы в цитоплазме. Влияние на обмен веществ: · Стимулирует глюконеогенез (ПВК-карбоксилаза, ФЕП-карбоксикиназа). При высоких концентрациях повышает распад гликогена, что приводит к повышению уровня глюкозы в крови. · Ингибирует синтез жиров в конечностях, стимулирует липолиз, синтез жиров в других частях тела. · В периферических тканях (мышцах) тормозит биосинтез белков, стимулирует их катаболизм до аминокислот (для глюконеогенеза). В печени стимулирует синтез белков-ферментов глюконеогенеза. Вызывает инволюцию лимфоидной ткани, гибель лимфоцитов. Производные кортизола обладают противовоспалительной функцией (ингибируют фосфолипазу А2, что ведет к снижению уровня простагландинов - медиаторов воспаления). Гиперкортицизм. Причины: · повышенная секреция АКТГ (из-за опухоли) - болезнь Иценко-Кушинга; · опухоль надпочечников - синдром Иценко-Кушинга. В результате активирования глюконеогенеза, распада гликогена повышается концентрация глюкозы в крови. Возникает стероидный диабет (худые конечности, большой живот, лунообразное лицо).
Тиреоидные гормоны Т3 и Т4 вырабатываются в фолликулах щитовидной железы из аминокислоты тирозина. Рецепторы к ним располагаются в ядре, могут в цитоплазме. Синтез зависит от поступления йода с пищей и водой. Для поддержания нормального синтеза требуется около 150 мкг йода в сутки (беременным - 200 мкг). Механизм синтеза
1. В клетках фолликулов синтезируется тиреоглобулин (содержит 115 остатков тирозина). 2. Затем он поступает в полость фолликула. 3. Там происходит включение ионизированного йода (I- → I+) под действием тиреопероксидазы в третье или третье и пятое положение кольца тирозина. Образуется монойодтирозин (МИТ) и дийодтирозин (ДИТ). 4. Затем они конденсируются: МИТ + ДИТ = Т3 (трийодтирозин) ДИТ + ДИТ = Т4 (тетрайодтирозин) Т3 и Т4 в составе тиреоглобулина не обладают активностью и могут находиться в фолликулах до появления стимула. Стимул - ТТГ. 5. Под действием ТТГ происходит активация ферментов (протеазы), которые отщепляют Т3 и Т4 от тиреоглобулина. 6. Т3 и Т4 поступают в кровь. Там они связываются с белками-переносчиками: · тироксинсвязывающий глобулин (основной) · тироксинсвязывающий преальбумин. Наибольшей активностью обладает Т3, т.к. у него сродство к рецепторам в 10 раз выше, чем у Т4. Действие Т3, Т4 1) Действует на клетки: § повышает энергетический обмен (кроме гонад и клеток мозга) § усиливает потребление кислорода клетками § стимулирует синтез компонентов ЦПЭ § увеличивает количество митохондрий § в больших концентрациях - разобщитель окислительного фосфорилирования. 2) Повышает основной обмен. При недостатке тиреоидных гормонов у новорожденных возникает кретинизм, у взрослых - гипотиреоз, микседема (слизистый отек), т.к. повышается синтез ГАГ и гиалуроновой кислоты, которые задерживают воду. Также могут наблюдаться: Аутоиммунный тиреоидит. Эндемический зоб. Базедова болезнь. ТЕМА 10 ПЕЧЕНЬ Самая крупная железа. Выполняет множество функций: ü поддержание нормальной концентрации глюкозы в крови за счет синтеза и распада гликогена и глюконеогенеза ü защитная - синтез факторов свертывания крови (I, II, V, VII, IX, X) ü влияет на липидный обмен: синтез Желчных кислот, кетоновых тел, ЛВП, фосфолипидов, 85% холестерола ü влияет на белковый обмен: орнитиновый цикл, обезвреживание биогенных аминов ü участвует в метаболизма гормонов ü выполняет дезинтоксикационную функцию (обезвреживание). Обезвреживанию подвергаются: · ксенобиотики · эндогенные токсические вещества. Ксенобиотики - вещества, не выполняющие в организме энергетическую и пластическую функцию: · предметы жизнедеятельности (транспорт, промышленность, сельское хозяйство) · токсичные вещества парфюмерии, лакокрасочные изделия · лекарственные вещества. Обезвреживание может проходить в 2 стадии: 1 - если вещество гидрофобно, то на первой стадии оно становится гидрофильным (водорастворимым) 2 - конъюгация - соединение гидрофильных токсичных веществ с каким-либо другим → обезвреживание. Обезвреживание может ограничиться первой стадии, если в процессе первой стадии токсичное вещество обрело гидрофильность и обезвредилось (вторая стадия не протекает). Обезвреживание только второй стадией происходит, если токсичное вещество гидрофильное (протекает только конъюгация). 1 стадия обезвреживания: гидрофобное → гидрофильное Может протекать путем: · окисления · восстановления · гидролиза (расщепление) · гидроксилирования - чаще всего (образование ОН-групп в токсичном веществе). Принимает участие микросомальная ЦПЭ. (Митохондриальная ЦПЭ - энергетическая функция, микросомальная - пластическая). Микросомы - обрывки гладкого ЭПР. В микросомальной ЦПЭ могут функционировать ферменты: · монооксигеназы - используют только один атом кислорода · диоксигеназы - используют два атома кислорода = молекулу кислорода. Микросомальная монооксигеназная ЦПЭ Основной компонент - цитохром Р450. Он имеет два центра связывания: один - для атома кислорода, второй - для гидрофобного вещества.
Цитохром Р450 имеет следующие свойства: · · индуцируемость = усиление синтеза при употреблении токсичных веществ ("эффект царя Митридата", который принимал в течение жизни малые дозы яда, чтобы не быть отравленным). Чтобы Р450 присоединил один атом кислорода и внедрил его к гидрофобному веществу, он должен быть активирован. Р450 активируется электронами, поэтому ЦПЭ короткая. Компоненты: · НАДФН+Н+ - кофермент из ПФП · фермент НАДФН-зависимая-Р450-редуктаза - промежуточный переносчик; имеет 2 кофермента ФАД и ФМН - разделяют поток Н+ и е-. · Р450. Механизм обезвреживания (на примере индола, который образуется при гниении триптофана в кишечнике).
1. Два атома водорода (в виде 2е- и 2Н+) перемещаются к НАДФН-зависимой-Р450-рдуктазе: сначала на ФАД, потом на ФМН. 2. От него 2Н+ поступают на восстановление одного атома кислорода. 3. 2е- присоединяются к Р450, активируют его (Р450*) и вместе с протонами идут на восстановление Н2О. 4. Активированный Р450 присоединяет к себе второй атом кислорода в один активный центр, а гидрофобное вещество - в другой. 5. Р450* внедряет кислород в гидрофобное вещество с образованием ОН-группы. Образуется гидрофильное, но еще токсичное вещество. Некоторые вещества после 1 стадии могут становиться еще токсичнее (парацетамол может превращаться в токсичное вещество, поражающее клетки печени).
2 стадия: конъюгация Гидрофильное токсичное + Другое вещество = Парное, нетоксичное, выводится с желчью Участвуют ферменты трансферазы (II класс).
В результате присоединения этих веществ токсичные вещества обезвреживаются. Например, 2 стадия обезвреживания индола.
Обезвреживание билирубина Нормальная концентрация билирубина в крови - 8-20 мкмоль/л. Это пигмент красно-коричневого цвета, образуется при распаде гемоглобина. Бывает прямой и непрямой билирубин. Гипербилирубинемию - повышение концентрации билирубина может вызвать: · повышение гемолиза эритроцитов · нарушение функций печени · нарушение оттока желчи. Гем - простетическая группа гемоглобина. Эритроциты погибают и разрушаются через 20 дней. Освобожденный гемоглобин разрушается (в селезенке, печени, красном костном мозге). 1. Под действием гемоксигеназы разрушается связь между 1 и 2 кольцом гема. Образуется зеленый пигмент вердоглобин. 2. От него спонтанно отщепляется железо (с трансферрином поступает в печень, где депонируется и используется повторно) и белковая часть (расщепляется до аминокислот, которые используются повторно). Образуется желтый пигмент биливердин. 3. Биливердин восстанавливается биливердинредуктазой (кофермент НАДФН+Н+ из ПФП). 4. Образуется красно-коричневый билирубин. Он токсичный, нерастворимый, непрямой (НПБил). Он поступает в кровь, соединяется с альбумином (белок-переносчик) и поступает в печень. 5. Печень захватывает его с помощью белков лигандин (Л) и протеин Z (Z). Их деффект вызывает наследственную желтуху - синдром Жильбера (Ϯ). 6. В печени непрямой билирубин конъюгирует с 2 молекулами глюкуроновой кислоты под действием УДФ-глюкуронилтрансферазы. Образуется прямой, обезвреженный, растворимый билирубин (ПрБил). Дефект УДФ-глюкуронилтрансферазы вызывает синдром Криглера-Найяра (наследственная желтуха Ϯ). 7. Обезвреженный билирубин поступает в кишечник. 8. Под действием ферментов микрофлоры превращается там в бесцветный стеркобилиноген. 9. 95% его выводится с калом, где окисляется на воздухе, приобретая коричневый цвет, и называется стеркобилин. 10. 5% через геморроидальную вену поступает в почки и выводится с мочой. Окисляется на воздухе, приобретает желтый цвет и называется уробилиноген.
Обезвреживание билирубина
Желтуха При концентрации билирубина в крови выше 30 ммоль/л он может откладываться в слизистых и прадавать им желтый цвет. Желтуху диагностируют по крови, моче и калу. В зависимости от причин желтуха бывает: 1. Надпеченочная = гемолитическая. Причина - повышенный гемолиз эритроцитов (при переливании несовместимой группы крови или дефекте фермента ПФП глюкоза-6Ф-дегидрогеназа). Следовательно, печень функционирует нормально, но не успевает обезвреживать много непрямого билирубина. Поэтому диагностическая картина такова:
2. Печеночная Причина - поражение печени, нарушение функции, разрушение клеток (цирроз, гепатит, хронический алкоголизм). Следовательно, нарушается функция печени и она меньше обезвреживает непрямого билирубина. А т.к. клетки печени разрушены, то обезвреженный (прямой) билирубин поступает в кровь.
3. Подпеченочная Причина - нарушение оттока желчи (желче-каменная болезнь). Следовательно, все в крови.
4. Физиологическая желтуха новорожденных Может возникать в первые 2 недели. Причины: · повышенный распад гемоглобина (т.к. HbF замещается наHbA); · недостаток активности фермента УДФ-глюкуронилтрансферазы. Что делать: · вводить фенобарбитал - индуктор синтеза фермента УДФ-глюкуронилтрансферазы; · облучать синезеленым светом (волны длиной 620 нм). В таких условиях билирубин превращается в нетоксичный фотоизомер и выводится. ТЕМА 11 ГЕМОСТАЗ Гемостаз - система, включающая в себя процессы: · остановки кровотечения после травматического повреждения сосудов; · поддержание крови в жидком состоянии; · включает компоненты, способствующие растворению тромбов. Гемостаз проходит в 3 стадии: 1) тромбоцитарный = первичный гемостаз (3-5 мин) - сужение кровеносных сосудов, заканчивается образованием белого тромба; 2) гемокоагуляционный = вторичный гемостаз (10-30 мин). Включает 3 этапа: а) прокоагулянтный - активирование протромбокиназы и превращение протромбина в тромбин; б) коагуляция - образование рыхлого фибринового сгустка; в) ретракция - образование плотного красного фибринового тромба. 3) фибринолиз - растворение красного фибринового тромба с целью восстановления микроциркуляции в сосуде. Существует противосвертывающая система крови, которая направлена на ограничение распространения тромба местом повреждения сосуда. 1. Первичный гемостаз Только тромбоциты способны к адгезии и агрегации. Адгезия - налипание на края раны. Агрегация - скучивание вокруг раны. Тромбоциты должны быть активированы. Активация тромбоцитов заключается в: · изменении их формы с пластинчатой на звездчатую; · появление на мембранах тромбогенных участков (отрицательно заряженных фосфолипидов мембран), на которых будет происходить свертывание крови. В норме кровь не сворачивается, т.к. тромбоциты имеют пластинчатую форму, а не звездчатую, и не способны к агрегации. В кровеносных сосудах вырабатываются простациклины (производные арахидоновой кислоты), которые тормозят агрегацию тромбоцитов и сужение кровеносных сосудов. Для активации существуют первичные и вторичные индукторы активации: 1) Первичные - · фактор фон Виллебранда · коллаген · тромбин; 2) Вторичные - вырабатываются под действием тромбина (первичного индуктора активации). Механизма активации тромбоцитов 1. При повреждении кровеносных сосудов тромбоцитами и эндотелием выделяется фактор фон Виллебранда (фВ), который взаимодействует с рецепторами тромбоцитов и коллагеном поврежденных сосудов, образует между ними мостики и способствует адгезии (прилипание к краям раны). Под действием фактора фон Виллебранда в тромбоцитах активируется фосфолипаза С (ФлС), которая стимулирует образование ИФ3, который стимулирует выведение Ca2+ из внутриклеточных депо. Ca2+ связывается с кальмодулином, и этот комплекс активирует миокиназу, которая путем фосфорилирования активирует сократительный белок тромбостенин. Он сокращается и изменяет форму тромбоцита с пластинчатой на звездчатую, что облегчает их сцепление между собой, т.е. агрегацию. Коллаген (появляется при повреждении кровеносных сосудов) взаимодействует с рецепторами тромбоцитов, активирует фосфолипазу А2, которая отщепляет от фосфолипидов мембран арахидоновую кислоту (20:4). Она под действием циклооксигеназы (ЦОГ) превращается в тромбоксаны, которые вызывают сужение сосуда и агрегацию тромбоцитов (агрегация пока обратимая, т.к при надавливании на края раны кровотечение восстанавливается).
2. Необратимая агрегация наступает под действием тромбина, который через ИФ3 высвобождает кальций из депо. Кальций активирует протеинкиназу С (ПкС), которая путем фосфорилирования активирует сократительный белок плекстрин. Он способен сокращать секреторные гранулы и высвобождать из них вторичные индукторы активации тромбоцитов. Под их действием происходит сужение сосудов и необратимая агрегация с образованием белого тромбоцитарного тромба. Кровотечение останавливается. Вторичные индукторы активации тромбоцитов: · АДФ, Са2+ - усиливают агрегацию, · тромбоглобулин - снижает синтез гепарина и простациклинов, · серотонин - сужает сосуды, · фибронектин - связывает тромбоциты с коллагеном сосуда, · тромбоспондин - агрегация, · фактор фон Виллебранда - агрегация и адгезия. Кроме того, при активации тромбоцитов на их поверхности появляются отрицательно заряженные фосфолипиды мембран - фактор №3. Эти участки тромбогеннные, т.к. на них будет протекать свертывание крови. Если диаметр кровеносного сосуда меньше 100 мкм, то свертывание крови заканчивается тромбоцитарным гемостазом. На ингибировании первичного гемостаза основано действие средств, "разжижающих" кровь (тромбоаз, аспирин - ингибирует ЦОГ → тормозится агрегация → снижается тромбообразование). Противоположное действие - коллагеновые гемостатические повязки, которые усиливают агрегацию, сужение кровеносных сосудов и, следовательно, более быстро останавливают кровотечение. Если повреждается более крупный сосуд, то наступает 2 стадия - гемокоагуляция. Происходит активация тромбокиназы, превращающей протромбин в тромбин. Это каскадный механизма, в результате которого проис ходит усиление сигнала. В нем принимают участие 13 факторов свертывания крови. Они находятся в неактивном виде, но при повреждении сосудов активируются частичным протеолизом, и к их номеру добавляется "а" - активированный.
Ферментами являются II, VII, IX, X, XI, XII факторы. Все дальнейшие реакции с участием факторов свертывания крови протекают на мембранах тромбоцитов или клетках эндотелия поврежденных сосудов.
1. сами отрицательно заряженные фосфолипиды мембран; 2. Са2+ - через него ферменты будут связываться с фосфолипидами мембран; 3. фермент (VII, IX, X, XI, XII факторы) - активируется частичным протеолизом, связывается с мембранами через ионы кальция своими отрицательно заряженными карбоксильными группами; Все ферменты имеют дополнительный отрицательный заряд (карбоксильную группу) в составе глутаминовой кислоты. Образуются γ-карбоксиглутаминовые кислоты (ГКГК) в печени с участием витамина К. Антивитамины К (дикумарол и варфарин) препятствуют карбоксилированию глутаминовой кислоты и, следовательно, свертываемости крови. Карбоксилирование глутаминовой кислоты
В результате этого происходит активация мембранных комплексов. 4. белок-активатор - усиливает действие фермента в 500-1000 раз. 2а - Прокоагулянтная стадия На первой стадии необходимо активировать тромбокиназу. Эта реакция происходит на мембранах тромбоцитов. Активация тромбокиназы
1. отрицательно заряженные фосфолипиды мембран; 2. Са2+; 3. фермент (Xа фактор); 4. белок-активатор (Vа фактор). Активация протекает двумя путями: 1 - прокоагулянтный (внешний) - 5-10 сек; инициатор - III фактор (тканевый); 2 - контактный (внутренний) - 10-12 мин; активируется при контакте XII фактора с коллагеном поврежденного сосуда. Менее распространен. Протекает возле воспаления на аномальных стенках (при атеросклерозе). 1- Внешний путь - каскадный (происходит усиление выработки тромбина). На мембранах поврежденных клеток эндотелия сосудов появляется первый мембранный инициирующий комплекс: 1. 2. Са2+; 3. фермент (VII фактор); 4. белок-активатор (III фактор).
III фактор очень быстро активирует VII. VIIа инициирует образование теназного мембранного комплекса.
1. отрицательно заряженные фосфолипиды мембран; 2. Са2+; 3. фермент (IХ фактор); 4. белок-активатор (VIII фактор).
В этом комплексе фактор IXа активирует тромбокназу (фактор Х). Х фактор катализирует превращение небольшого количества протромбина в тромбин. Тромбин по принципу обратной отрицательной связи вызывает активацию V, VII, VIII факторов в вышеперечисленных комплексах, что способствует каскадному усилению активации тромбокиназы. В результате под действием Х фактора образуется много тромбина. 2 - Внутренний путь. XII фактор при контакте с коллагеном активируется и образуется мембранный косплекс, который вместе с ВМК способен превращать прекалликреин в калликреин. Калликреин по принципу обратной отрицательной связи активирует XII фактор. Общая схема прокоагулянтной стадии:
2б - Коагуляция Превращение фибриногена в фибрин под действием тромбина. Фибриноген состоит из 6 ппц (2А, 2В и 2γ).
Отщепление отрицательно заряженных А и В концов способствует образованию фибрин-мономера, изменению его конформации, открытию участков взаимодействия с другими мономерами. В результате их агрегации образуется фибрин-полимер. Фибриновый сгусток рыхлый, в его структуре присутствует сыворотка и тромбоциты. Под действием XIII фактора происходит образование ковалентных связей между отдельными мономерами. 2в - Ретракция Под действием сократительного белка тромбостенина фибрин-полимер сжимается, из него выдавливается сыворотка. Образуется красный фибриновый тромб. который стягивает края раны, облегчая ее зарастание соединительной тканью. 3. Фибринолиз Разрушение красного фибринового тромба. Когда образовался тромб, в печени синтезируется плазминоген, который прикрепляется к тромбу вместе со своими активаторами. Активаторы плазминогена: · ТАП (основной) - тканевый активатор плазминогена - синтезируется эндотелием; · урокиназа - синтезируется в моче, а также в тканях фибробластами и макрофагами; · стрептокиназа - фермент стрептококков. Под действием плазмина (активированного плазминогена) расщепляются фибриновые нити на мелкие кусочки (ппц), которые поступают в кровь. В результате тромб растворяется. Противосвертывающая система Функции: ü сохранение крови в жидком состоянии; ü препятствует распространению тромба местом повреждения сосуда, т. е направлена на сохранение свертываемости крови во времени и пространстве. Во времени Данная система ограничивает время существования активных фелков-ативаторов и обеспечивается антикоагулянтной системой (системой протеина С). Системой протеина активируется тромбином (в поврежденном сосуде тромбин активирует свертывание, а в неповрежденном - тормозит свертывание). Тромбин синтезирует образование двух мембранных комплексов на эндотелии неповрежденных сосудов. На поверхности мембран их эндотелия находится белок тромбомодулин, являющийся рецептором тромбина. Тромбомодулин - интегральный белок цитоплазматической мембраны, обнаруживается только в эндотелиальных клетках. Тромбин соединяется с мембраной неповрежденных клеток и образует комплекс (первый), который состоит из тромбомодулина (Тм), тромбина (Т) и Са2+.
Протеин С - профермент, содержит остатки глутаминовой кислоты, активируется частичным протеолизом под действие первого мембранного комплекса. Под действием тромбина протеин С (циркулирующий в крови) присоединяется к неповрежденным мембранам и в присутствии белка S активируется и расщепляет (инактивирует) V и VIII факторы, которые являются белками-активаторами ферментов. В пространстве Ограничение распространения тромба местом повреждения сосуда. Осуществляется путем ингибирования факторов свертывания крови, которые являются ферментами. Ингибиторы: 1) Антитромбин III (основной) Составляет 80-90% от общего числа подобных веществ. Активатор - гепарин. Связывает факторы-ферменты (II, IX, X, XII) и снижает их активность. Также активирует урокиназу, плазмин, калликреин. Но не инактивирует сериновые протеазы. Действует только на ферменты, циркулирующие в крови. Но не действует на ферменты, находящиеся в составе мембранных комплексов. Дефект антитромбина III приводит к тромбозам и эмболии сосудов. 2) Антиконвертин Ингибитор ферментов внешнего пути свертывания крови. Связывается с тканевым фактором, в результате чего не происходит активация инициирующего комплекса. Поэтому антиконвертин называют также ингибитором тканевого фактора. 3) α-макроглобулин Взаимодействует с активными сериновыми протеазами и подавляет их протеолитическую активность. 4) Оксалат, ЭДТА Связывают ионы кальция. 5) Природные антикоагулянты Расщепляют ферменты, участвуют в свертывании крови. Например, гегрудин, находящийся в слюне пиявки. Кроме этого, с недостатком функционирования факторов (VII, IX, XI) связано заболевание - гемофилия. С недостатком функционирования печени в синтезе факторов или присутствием антивитамина К связаны многие заболевания.
ТЕМА 12 СОЕДИНИТЕЛЬНАЯ ТКАНЬ Соединительные ткани - ткани, у которых мало клеток и много межклеточного вещества = межклеточного матрикса. Они составляют около 50% всех тканей. Клетки: · фибробласты · остеобласты · хондробласты <
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 702; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.045 с.) |


 широкая субстратная специфичность (обезвреживает множество токсичных веществ - барбитураты, лекарственные вещества, спирт и т.д.);
широкая субстратная специфичность (обезвреживает множество токсичных веществ - барбитураты, лекарственные вещества, спирт и т.д.);
 Глюкуроновая кислота (производное глюкозы)
Глюкуроновая кислота (производное глюкозы)
 УДФ-глюкуронат
УДФ-глюкуронат
 3'-фосфоаденозин-5'-фосфосульфат
3'-фосфоаденозин-5'-фосфосульфат



 Мембранные комплексы включают 4 компонента (на них происходит свертывание крови):
Мембранные комплексы включают 4 компонента (на них происходит свертывание крови):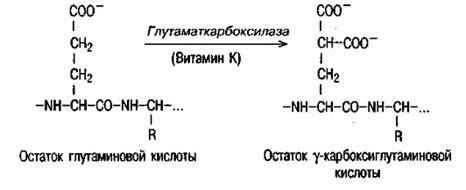
 Тромбокиназа - комплекс факторов:
Тромбокиназа - комплекс факторов: отрицательно заряженные фосфолипиды мембран;
отрицательно заряженные фосфолипиды мембран; Теназный мембранный комплекс:
Теназный мембранный комплекс:



 Второй мембранный комплекс включает в себя протеин С и его активатор - белок S, и Са2+.
Второй мембранный комплекс включает в себя протеин С и его активатор - белок S, и Са2+.


