
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы исследования структуры белков и пептидовСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Аминокислоты, соединяясь пептидной связью, образуют полипептидные цепи. Линейная последовательность аминокислотных остатков, соединенных между собой пептидными связями, определяет первичную структуру белковой молекулы.
ЭТАПЫ ИССЛЕДОВАНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКОВ И ПЕПТИДОВ
I. Выделение белка из смеси в чистом виде (по одному из признаков: размер молекулы, заряд, специфическое сродство связывания). Определение М. II. Определение N-концевой АК. III. Определение С-концевой АК. IV. Определение АК-последовательности белковой цепи.
Выделение белка из биологического материала основано на его физико-химических свойствах. Чаще всего для этих целей используют кислотно-основные свойства белков (амфотерность, заряд молекулы, изоэлектрическое состояние). От заряда белковых молекул зависит их: - растворимость (минимальна в ИЗС); - электрофоретическая подвижность; - структура и биологическая активность. При растворении в водной среде на поверхности белковой молекулы формируется гидратная оболочка. Устойчивость белка в растворе зависит от: 1) заряда белковой молекуы; 2) наличия гидратной оболочки; 3) молекулярной массы белка. Для выделения нативных белков (без изменения пространственной структуры) из биологического раствора используют методы: ▪ высаливание (осаждение солями щелочноземельных металлов: хлорид натрия, сульфат аммония); не нарушается первичная структура белка; ▪ осаждение (использование водоотнимающих веществ: спирт или ацетон при низких температурах, около –20°С). При использовании этих методов белки лишаются гидратной оболочки и выпадают в осадок в растворе. Денатурация — нарушение пространственной структуры белков (первичная структура молекулы сохраняется). Может быть обратимая (структура белка восстанавливается после устранения денатурирующего агента) или необратимая (пространственная структура молекулы не восстанавливается, например, при осаждении белков минеральными концентрированными кислотами, солями тяжелых металлов).
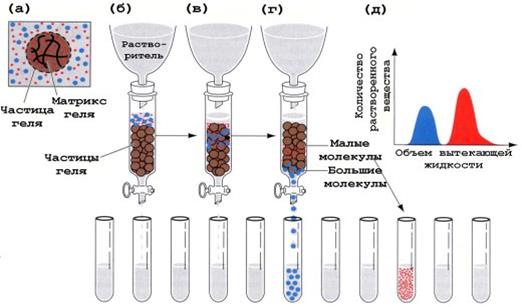
МЕТОДЫ РАЗДЕЛЕНИЯ БЕЛКОВ Отделение белков от низкомолекулярных примесей Метод мембранных сит (диализ) Используют диализную мембрану, которая является полимером и имеет поры определенной величины. Малые молекулы (низкомолекулярные примеси) проходят через поры в мембране, а крупные (белки) задерживаются. Таким образом белки отмывают от примесей. Разделение белков по молекулярной массе Гель-хроматография Хроматографическую колонку заполняют гранулами геля (сефадекс), который имеет поры определенной величины. В колонку вносят смесь белков. Белки, размер которых меньше, чем размер пор сефадекса, задерживаются в колонке, так как «застревают» в порах, а остальные свободно выходят из колонки. Размер белка зависит от его молекулярной массы.
Ультрацентрифугирование Этот метод основан на различной скорости седиментации (осаждения) белковых молекул в растворах с различным градиентом плотности (сахарозный буфер или хлорид цезия).
Электрофорез Данный метод основан на различной скорости миграции белков и пептидов в электрическом поле в зависимости от заряда. Носителями для электрофореза могут служить гели, ацетатцеллюлоза, агар. Разделяемые молекулы движутся в геле в зависимости от размера: те из них, которые имеют большие размеры, будут задерживаться при прохождении через поры геля. Меньшие молекулы будут встречать меньшее сопротивление и, соответственно, двигаться быстрее. В результате, после проведения электрофореза, большие молекулы будут находиться ближе к старту, чем меньшие.
Методом электрофореза можно разделить белки по молекулярной массе. Для этого используют электрофорез в ПААГ в присутствии додецилсульфата натрия (ДДS-Na).
|
|||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 898; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.141.201 (0.007 с.) |



 Додецилсульфат натрия (ДДС-Na)
Додецилсульфат натрия (ДДС-Na)




