Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема «строение и функции белков» (занятия 1- 4)Содержание книги
Поиск на нашем сайте
Министерства здравоохранения Российской Федерации Кафедра биологической химии
Практическое пособие по биологической химии для студентов лечебного и педиатрического факультетов (часть I, занятия 1- 9)
Тюмень - 2009
Практическое пособие по биологической химии для студентов лечебного и педиатрического факультетов (часть I). Авторы: Бышевский А.Ш., Леонова О.Ф., Тажудинова С.И., ГОУ ВПО Тюменская государственная медицинская академия Министерства здравоохранения России. Тюмень, 2005.
Учебно-методическое пособие утверждено и рекомендовано к тиражированию Центральным координационно-методическим советом Тюменской Государственной медицинской академии, протокол № 7 от 10 июня 2004 г.
Рекомендуемые пособия: Биохимия. Под редакцией чл.-корр. РАН, профессора Северина Е.С., Москва: ГОЭТАР-МЕД. – 2003 1. Березин Т.Г., Коровкин Б.Ф. Биологическая химия. М.: Медицина. – 1998. 2. Николаев А.Я. Биологическая химия. М.: Высшая школа. – 1998. 3. Бышевский А.Ш., Терсенов О.А.. Биохимия для врача. Екатеринбург: Уральский рабочий. - 1994 4. Конспекты лекций
Дополнительная литература:
1. Строев Е.А. Биологическая химия. М.: Медицина. – 1986 2. Уайт А., Хендлер Ф., Смит Э.И. и др. Основы биохимии (тома 1, 2 и 3). М.: Мир. – 1981. 3. Мари Р., Геннер Д., Мейес П., Родуэн В. Биохимия человека (тома 1, 2). М.: Мир. - 1993
Тема «Строение и функции белков» (занятия 1- 4) Цель: получить представление о белках - соединениях, являющихся приоритетными и обязательными структурно-функциональным компонентами клетки, изучить их строение (аминокислотный состав, уровни пространственной организации, виды химических связей, поддерживающих структуру) и функции, определяющие важную роль белков в животных организмах. Значение темы. Белки – неотъемлемый компонент живых организмов - играют ведущую роль в формировании и функционировании минимальной структуры живого – клетки, а также неклеточных образований в организмах. Приоритетное место белков в живых системах определяется многообразием их биологических функций, обусловленным в свою очередь многообразием и уникальностью структуры белковых молекул. В основе многообразия и уникальности белков лежат различия в их аминокислотном составе и последовательности (секвенции) протеиногенных аминокислот, общее число которых сравнительно невелико.
Существенно для медицинской науки то, что нарушения оптимального соотношения белков (аминокислот) в рационе питания, нарушения белкового обмена или обмена отдельных аминокислот лежат в основе многих патологических состояний. Это связано с тем, что белки выполняют в клетке ключевые функции (пластическую, транспортную, каталитическую, гормональную, защитную и энергетическую). Изменения в аминокислотном составе белковых молекул, а, следовательно, и в пространственной организации синтезируемых клеткой белков являются нередкой причиной нарушения обменных процессов. ЗАНЯТИЕ 1 «Техника безопасности. Цветные реакции, Обнаруживающие белки и аминокислоты» Цель занятия: 1) ознакомиться с элементами техники безопасности при работе в химической лаборатории, с приемами самостоятельной работы в процессе изучения дисциплины; 2) изучить общие характеристики белков; 3) изучить их физико-химические свойства, элементарный и аминокислотный состав, распространение белков в органах и тканях; 4) химическую структуру и свойства аминокислот; 5) овладеть простейшими приёмами обнаружения белков и аминокислот в биологических средах. Студент должен знать: А 1. Приёмы техники безопасности при работе с электроприборами, с агрессивными химическими соединениями, 2. Как предупреждать возможность поражения агрессивными соединениями, используемыми в лабораторных исследованиях, 3. Как предупредить электротравмы, как оказывать помощь подвергшимся электротравме, как вести себя при возникновении пожароопасной ситуации. Б 4. Определение понятия «Белковая молекула» 5. Общие свойства белковых молекул. 6. Элементарный состав белковых молекул. 7. Классификацию и номенклатуру, наименования и структурные формулы протеиногенных аминокислот. 8. Основной вид связи аминокислот в белковой молекуле. Студент должен уметь: 1. Изобразить общую структурную формулу аминокислоты. 2. Изобразить структурную формулу аминокислоты по её химическому наименованию. 3. Различать 20 протеиногенных аминокислот среди других аминокислот, не участвующих в построении белковых молекул.
4. Распознавать заменимые и незаменимые аминокислоты, а также условно (факультативно) незаменимые. 5. Выполнить цветные реакции, которые позволяют обнаружить белок и аминокислоты в биоматериалах без их фракционирования. Студент должен получить представление: 1) о роли дефицита аминокислот в возникновении некоторых патологических состояний; 2) о принципах, на которых основаны современные методы разделения и идентификации аминокислот. Сведения из базовых дисциплин, необходимые для изучения т емы: 1) аминокислоты как производные органических кислот, классификация последних; 2) строение и свойства карбамидной (пептидной) связи; 3) реакции гидролиза, условия их осуществления; 4) условия осуществления реакции синтеза, протекающей с отнятием элементов воды Аудиторная работа Лабораторная работа (цветные реакции, обнаруживающие белок) 1. Биуретовая реакция открывает в белке карбамидную связь (-СО-NH-), образующуюся в результате взаимодействия карбоксильной и аминогруппы a -аминокислот при отнятии молекулы воды. Название реакции происходит от производного мочевины - биурета, имеющего группировки, характерные для белковой молекулы (-СО-NH-). NB. Карбамидную связь в составе белковой молекулы СООН COOH Цистеин Серин
3) Nа2S+Nа2РЬО2+2Н2О → PbS ↓ +4NaOH. Черный осадок
Ход работы. К 5 каплям раствора белка прилить 5 капель реактива Фоля, нагреть до кипения и оставить на 1 или 2 мин - появляется бурый или черный осадок сернистого свинца. ВНИМАНИЕ!!! После выполнения проб каждому студенту необходимо индивидуально проделать следующее: в пробе жидкости, полученной у ассистента, установить наличие белка или аминокислот (при обнаружении аминокислот определить тип).
Дайте (письменно) обоснованные ответы на следующие вопросы: 1. Из 1 мл биологической жидкости полностью осажден белок, с помощью метода Къельдаля в осадке обнаружено 3 мг азота. Каково процентное содержание белка в исследуемой жидкости? 2. Исследуемая биологическая жидкость при нагревании с нингидрином приобретает фиолетовое окрашивание. Содержатся ли в исследуемой жидкости соединения белковой природы? 3. Исследуемая жидкость при нагревании с реактивом Миллона приобретает кирпично-красный цвет. Свидетельствует ли это о присутствии белка? 4. Реакция Фоля с биологической жидкостью положительна. Ваши выводы, нужна ли дополнительная информация? 5. Можно ли установить присутствие свободных аминокислот в растворе белка, располагая реактивами только для нингидриновой пробы? Используя учебник, проделайте следующее: 1. Запишите определение понятия «белковая молекула», 2. Изобразите структурные формулы протеиногенных аминокислот, 3. Р азделите их в зависимости от строения радикала на циклические и ациклические, 4. Разделите их в зависимости от характера дополнительной функциональной группы. Аудиторная работа Лабораторная работа (Х роматографическое разделение аминокислот - демонстрация прибора и хроматограммы. Высаливание белков, их количественное определение )
1. Высаливание белков сыворотки крови сульфатом аммония может использоваться для разделения альбуминов и глобулинов, так как глобулины осаждаются при 50%-ном насыщении сульфатом аммония, а альбумины - при 100%-ном насыщении.
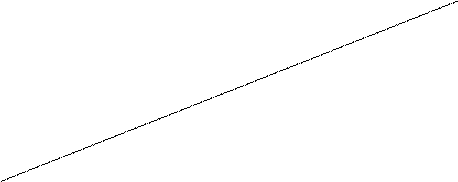
Ход работы. В пробирку внести 2 мл сыворотки крови и прибавить столько же насыщенного раствора сульфата аммония. Образующийся осадок отфильтровать - на фильтре при этом останутся глобулины. К фильтрату добавить сухого тонко измельченного порошка сульфата аммония до насыщения. Образующийся при этом осадок, представленный альбуминами, отделить фильтрованием. Высаливание сульфатом аммония обратимо. В этом можно убедиться, поместив фильтры с осадком белка в воду - происходит растворение осадка. 2. Количественное определение белка в моче основано на реакции осаждения белка сульфосалициловой кислотой и определении мутности осадка (нефелометрическое определение). Ход работы: А. Опытная проба - 1) в центрифужную пробирку внести 1.25 мл фильтрата мочи и добавить до 5 мл раствора сульфосалициловой кислоты; 2) экспонировать 5 мин; 3) внести пробу после экспозиции в кювету (10 мм) фотоэлектроколориметра и определить (против воды) плотность образовавшейся мути, используя оранжевый фильтр. Б. Контрольная проба: внести в центрифужную пробирку вместо сульфосалициловой кислоты 1,25 мл дистиллированной воды и далее воспроизвести пункты 2- и 3 основного опыта. Найти разницу между оптической плотностью опытной и контрольной проб и учесть результат по калибровочному графику. Представленный график (см. следующую страницу) построен по результатам определения оптической плотности растворов альбумина с известной концентрацией при добавлении к ним сульфосалициловой кислоты: на оси абсцисс отложены значения концентраций белка (в %), на оси ординат – значения оптической плотности (единица измерений - экстинкции).
0.20
0.12
0.04
0.1 0.25 0.50 1.0 С, % Аудиторная работа Гидролиз нуклеопротеидов Ход работы. В круглодонную колбу поместить 1 г дрожжей, добавить 20 мл 10%-ного раствора серной кислоты и столько же дистиллированной воды. Колбу закрыть пробкой с обратным холодильником и кипятить под тягой 1,5 ч при слабом нагревании. Жидкость охладить, довести дистиллированной водой до исходного объема, фильтровать. Фильтрат использовать для следующих качественных реакций: а) биуретовая реакция (для обнаружения полипептидов). К 5 каплям полученного гидролизата прибавить 10 капель 10%-ного раствора едкого натра и 1 каплю 1%-ного раствора сернокислой меди. Жидкость окрашивается в розовый цвет; б) серебряная проба (для обнаружения пуриновых оснований). К 5 каплям гидролизата прилить 5 капель 2%-го аммиачного раствора азотнокислого серебра. Через 3-5 мин выпадает небольшой бурый осадок серебряных соединений пуриновых оснований;
в) качественная реакция Молиша (для обнаружения пентозной группировки). К 10 каплям гидролизата прилить 2 - 3 капли 1%-ного раствора тимола в этаноле, перемешать и по стенке опустить равный объем концентрированной серной кислоты - отчетливое красное кольцо; г) молибденовая проба (для обнаружения фосфорной кислоты). К 5 каплям гидролизата прилить 5 капель молибденового реактива и кипятить несколько минут. Появляется лимонно-желтое окрашивание, а при охлаждении - желтый кристаллический осадок комплексного соединения фосфорномолибденовокислого аммония. Дать обоснованные ответы предложенные ниже задания: 1. Какие структурные компоненты входят в состав ДНК? В какой последовательности связаны они между собой? 2. Построить комплементарную цепь к участку. представленного ниже фрагмента ДНК (- А - Г - Г - Ц - Т- Г-Т) так, чтобы образовавшаяся цепь представляла собой фрагмент РНК:
3. Построить комплементарную цепь к участку одной из цепей ДНК, представленному ниже: -А - Г - Г - Ц - Т - : -: -: -: -: -? -? -? -? -? -
4.Найдите ошибки в представленном ниже фрагменте ДНК:
-Т - У - А - У - Ц - Т - Т - Г- : -: -: -::::: А - А - Т - А - Г - А - А - У- 5. Олигонуклеотид гидролизовали двумя способами. В первом случае в гидролизате определили мононуклеотиды А, Г, Ц и Т (последний находится в гидролизате в количестве, превышающем остальные в 2 раза), а также динуклеотиды Г - А, А - Т и Т - Т. Во втором случае, наряду со свободными нуклеотидами нашли динуклеотид Г - Ц. Определите последовательность нуклеотидов в исходном продукте? 6. Исследуемый раствор обнаруживает положительную биуретовую реакцию, образует осадок при кипячении и добавлении концентрированных минеральных кислот, а также сульфосалициловой кислоты. Составить план исследования, цель которого - выяснить, находятся в растворе простой или сложный белок. Если обнаружится сложный белок, как установить (или исключить), что он является гемоглобином. 7. Объяснить, на чем основано деление сложных белков на классы. 8. Дать краткую характеристику всех классов сложных белков. 9. Запомнить структурные формулы простетических групп нуклеиновых кислот. 10. Охарактеризовать азотистые основания, входящие в состав нуклеиновых кислот и перечислить различия между ДНК и РНК (по локализации, структуре, функциям). 11. Назвать минимальный информационный элемент в структуре ДНК и РНК. 12. Усвоить, как реализуется роль ДНК и РНК как источников информации. 13. Назвать две подгруппы хромопротеидов и различия между ними. 14. Закрепить представление о структуре гемоглобина (изучить компоненты белковой части и компоненты гема, а также их роль в основной функции гемоглобина).
ЗАНЯТИЕ 4 (итоговое) При подготовке к итоговому занятию проконтролировать усвоены ли Вами раздел «Строение и функции белков» с помощью следующих вопросов (при подготовке использовать материалы лекций и учебники): 1. Сформулировать понятие «Жизнь», включая в определение все элементы, являющиеся предметом биохимии.
2. Определить предмет биохимии и перечислить вопросы, которыми занимается эта наука. 3. Назвать важнейшие надмолекулярные образования живого и группы молекул, их составляющие 4. Дать определения класса «Белки» 5. Дать определение класса «Аминокислоты». 6. Написать структурные формулы всех трипептидов, которые можно построить из гистидина, аланина и валина. 7. Какие из приведенных ниже пептидов являются кислыми, основными или нейтральными и указать общий электрический заряд каждого из них. pro-ser-ser; ala-pro-leu-thr; met-gly-ala; glu-his-ser; cys-lys-arg, glu-arg-lys; his-glu. 8. Перечислить известные вам подходы к классификации белков 9. Назвать группы белков, различающиеся по составу. 10. Назвать группы белков, различающиеся по трехмерной структуре. 11. Назвать группы сложных белков. 12. Продолжить фразу «Потеря нативной конформации под воздействием химических, физических и других факторов без нарушения аминокислотной последовательности - это.........» 13. Перечислить типы химических связей, разрушающихся при денатурации. 14. Перечислить в логической последовательности действия, необходимые для выделения белков из тканей. 15. Изобразить структурные формулы азотистых оснований, входящих в состав мононуклеотидов. 16. Изобразить структурные формулы АМФ, ГМФ, ЦМФ, ТМФ и УМФ. 17. Изобразить способ связи между мононуклеотидами в полинуклеотиде. 18. Назвать различия между ДНК и РНК по составу, структуре, локализации и функции. 19. К какому типу белков относится гемоглобин? 20. Назвать структурные особенности глобина. 21. Изобразить структурную формулу гема, назвать связи между гемом и глобином. 22. Чем обусловлено многообразие функций белков? 23. Перечислить биологические функции белков.
При изучении этого раздела приобретаются также сведения о том, как в целостном организме регулируется активность ферментов, и создаются общие представления о связи ряда патологических процессов с изменением активности или количества ферментов, сведения о принципах количественной характеристики ферментов, об их использовании в диагностических и терапевтических целях. Занятие 5 (Влияние температуры и реакции среды на каталитическую активность ферментов. Специфичность ферментов)
Цель занятия: изучить свойства ферментов, обусловленные их белковой природой. Студент должен знать: 1. Прямые и косвенные доказательства белковой природы ферментов а также то, что ферменты могут иметь структуру простых и сложных белков. 2. Соединения, выполняющие функцию простетической группы ферментов. 3. Принципы классификации ферментов, современную классификацию и номенклатуру. 4. Свойства ферментов и факторы, влияющие на скорость ферментативной реакции. 5. Как регистрируется активность фермента. Факторы, влияющие на скорость ферментативной реакции. 6. Что представляет собой активный и каталитический центры фермента 7. Способы выражения активности ферментов. Студент должен уметь: 1. Расшифровать функцию фермента по его химическому наименованию. 2. Назвать субстрат фермента по химическому наименованию. 3. Рассчитать активность фермента по данным, полученным в экспериментальной системе, в которой после внесения исследуемого фермента через определенное время установили количество превращенного субстрата. 4. Распознать среди перечня химических соединений те из них, которые могут играть роль коферментов. 5. Определять температурный и рН-оптимум фермента. 6.. Строить графики зависимости скорости реакции от температуры, рН среды и концентрации субстрата, находить константу Михаэлиса. Студент должен получить представление: 1) о существовании заболеваний, обусловленных наследуемыми дефектами генов, ответственных за продукцию белков-ферментов, 2) о возможностях, которые предоставляет энзимология практической медицине, 3) о лечебном применении энзимов в диагностике и терапии (энзимодиагностике и энзимотерапии), 4) о принципах хранения ферментативных препаратов Сведения из базовых дисциплин, необходимые для изучения т емы: 1) сведения о связи структуры и функции в молекуле белка; 2) сведения о факторах, стабилизирующих белковую молекулу, и факторах, повышающих лабильность белковой молекулы, 3) сведения о влиянии температуры и рН среды на диссоциацию.
Аудиторная работа. Лабораторные работы 1. Влияние температуры на каталитическую активность амилазы слюны. Амилаза слюны катализирует расщепление крахмала через стадию образования декстринов до дисахарида мальтозы, которая обладает восстанавливающими свойствами. О действии фермента можно судить по исчезновению субстрата амилазы (крахмала) или по образованию конечных продуктов расщепления. Крахмал обнаруживается пробой Люголя (синее окрашивание со свободным йодом). Мальтоза открывается реакцией Троммера (при нагревании с восстанавливающим сахаром гидрат окиси меди восстанавливается сначала в гидрат закиси желтого цвета, затем - в закись меди кирпично-красного цвета). Ход работы. В четыре пробирки отмерить по 4 мл 0,5%-ного раствора крахмала и по 1 мл слюны, разведенной в 10 раз водой. 1-ю пробирку поместить в кипящую водяную баню, 2-ю - в ледяную баню, 3-ю - в термостат при 370 С, 4-ю - оставить при комнатной температуре. Через 10 мин содержимое каждой пробирки разделить на две примерно равных части. С одной частью провести пробу на крахмал, с другой - на восстанавливающий сахар (пробы Люголя и Троммера соответственно): 1) к содержимому пробирки добавить 2 капли раствора Люголя – появление синего окрашивания свидетельствует о наличии крахмала; 2) к содержимому пробирки добавить 1 мл 10%-ного раствора едкого калия и по каплям вносить 1%-ный раствор сернокислой меди до образования неисчезающего осадка (муть на фоне голубой окраски раствора); затем нагреть до кипения - появление желтого окрашивания, переходящего в кирпично-красное, указывает на наличие восстанавливающих углеводов. Сравнить результаты проб, проведенных при разных температурах, и сделать выводы. 2. Влияние рН на действие ферментов. Зависимость активности ферментов от концентрации Н-ионов можно проследить в опытах с амилазой слюны, рН-оптимум которой равен 6,8. Ход работы. В три пробирки внести по 3 мл буферного раствора с рН 1,2; 6,8 и 10,0. Добавить в каждую пробирку по 1 мл слюны, разведенной водой в 10 раз, и по 2 мл 0,5%-ного раствора крахмала. Смешать и инкубировать при 370С 10 мин. Подкислить содержимое второй и третьей пробирок добавлением соответственно 1 и 2 мл 0,1 н соляной кислоты (реакция на крахмал положительна только в кислой среде!) и провести пробу Люголя. Сравнить интенсивность распада крахмала в зависимости от рН и сделать выводы. 3. Специфичность действия ферментов. Специфическими субстратами амилазы слюны являются крахмал и гликоген, расщепление которых амилаза катализирует. Образующаяся при расщеплении крахмала мальтоза обнаруживается пробой Троммера. Используя в качестве субстрата сахарозу, можно убедиться в том, что амилаза не катализирует распад крахмала. Ход работы. В одну пробирку внести 2 мл 0,5%-ного раствора крахмала, в другую -.2 мл 2%-ного раствора сахарозы. Добавить в обе пробирки по 2 мл слюны, разведенной в 10 раз водой, смешать и оставить на 10 мин при 370С. Провести с содержимым обеих пробирок пробу Троммера. Она окажется положительной при наличии редуцирующего углевода - мальтозы (пробирка первая) и отрицательной в отсутствие редуцирующего углевода (пробирка вторая). Решите следующие задачи, приведите ход рассуждений: 1. Как доказать, что способность дрожжевых клеток расщеплять крахмал сохраняется и при их разрушении? Вы располагаете раствором крахмала, раствором Люголя, поваренной солью и льдом. 2. Как обнаружить присутствие каталазы в биологической жидкости? 3. Какой раствор можно использовать для обнаружения примеси свежей крови в воде: разбавленным этанолом, муравьиной кислотой, перекисью водорода, раствором хлорида калия? 4. Выберите правильное утверждение: а) катализатор ускоряет реакцию, не участвуя в ней; б) катализатор ускоряет реакцию, образуя промежуточные соединения с исходными продуктами, и входит в состав конечных продуктов; в) катализатор ускоряет реакцию, взаимодействуя с реагирующими соединениями, но не входит в состав конечных продуктов; г) катализатор ускоряет реакцию, но не входит в состав конечных продуктов. 5. Вещества А и Б взаимодействуют по схеме А+Б↔АБ. При заданной концентрации А и Б через 30 мин после их смешивания устанавливается подвижное равновесие - скорость прямой и обратной реакций уравниваются. Какую из приведенных характеристик реакции изменит внесение катализатора? 6. Вещество х,не изменяет соотношения между концентрацией исходных и конечных продуктов реакции в состоянии подвижного равновесия, но удлиняет (или сокращает) время наступления равновесия. В каком случае это вещество можно назвать катализатором? 7. Скорость взаимодействия А+Б увеличилась в 3 раза после добавления вещества К. В качестве конечных продуктов в последнем случае обнаруживаются соединения АК и БК. Является ли вещество К катализатором? Аудиторная работа. Ферментативных реакций) Биологическое окисление). Цель: 1. Познакомиться с определением понятия «Обмен веществ», убедиться в том, что обмен веществ – совокупность всех химических превращений в организме; познакомиться с терминологией, используемой при изучении настоящего раздела, уяснить суть понятий «анаболизм» и «катаболизм» и их отличия от терминов синтез и распад. 2. Познакомиться с историей развития представлений о биологическом окислении и современным понятием «биологическое окисление», с представлением о формах биологического окисления, роли свободных радикалов кислорода, значении свободнорадикального окисления. Студент должен знать: 1. Что включает понятие «Обмен веществ». 2. Как сочетаются в обменных процессах (анаболических и катаболических) реакции синтеза и распада. 3. Что значит «метаболический путь», виды метаболических путей. 4. Чем отличается биологическое окисление от окисления в неживой природе. 5. В чем заключается биологический смысл окисления в организмах. 6. Структуру макроэргических соединений. 7. Что представляет собой свободнорадикальное окисление. . Студент должен уметь: 1. Отличать понятия катаболизм и анаболизм от понятий синтез и деструкция (расщепление). 2. Охарактеризовать основные этапы метаболизма 3. Составить схему круговорота энергии и веществ в живой природе с учетом аутотрофных и гетеротрофных организмов. 4. Изобразить структурные формулы важнейших макроэргических соединений живой природы. 5. Составить схему экспериментального выявления окислительно-восстановительных свойств у исследуемого вещества (на примере тирозина) Студент должен получить представление: 1) об общих чертах метаболических процессов, 2) о важнейших источниках энергии в животном организме, 3) о значении свободнорадикального окисления как физиологического процесса, 4) о патологических состояниях, связанных с гипероксидацией, 5) о значении антиоксидантов в комплексе терапевтических мероприятий. Сведения из базовых дисциплин, необходимые для изучения т емы: 1) основные положения термодинамики, 2) понятия о фазовых реакциях, 3) сведения о катализе, 5) сведения о процессах фотосинтеза в клетке, 6) современная номенклатура химических соединений. Аудиторная работа. И участники процесса») Цель: ознакомиться с важнейшим механизмом биологического окисления – тканевым дыханием, структурой и локализацией ферментов этого процесса, с механизмами транспорта протонов и электронов по дыхательной цепи, фактором, определяющим направление переноса. Студент должен знать: 1. В какой роли выступает в процессе тканевого дыхания окисляемый субстрат. 2. Что представляют собой акцепторы-донаторы протонов и электронов в дыхательной цепи, их структуру, последовательность взаимодействия, 3. Чем определяется направление транспорта протонов-электронов; компоненты структуры простетических групп дегидрогеназ, определяющие их способность транспортировать электроны и протоны. 4. Водородтранспортный и электронтранспортный участки дыхательной цепи, множественность форм электронтранспортных компонентов, чем отличаются неаутооксидабельные и аутооксидабельные компоненты. 5. Локализацию энзимов тканевого дыхания, последовательность их расположения во внутренней мембране митохондрии. 6. О свойстве внутренней мембраны относительно Н-ионов, структуру и роль протонного канала. 7. Значение некоторых витаминов в транспорте протонов и электронов. 8. Отличия в механизмах дегидрирования насыщенных, ненасыщенных соединений, спиртов, альдегидов, кетонов и аминокислот.
. Студент должен уметь: 1. о ведущей роли биологического окисления в поддержании энергетического обмена, 2. Опознать по структуре кофермента дегидрогеназ их место в дыхательной цепи. 3. Составить схему локализации и функционирования дыхательной цепи. 4. Изобразить схему того структурного компонента митохондрий, в котором располагаются энзимы дыхательной цепи, указать на схеме элементы протонного канала 5. Уметь изображать структурные формулы важнейших макроэргических соединений живой природы. 6. Показать на фрагментах структурных формул насыщенных и ненасыщенных соединений, спиртов, альдегидов и кетонов ход их дегидрирования. Студент должен получить представление: 1) о значении нарушений биологического окисления в развитии некоторых патологических состояний, 3) о патологических состояниях, ведущих к нарушению энергетического обмена.. Сведения из базовых дисциплин, необходимые для изучения т емы: 1) основные положения термодинамики, 2) представления об окислительно-восстановительном потенциале, 3) о принципах определения окислительно-восстановительного потенциала in vitro.
Аудиторная работа. Лабораторная работа (сопоставление окислительно-восстановительного потенциала рибофлавина и метиленовой сини). Ход работы. В пробирку внести 4 - 5 капель воды, одну каплю взвеси рибофлавина и по каплям добавлять раствор красителя «метиленовый синий» до появления синего или зеленовато-синего окрашивания раствора. Затем внести в пробирку гранулу цинка и 2 капли концентрированной соляной кислоты. Начинается выделение пузырьков водорода. По мере насыщения раствора водородом окислительно-восстановительный потенциал смеси постепенно снижается, и происходит восстановление рибофлавина и метиленового синего. Восстановление всего имеющегося метиленового синего (Е - 0,11) происходит раньше, чем восстановление значительной части рибофлавина (Е - 0,20), поэтому окраска жидкости переходит последовательно в зеленый, желто-зеленый, желтый и, наконец, бледно-желтый или розовый цвет. Бледно-желтую жидкость слить в другую пробирку и наблюдать изменение окраски. Водород в жидкость больше не поступает, а ранее растворенный в ней водород частично уходит в атмосферный воздух, отчасти переносится через рибофлавин и метиленовый синий на кислород воздуха. В связи с этим окислительно-восстановительный потенциал, постепенно повышается. После расходования водорода в растворе начинается окисление восстановленного рибофлавина, он передает водород через метиленовый синий на кислород и приобретает желтую окраску (раствор желтеет). Затем начинается окисление восстановленного (т.е. бесцветного) метиленового синего - раствор становится вначале зеленым, а затем синим. В протоколе работы записать схему переноса водорода в изучаемой системе. Дать (приводя ход решения) ответы на следующие задачи или выполнить указанные действия: 1. Соединения А, В, С, Х и Y имеют редокс-потенциалы, равные - 0,39, + 0,22, - 0,37, - 0,35, + 0,28 В соответственно. В какой последовательности будет происходить перенос электронов в системе, включающей эти соединения (от водородного электрода)? 2. Написать реакции дегидрирования соединений: а) R-СН2-СН2-R; б) R-СН=О; в) R-СНОН-R; г) R-СН=СН-R. 3. Какие из перечисленных соединений являются субстратом флавиновых ферментов: глюкоза, сахароза, янтарная кислота, глицериновый альдегид, НАД Н+, НАДФ Н+, глутаминовая кислота? 4. Какие из перечисленных соединений могут служить акцепторами водорода от флавиновых ферментов: О2, НАД, НАДФ, цитохромы, пировиноградная кислота, глутатион, фумаровая кислота? 5. Как изменится коэффициент полезного действия (КПД) тканевого дыхания, сопряженного с окислительным фосфорилированием, если в переносе протонов и электронов не участвуют НАД-дегидрогеназы (КПД в условия нормы принять равным 0,4)? 6. Как изменится теплопродукция органа; если при постоянной интенсивности тканевого дыхания в связи с появлением разобщающего фактора коэффициент Р/О снизился с 3 до 1?
7. Какой элемент отсутствует в уравнении: СOOH-СН2-СН2-COOH +? →сукцинатдегидрогеназа→ СООН-CH=CH-СООН +?
8. Какие элементы отсутствуют в уравнениях:
а) Н2СО +? →? + НСООН; б)? + 1/2О2 ксантиноксидаза > НСООН +?
9. Напишите химическое уравнение реакции анаэробного дегидрирования первичного спирта с учетом всех необходимых компонентов. 10. Три названных ниже продукта могут составить окислительно-восстановительную цепь: 02, глутаминовая кислота, протеин-ФМН. Построить цепь в последовательности: донатор - промежуточный акцептор протонов и электронов - конечный акцептор. 11. Как изменится теплопродукция органа, если блокирована НАД-дегидрогеназа, но сохранена функция, других компонентов дыхательной цепи? В качестве субстрата используется глутаминовая кислота (до повреждения орган продуцировал 50 кал/мин). 12. Коэффициент Р/О исследуемой ткани снизился с 3 до 2 (с 3 до 1). Какой процесс, на каких этапах нарушен в первом и втором случаях? 13. В пробирке создана система, содержащая неповрежденные митохондрии, обеспечивается доступ кислорода, присутствуют достаточные количества АДФ и неорганического фосфата. Подберите из перечисленных ниже субстратов такие, окисление которых может обеспечить коэффициент Р/О, равный.2 или 3: глюкоза, глицериновый альдегид, глутаминовая кислота, НАД Н+, НАДФ Н+, янтарная кислота. 14. Как изменится концентрация неорганического фосфата и АДФ в системе, содержащей неповрежденные митохондрии и обильно снабжаемой способным к окислению субстратом: 1) в присутствии 2,4-динитрофенола, 2) в отсутствие 2,4-динитрофенола. Аргументировать ответ Занятие 9 (итоговое). При подготовке к занятию в порядке самоконтроля определить с помощью следующих вопросов, усвоены ли Вами разделы «Ферменты» и «Биологическое окисление» (использовать материалы лекций, учебники). 1. Природа и свойства ферментов. 2. Номенклатура и классификация ферментов. 3. Принципы определения и выражения активности ферментов. 4. Кинетика ферментативных процессов; эффекторы ферментативных реакций (ингибиторы и активаторы); 8. Современные представления о биологическом окислении (тканевое дыхание и окислительное фосфорилирование). 9. Ферменты тканевого дыхания – локализация, последовательность размещения, понятия «донатор-акцептор» протонов и электронов, водород- и эелектронтранспортные участки, конечный акцептор электронов и протонов 10. Типы дегидрирования. 11. Механизмы сопряжения и разобщения (фактор сопряжения, разобщающие факторы, коэффициент Р/О).
Министерства здравоохранения Российской Федерации Кафедра биологической химии
Практическое пособие по биологической химии для студентов лечебного и педиатрического факультетов (часть I, занятия 1- 9)
Тюмень - 2009
Практическое пособие по биологической химии для студентов лечебного и педиатрического факультетов (часть I). Авторы: Бышевский А.Ш., Леонова О.Ф., Тажудинова С.И., ГОУ ВПО Тюм
|
|||||||||||||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 391; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.156.26 (0.02 с.) |

 0.4
0.4