
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
III. По степени сложности молекулыСодержание книги Поиск на нашем сайте
1. Простые (состоят только из АК). 2. Сложные (в состав белка входит небелковое вещество — простетическая группа). ФУНКЦИИ ПЕПТИДОВ 1. Регуляторная (пептиды ренин-ангиотензивной системы и др.). 2. Гормоны (окситоцин, инсулин, глюкагон). 3. Антибиотики (пенициллин, цефалоспорины). 4. Токсины (аманитотоксин). 5. Антиоксиданты (глутатион). 6. Нейропептиды (энкефалины, эндорфины — обезболивающий эффект).
- протеиногенные, которые кодируются генетическим кодом (20); - непротеиногенные (более 150). Протеиногенные АК являются a-АК (кроме пролина). КЛАССИФИКАЦИЯ АК I. По строению радикала 1. Алифатические (гли, ала, вал, лей, илей). 2. Гидроксиаминокислоты (сер, тре). 3. Дикарбоновые (асп, глу). 4. Амиды дикарбоновых кислот (асн, глн). 5. Серосодержащие (мет, цис). 6. Циклические (фен, тир, три, гис). 7. Диаминомонокарбоновые (лиз, арг). 8. Иминокислота (про). II. По кислотно-основным свойствам 1. Нейтральные. 2. Кислые. 3. Основные. III. По полярности 1. Неполярные (ала, вал, лей, мет, про, иле, три, фен). 2. Полярные: а) незаряженные (сер, тре, цис, гли, тир,асн, глн); б) заряженные: - отрицательно заряженные (глу, асп); - положительно заряженные (лиз, арг, гис). Нестандартные АК в составе белков: - g-карбоксиглутаминовая кислота (протромбин: свертывание крови); - 4-гидроксипролин, 5-гидроксилизин (белки соединительной ткани: коллаген); - десмозин (конденсация 4-х молекул лизина: соединительная ткань); - дийодтирозин (гормоны щитовидной железы).
СВОЙСТВА АМИНОКИСЛОТ Кислотно-основные свойства Амфотерность Аминокислоты имеют 2 функциональные группы с противоположными свойствами: кислую карбоксильную и основную аминогруппу. Поэтому в водном растворе аминокислоты существуют в виде биполярного иона.
При добавлении в раствор аминокислот дополнительного количества протонов Нейтральные аминокислоты в воде не имеют заряда. Дикарбоновые аминокислоты имеют две карбоксильные группы, которые диссоциируют, отдавая 2 протона, но поскольку у них только одна аминогруппа, принимающая один протон, то такие аминокислоты ведут себя как кислоты и раствор их имеет кислую реакцию. Сам ион аминокислоты заряжается отрицательно.
Добавляя к раствору аминокислоты определенное количество кислоты или щелочи, можно изменить их заряд. При определенном значении pH наступает такое состояние, при котором заряд аминокислоты становится нейтральным. Такое значение pH получило название изоэлектрической точки (ИЭТ). При значении pH, равном изоэлектрической точке, аминокислоты не перемещаются в электрическом поле. Если pH ниже изоэлектрической точки, катион аминокислоты движется к катоду, а при pH выше ИЭТ анион аминокислоты — к аноду. На этих свойствах аминокислот основана возможность разделения их в электрическом поле (электрофорез). Кислые аминокислоты имеют ИЭТ в слабокислой среде, основные — в слабоосновной, а нейтральные — в нейтральной. 2. Обусловлена наличием у аминокислоты ассиметричного атома углерода (называется хиральный центр). ▪ по абсолютной конфигурации (эталон — глицериновый альдегид).
Спектральные свойства Все аминокислоты поглощают свет в инфракрасной области спектра. Три циклических аминокислоты (фенилаланин, тирозин и триптофан) поглощают свет в ультрафиолетовой области при
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 400; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.64.210 (0.006 с.) |

 Главные составные части белка — аминокислоты.
Главные составные части белка — аминокислоты.
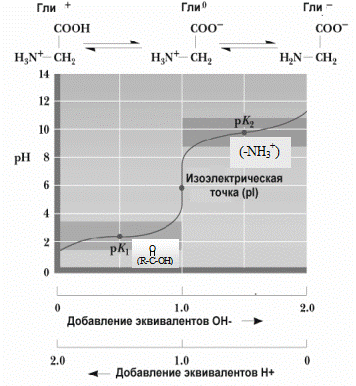 Диаминомонокарбоновые аминокислоты реагируют в водном растворе как слабые основания, так как один протон, который освобождается при диссоциации карбоксильной группы таких аминокислот, связывается с одной из аминогрупп, а вторая аминогруппа связывает протон из водного окружения, в результате увеличивается количество OH– групп и повышается pH. Заряд иона таких аминокислот будет положительным.
Диаминомонокарбоновые аминокислоты реагируют в водном растворе как слабые основания, так как один протон, который освобождается при диссоциации карбоксильной группы таких аминокислот, связывается с одной из аминогрупп, а вторая аминогруппа связывает протон из водного окружения, в результате увеличивается количество OH– групп и повышается pH. Заряд иона таких аминокислот будет положительным. Стереоизомерия
Стереоизомерия АК могут быть L- или D-стереоизомеры. В состав белков организма входят L-стереоизомеры аминокислот.
АК могут быть L- или D-стереоизомеры. В состав белков организма входят L-стереоизомеры аминокислот.


