
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
I. Функциональная (по функции, выполняемой в организме)Содержание книги
Поиск на нашем сайте
СОДЕРЖАНИЕ
ПРЕДИСЛОВИЕ................................................................................................................................................................................ 4 СТРУКТУРА И ФУНКЦИИ БЕЛКОВ И ПЕПТИДОВ. СЛОЖНЫЕ БЕЛКИ..................................................................... 5 МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БЕЛКОВ И ПЕПТИДОВ............................................................................ 13 БЕЛКИ СОЕДИНИТЕЛЬНОЙ ТКАНИ 18 ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ. СВОЙСТВА ФЕРМЕНТОВ........................................................................................ 24 РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ.......................................................................................................................... 28 ВВЕДЕНИЕ В МЕТАБОЛИЗМ. ЦЕНТРАЛЬНЫЕ МЕТАБОЛИЧЕСКИЕ ПУТИ.......................................................... 32 ТКАНЕВОЕ ДЫХАНИЕ, ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ........................................................................ 41 ПЕРЕВАРИВАНИЕ, ВСАСЫВАНИЕ, поступление В КЛЕТКУ УГЛЕВОДОВ. ГЛИКОЛИЗ. АЭРОБНОЕ ОКИСЛЕНИЕ ГЛЮКОЗЫ. ГЛЮКОНЕОГЕНЕЗ................................................................... 55 ПЕНТОЗОФОСФАТНЫЙ И глюкуроновЫЙ ПУТИ ОБМЕНА ГЛЮКОЗЫ........................................................... 61 ПЕРЕВАРИВАНИЕ ЛИПИДОВ, СИСТЕМА ИХ ДОСТАВКИ В КЛЕТКИ..................................................................... 65 ТРАНСПОРТ ЛИПИДОВ В КРОВИ, ДЕПОНИРОВАНИЕ И МОБИЛИЗАЦИЯ ЛИПИДОВ ВНУТРИКЛЕТОЧНЫЙ МЕТАБОЛИЗМ ЖИРНЫХ КИСЛОТ.......................................................................................... 73 СИНТЕЗ И НАРУШЕНИЯ ОБМЕНА ХОЛЕСТЕРОЛА. МЕТАБОЛИЗМ КЕТОНОВЫХ ТЕЛ................................. 78 СИСТЕМА СВЁРТЫВАНИЯ КРОВИ....................................................................................................................................... 83 Оценка состояния обмена белков, ПРОТЕОЛИЗ.............................................................................................. 89 ВНУТРИКЛЕТОЧНЫЙ ОБМЕН АМИНОКИСЛОТ............................................................................................................. 91 ХИМИЯ НУКЛЕОПРОТЕИНОВ................................................................................................................................................ 96 ОБМЕН НУКЛЕОПРОТЕИНОВ.............................................................................................................................................. 100 БИОСИНТЕЗ ДНК, РНК И БЕЛКА......................................................................................................................................... 105 СОВРЕМЕННЫЕ МЕТОДЫ МОЛЕКУЛЯРНОЙ БИОЛОГИИ....................................................................................... 111 ГОРМОНЫ. ОБЩИЙ МЕХАНИЗМ ДЕЙСТВИЯ ГОРМОНОВ....................................................................................... 113 ГОРМОНЫ — ПРОИЗВОДНЫЕ БЕЛКОВ, ПЕПТИДОВ И АМИНОКИСЛОТ........................................................... 118 СТЕРОИДНЫЕ ГОРМОНЫ...................................................................................................................................................... 125 БИОХИМИЯ ПИТАНИЯ (МИКРО- И МАКРОЭЛЕМЕНТЫ).......................................................................................... 129 БИОХИМИЯ ПИТАНИЯ. ВИТАМИНЫ И ДРУГИЕ НЕЗАМЕНИМЫЕ ФАКТОРЫ ПИТАНИЯ. БИОХИМИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ И ОРГАНОВ ПОЛОСТИ РТА................................................................ 141 БИОХИМИЯ РОТОВОЙ ЖИДКОСТИ................................................................................................................................... 144 БИОХИМИЯ ПЕЧЕНИ................................................................................................................................................................ 149 БИОХИМИЯ МЫШЕЧНОЙ ТКАНИ...................................................................................................................................... 154
ПРЕДИСЛОВИЕ
Необходимость в составлении данного учебно-методического пособия вызвана стремлением преподавателей кафедры облегчить усвоение лекционного материала по биологической химии иностранными студентами стоматологического факультета. С этой целью в данном учебно-методическом пособии было решено сконцентрировать рисунки, схемы, графики, основные понятия, определения, изложенный простым языком краткий текст лекций, то есть все то, что призвано максимально облегчить понимание изучаемого материала. В издание включены все лекции курса для студентов стоматологического факультета (30). Однако приводимый материал ни в коей мере не подменяет присутствие иностранных студентов на лекциях. Во-первых, есть возможность поработать с текстом накануне прослушивания лекции. Это поможет иностранным учащимся преодолеть трудности в понимании излагаемого материала. Во-вторых, во время чтения лекций данное издание может быть использовано для записи не вошедшего в него материала. Авторы будут благодарны всем, кто посчитает возможным высказать свое мнение о пользе и целесообразности настоящего пособия, сделать критические замечания и высказать пожелания по его улучшению.
От имени авторского коллектива зав. кафедрой биологической химии, профессор А.Д. Таганович СТРУКТУРА И ФУНКЦИИ БЕЛКОВ И ПЕПТИДОВ. Белки — высокомолекулярные природные полимеры, состоящие из аминокислотных остатков, соединенных пептидной связью; являются главной составной частью живых организмов и молекулярной основой процессов жизнедеятельности.
КЛАССИФИКАЦИЯ БЕЛКОВ
I. Функциональная (по функции, выполняемой в организме) 1. Каталитическая (более 3000 белков — ферменты). 2. Сократительная (актин, миозин и т. д.). 3. Структурная (белки плазматических мембран, коллаген, эластин и др.). 4. Транспортная (транспорт веществ в крови и клетке: гемоглобин, цитохром с, липопротеины и др.). 5. Защитная (антитела, иммуноглобулины). 6. Регуляторная (факторы роста и дифференцировки клеток и др.). 7. Гормональная (гормоны гипоталамуса, гормон роста и др.). 8. Буферная (гемоглобиновый белковый буфер, поддержание рН крови). 9. Резервная или запасная (казеин, овальбумин и др.). 10. Токсины (ботулинический, холерный). 11. Антибиотики (неокарциностатин и др.). 12. Рецепторная (родопсин, хеморецепторы и др.). 13. Белки, поддерживающие онкотическое давление в клетках и крови. 14. Энергетическая (в очень малой степени, т. к. продукты гидролиза белка служат источником энергии только в особых условиях, например, при голодании). II. По форме молекулы 1. Глобулярные или шаровидные (альбумины, глобулины). 2. Фибриллярные или нитевидные (коллаген). III. По степени сложности молекулы 1. Простые (состоят только из АК). 2. Сложные (в состав белка входит небелковое вещество — простетическая группа). ФУНКЦИИ ПЕПТИДОВ 1. Регуляторная (пептиды ренин-ангиотензивной системы и др.). 2. Гормоны (окситоцин, инсулин, глюкагон). 3. Антибиотики (пенициллин, цефалоспорины). 4. Токсины (аманитотоксин). 5. Антиоксиданты (глутатион). 6. Нейропептиды (энкефалины, эндорфины — обезболивающий эффект).
- протеиногенные, которые кодируются генетическим кодом (20); - непротеиногенные (более 150). Протеиногенные АК являются a-АК (кроме пролина). КЛАССИФИКАЦИЯ АК I. По строению радикала 1. Алифатические (гли, ала, вал, лей, илей). 2. Гидроксиаминокислоты (сер, тре). 3. Дикарбоновые (асп, глу). 4. Амиды дикарбоновых кислот (асн, глн). 5. Серосодержащие (мет, цис). 6. Циклические (фен, тир, три, гис). 7. Диаминомонокарбоновые (лиз, арг). 8. Иминокислота (про). II. По кислотно-основным свойствам 1. Нейтральные. 2. Кислые. 3. Основные. III. По полярности 1. Неполярные (ала, вал, лей, мет, про, иле, три, фен). 2. Полярные: а) незаряженные (сер, тре, цис, гли, тир,асн, глн); б) заряженные: - отрицательно заряженные (глу, асп); - положительно заряженные (лиз, арг, гис). Нестандартные АК в составе белков: - g-карбоксиглутаминовая кислота (протромбин: свертывание крови); - 4-гидроксипролин, 5-гидроксилизин (белки соединительной ткани: коллаген); - десмозин (конденсация 4-х молекул лизина: соединительная ткань); - дийодтирозин (гормоны щитовидной железы).
СВОЙСТВА АМИНОКИСЛОТ Кислотно-основные свойства Амфотерность Аминокислоты имеют 2 функциональные группы с противоположными свойствами: кислую карбоксильную и основную аминогруппу. Поэтому в водном растворе аминокислоты существуют в виде биполярного иона.
При добавлении в раствор аминокислот дополнительного количества протонов Нейтральные аминокислоты в воде не имеют заряда. Дикарбоновые аминокислоты имеют две карбоксильные группы, которые диссоциируют, отдавая 2 протона, но поскольку у них только одна аминогруппа, принимающая один протон, то такие аминокислоты ведут себя как кислоты и раствор их имеет кислую реакцию. Сам ион аминокислоты заряжается отрицательно.
Добавляя к раствору аминокислоты определенное количество кислоты или щелочи, можно изменить их заряд. При определенном значении pH наступает такое состояние, при котором заряд аминокислоты становится нейтральным. Такое значение pH получило название изоэлектрической точки (ИЭТ). При значении pH, равном изоэлектрической точке, аминокислоты не перемещаются в электрическом поле. Если pH ниже изоэлектрической точки, катион аминокислоты движется к катоду, а при pH выше ИЭТ анион аминокислоты — к аноду. На этих свойствах аминокислот основана возможность разделения их в электрическом поле (электрофорез). Кислые аминокислоты имеют ИЭТ в слабокислой среде, основные — в слабоосновной, а нейтральные — в нейтральной. 2. Обусловлена наличием у аминокислоты ассиметричного атома углерода (называется хиральный центр). ▪ по абсолютной конфигурации (эталон — глицериновый альдегид).
Спектральные свойства Все аминокислоты поглощают свет в инфракрасной области спектра. Три циклических аминокислоты (фенилаланин, тирозин и триптофан) поглощают свет в ультрафиолетовой области при Сложные белки
Многие белки в своем составе, помимо аминокислот, могут содержать и небелковые компоненты. Эти соединения в составе белков называют простетической группой. Простетические группы с белком соединяются разными типами связей. В зависимости от химического состава простетической группы сложные белки можно разделить на несколько классов. 1. Хромопротеины. Это белки, простетическая группа которых имеет окраску. К ним относятся многие белки, содержащие металлы. Например, церулоплазмин — белок, содержащий медь, имеет синюю окраску. Белки, содержащие железо: гемоглобин, миоглобин, цитохромы. Они имеют красную окраску. Присутствие витамина B2 придает белкам желтый цвет (флавопротеины). Простетическая группа хромопротеинов связана с гистидином полипептидной цепи координационными связями. 2. Гликопротеины. Это белки, простетическая группа которых содержит углеводы. Углевод соединяется с белковой частью ковалентными связями. В соединении с углеводом участвует OH-группа аминокислоты серина или треонина. Гликопротеины — это часть белково-углеводных комплексов. Этим белкам принадлежит важная роль в структурной организации клеток и тканей, они выполняют защитные функции. Основная часть внеклеточных белков — это гликопротеины. 3. Липопротеины. Это белки, простетическая группа которых содержит липиды. Они обеспечивают транспорт липидов в крови, являются компонентами биологических мембран. Связи между белковой частью молекулы и липидом — гидрофобные или ионные. 4. Металлопротеины. Это белки, простетическая группа которых представлена металлами. Они транспортируют или участвуют в депонировании металлов (ферритин, трансферрин). Между белком и простетической группой образуются координационные связи. 5. Нуклеопротеины. Простетическая группа у таких белков — нуклеиновая кислота. Различают дезоксирибонуклеопротеины (простетическая группа — ДНК) и рибонуклеопротеины (простетичесая группа — РНК). Им принадлежит важная роль в хранении, передаче и реализации генетической информации. Между белком и молекулой нуклеиновой кислоты образуются ионные связи. 6. Фосфопротеины. Белки, которые содержат в своем составе фосфорную кислоту. Используются для регуляции процессов жизнедеятельности (фосфорилирование / дефосфорилирование). Между белком и остатком фосфорной кислоты формируются сложноэфирные связи, в образовании которых участвует OH-группа серина.
МЕТОДЫ РАЗДЕЛЕНИЯ БЕЛКОВ Гель-хроматография Хроматографическую колонку заполняют гранулами геля (сефадекс), который имеет поры определенной величины. В колонку вносят смесь белков. Белки, размер которых меньше, чем размер пор сефадекса, задерживаются в колонке, так как «застревают» в порах, а остальные свободно выходят из колонки. Размер белка зависит от его молекулярной массы.
Ультрацентрифугирование Этот метод основан на различной скорости седиментации (осаждения) белковых молекул в растворах с различным градиентом плотности (сахарозный буфер или хлорид цезия).
Электрофорез Данный метод основан на различной скорости миграции белков и пептидов в электрическом поле в зависимости от заряда. Носителями для электрофореза могут служить гели, ацетатцеллюлоза, агар. Разделяемые молекулы движутся в геле в зависимости от размера: те из них, которые имеют большие размеры, будут задерживаться при прохождении через поры геля. Меньшие молекулы будут встречать меньшее сопротивление и, соответственно, двигаться быстрее. В результате, после проведения электрофореза, большие молекулы будут находиться ближе к старту, чем меньшие.
Методом электрофореза можно разделить белки по молекулярной массе. Для этого используют электрофорез в ПААГ в присутствии додецилсульфата натрия (ДДS-Na).
Аффинная хроматография Метод основан на способности белков прочно связываться с различными молекулами нековалентными связями. Используется для выделения и очистки ферментов, иммуноглобулинов, рецепторных белков. Молекулы веществ (лиманды), с которыми специфически связываются определенные белки, ковалентно соединяют с частицами инертного вещества. Смесь белков вносят в колонку и искомый белок прочно присоединяется к лиганду. Остальные белки свободно выходят из колонки. Задержанный белок затем можно вымыть из колонки с помощью буферного раствора, содержащего в свободном состоянии лиганд. Этот высокочувствительный метод позволяет выделить в чистом виде очень малые количества белка из клеточного экстракта, содержащего сотни других белков.
Используется пластина с амфолином — веществом, у которого заранее сформирован градиент pH. Проводят сначала электрофорез в горизонтальном направлении. Белки разделяются в зависимости от заряда (изоэлектрическая точка). Затем обрабатывают пластину раствором ДДС-Na и проводят электрофорез в вертикальном направлении. Белки разделяются в зависимости от молекулярной массы. Анализ гомологичных белков Гомологичные белки — белки, которые выполняют одну и ту же функцию, но различаются по первичной структуре (например, локализованы в различных органах или образуются при патологических состояниях). Например, HbA (содержит Glu) Þ HbS (содержит Val) при серповидноклеточной анемии. Метод пептидных карт (отпечатков пальцев),предложенный Ингремом. Этапы: 1) оба анализируемых белка расщепляют на фрагменты (пептиды); 2) смесь пептидов каждого белка наносят в виде пятна на угол листа хроматографической бумаги; 3) проводят электрофорез в горизонтальном направлении; 4) проводят распределительную хроматографию в вертикальном направлении; 5) полученные карты окрашивают и сравнивают; 6) различающиеся пептидные пятна выделяют и анализируют.
БЕЛКИ соединительных тканей (Молекулы внеклеточного матрикса) Главный компонент внеклеточного матрикса — белки. Выделяют 3 группы белков: ▪ протеогликаны (ПГ); ▪ фибриллярные структурные белки (семейства коллагена и эластина); ▪ фибриллярные адгезивные белки (семейства фибронектина и ламинина). Все эти белки содержат углеводы, поэтому относятся к сложным белкам и называются белково-углеводные комплексы (БУК). БУК классифицируются по 2 критериям: количеству углеводов в комплексе и качественному углеводному составу: ▪ протеогликаны (свыше 95% углеводов); ▪ мукопротеины (10–50% углеводов); ▪ гликопротеины (менее 10% углеводов). ПГ — это белковые комплексы, в которых с молекулами белка ковалентно связаны гликозаминогликаны (ГАГ). Белки ПГ называют коровыми белками (core — сердцевина, стержень). ГАГ — гетерополисахариды, построенные по стандартному принципу: состоят из многократно повторяющихся дисахаридов, мономерами которых являются уроновые кислоты и гексозамины. Классифицируют ГАГ по строению остатков моносахаридов, типу связи между ними, числу и локализации сульфатных групп. Выделяют несколько семейств ГАГ: 1)гиалуронаты; 2)хондроитин- и дерматансульфаты; 3)кератансульфаты; 4)гепарин и гепарансульфаты. Строение главного ПГ хрящевой ткани — агрекана:
Функции ПГ: 1) структурные компоненты внеклеточного матрикса; 2) специфически взаимодействуют с коллагеном, эластином, фибронектином, ламинином и другими белками матрикса; 3) как полианионы, они связывают поликатионы и катионы; 4) обеспечивают тургор (упругость) различных тканей, связывая воду; 5) противостоят компрессионным силами; 6) влияют на клеточную миграцию; 7) действуют как антикоагулянты. Гликопротеины и мукопротеины часто считают синонимами, так как различия между ними касаются лишь количества углеводов в комплексе, а моносахариды глико- и мукопротеинов одинаковы: галактоза, манноза, гексозамины, нейраминовая и сиаловая кислоты. Функции мукопротеинов: 1) как компоненты секретов слизистых оболочек, они обладают защитными свойствами, уменьшая трение соприкасающихся поверхностей; 2) обеспечивают групповую, видовую и тканевую специфичность; 3) обладают ферментативной активностью. Функции гликопротеинов: 1) являются структурными компонентами мембраны клетки, коллагеновых, эластиновых и фибриновых волокон, костного матрикса; 2) транспортные молекулы для витаминов, липидов, микроэлементов; 3) обеспечивают иммунную защиту; 4) обладают гормональной и ферментативной активностью (тиротропин, факторы свертывания крови). В зависимостиот типа связи между углеводной и белковой частями БУК различают 2 типа БУК: · БУК с О-гликозидной связью между углеводом и СЕР, ТРЕ, гидроксиЛИЗ (ОН-ЛИЗ) белковой молекулы; · БУК с N-гликозидной связью между углеводом и амидным азотом АСН белковой молекулы. Белковые части обоих типов БУК синтезируются по законам матричного синтеза, а углеводные части — нематрично по двум механизмам: · углеводная цепь для БУК с О-гликозидной связью образуется путем постепенного добавления моносахаридов к синтезированной белковой части с помощью ферментов гликозилтрансфераз, обдадающих очень большой специфичностью; · углеводная цепь для БУК с N-гликозидной связью синтезируется на специальной матрице — долихоле (полиизопреновое соединение) — и только затем присоединяется к синтезированной белковой части. Распад БУК катализируется с помощью ферментов лизосом. Белковую часть расщепляют протеиназы, а углеводную цепь — гликозидазы. При врожденных дефектах гликозидаз возникают заболевания — мукополисахаридозы (болезни накопления БУК, лизосомные болезни). Строение фермента
По сложности строения белковой молекулы выделяют простые (однокомпонентные) ферменты, состоящие только из белковой части, и сложные (двухкомпонентные) ферменты, имеющие кроме белковой части (апофермента) и небелковую часть (кофермент). В этом случае сложный фермент часто называют холофермент. Кофермент часто называют кофактором или простетической группой. Отличие заключается в характере связывания с апоферментом. Кофермент связывается с ним нековалентными связями, а кофактор (простетическая группа) — ковалентными. Коферменты выполняют следующие функции: а) являются посредниками между ферментом и субстратом; б) непосредственно участвуют в акте катализа, выполняя чаще всего роль промежуточного переносчика групп, участвующих в реакции; в) стабилизируют апофермент. Роль коферментов могут выполнять как органические, так и неорганические соединения. Различают: а) коферменты алифатического ряда (липоевая кислота); б) коферменты ароматического ряда (убихинон); в) коферменты — производные водорастворимых витаминов (ТПФ, ПФ); г) коферменты-нуклеотиды (НАД+, ФАД); д) коферменты-металлы (Zn, Co, Mg). В строении белковой части фермента можно выделить ряд функциональных доменов, обеспечивающих главные функции фермента: а) домен, обеспечивающий связь с коферментом (в двухкомпонентных ферментах); б) домен, обеспечивающий взаимодействие с регулятором (регулируемые ферменты) и др. Обязательным для всех ферментов является домен — активный центр фермента. Он образуется из остатков аминокислот, находящихся в составе различных участков полипептидной цепи или различных полипептидных цепей, но пространственно сближающихся при образовании пространственной структуры белка-фермента. В активном центре выделяют: а) способствующие группы; б) контактный (якорный) участок; в) каталитический участок; г) вспомогательные группы. Белковая природа ферментов придает им ряд особенностей, отличающих их от обычных катализаторов. Эти особенности ферментов называют общими свойствами ферментов. К ним относятся: ▪ высокая молекулярная активность (ферменты могут ускорять реакцию в 108–1012 раз); ▪ высокая специфичность ферментов к субстратам (субстратная специфичность) и к типу катализируемой реакции (реакционная специфичность); ▪ высокая чувствительность ферментов к неспецифическим физико-химическим факторам среды — температуре, рН, ионной силе раствора и т. д.; ▪ высокая чувствительность к химическим реагентам; ▪ возможность регуляции активности. Важное условие, характеризующее действие фермента, — специфичность взаимодействия. Различают несколько типов специфичности: а) абсолютная — фермент катализирует превращение строго определенного вещества (уреаза расщепляет только мочевину на СО2 и NH3); б) стереохимическая — фермент катализирует превращение только одного стереоизомера при наличии рацемата (L-оксидазы превращают L-аминокислоты, но не D-амино-кислоты); в) групповая абсолютная специфичность — фермент катализиpyет превращения группы субстратов, имеющих одинаковую химическую группу, связанную одним типом химических связей (например, метилэстеразы действуют на субстраты, в которых метильная группа связана эфирной связью); г) групповой относительной специфичностью обладают ферменты, для которых важен только тип связи. Существуют две модели, объясняющие специфичность: модель Фишера — «ключ – замок» и модель Кошланда — индуцированного взаимодействия. Влияние ингибиторов Ингибиторы ферментов — это вещества, замедляющие ферментативные реакции.
Конкурентные (изостерические) ингибиторы имеют следующие характеристики: а) они похожи по структуре на субстрат (изо — подобный); б) эффект конкурентного ингибитора может быть устранен избытком субстрата (Vmax не изменяется, а соответствующая Km увеличивается). Как субстрат, так и ингибитор связываются с ферментом в одном и том же участке, и связывание там одного из них исключает связывание второго. Неконкурентные ингибиторы имеют следующие характеристики: а) ингибитор не похож по структуре на субстрат; б) эффект неконкурентного ингибитора не может быть устранен избытком субстрата (Vmax уменьшается, а Km остается неизменной). Связывание ингибитора с ферментом не влияет на связывание субстрата с ферментом. Ингибитор может связываться как с ферментом, так и с фермент-субстратным комплексом, но только ES-комплекс (а не ESI-комплекс) ведет к образованию продукта. По аналогии с изостерическими этот вид ингибиторов должен быть назван аллостерическим (аллос — иной, другой), однако термин «аллостерический» закрепился за регуляторами, действующими на мультимерные ферменты, субъединицы которых кооперативно реагируют на присоединение или удаление регулятора. Примеры использования ингибиторов в медицинской практике При лечении заболеваний микробной этиологии — сульфаниламидные препараты структурно подобны парааминобензойной кислоте и тормозят образование фолиевой кислоты, необходимой для роста микроорганизмов. При отравлении антифризом (этиленгликолем) дают противоядие — этиловый спирт в больших дозах, играющий роль конкурентного ингибитора. Для лечения подагры используют вышеупомянутый аллопуринол (необратимый ингибитор). Для лечения алкоголизма используют эспераль — необратимый ингибитор оксидазы уксусного альдегида, что тормозит превращение альдегида в уксусную кислоту. Накапливающийся альдегид оказывает сильное токсическое действие. Для лечения панкреатита применяют контрикал — необратимый ингибитор протеолитических ферментов поджелудочной железы — для предотвращения «самопереваривания» железы. Причины гиперферментемий 1. Увеличение скорости синтеза фермента в клетках. 2. Увеличение количества клеток, синтезирующих фермент. 3. Повышение проницаемости клеточных мембран. 4. Некроз (гибель) клеток. СОДЕРЖАНИЕ
ПРЕДИСЛОВИЕ................................................................................................................................................................................ 4 СТРУКТУРА И ФУНКЦИИ БЕЛКОВ И ПЕПТИДОВ. СЛОЖНЫЕ БЕЛКИ..................................................................... 5 МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ БЕЛКОВ И ПЕПТИДОВ............................................................................ 13 БЕЛКИ СОЕДИНИТЕЛЬНОЙ ТКАНИ 18 ВВЕДЕНИЕ В ЭНЗИМОЛОГИЮ. СВОЙСТВА ФЕРМЕНТОВ........................................................................................ 24 РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ.......................................................................................................................... 28 ВВЕДЕНИЕ В МЕТАБОЛИЗМ. ЦЕНТРАЛЬНЫЕ МЕТАБОЛИЧЕСКИЕ ПУТИ.......................................................... 32 ТКАНЕВОЕ ДЫХАНИЕ, ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ........................................................................ 41 ПЕРЕВАРИВАНИЕ, ВСАСЫВАНИЕ, поступление В КЛЕТКУ УГЛЕВОДОВ. ГЛИКОЛИЗ. АЭРОБНОЕ ОКИСЛЕНИЕ ГЛЮКОЗЫ. ГЛЮКОНЕОГЕНЕЗ................................................................... 55 ПЕНТОЗОФОСФАТНЫЙ И глюкуроновЫЙ ПУТИ ОБМЕНА ГЛЮКОЗЫ........................................................... 61 ПЕРЕВАРИВАНИЕ ЛИПИДОВ, СИСТЕМА ИХ ДОСТАВКИ В КЛЕТКИ..................................................................... 65 ТРАНСПОРТ ЛИПИДОВ В КРОВИ, ДЕПОНИРОВАНИЕ И МОБИЛИЗАЦИЯ ЛИПИДОВ ВНУТРИКЛЕТОЧНЫЙ МЕТАБОЛИЗМ ЖИРНЫХ КИСЛОТ.......................................................................................... 73 СИНТЕЗ И НАРУШЕНИЯ ОБМЕНА ХОЛЕСТЕРОЛА. МЕТАБОЛИЗМ КЕТОНОВЫХ ТЕЛ................................. 78 СИСТЕМА СВЁРТЫВАНИЯ КРОВИ....................................................................................................................................... 83 Оценка состояния обмена белков, ПРОТЕОЛИЗ.............................................................................................. 89 ВНУТРИКЛЕТОЧНЫЙ ОБМЕН АМИНОКИСЛОТ............................................................................................................. 91 ХИМИЯ НУКЛЕОПРОТЕИНОВ................................................................................................................................................ 96 ОБМЕН НУКЛЕОПРОТЕИНОВ.............................................................................................................................................. 100 БИОСИНТЕЗ ДНК, РНК И БЕЛКА......................................................................................................................................... 105 СОВРЕМЕННЫЕ МЕТОДЫ МОЛЕКУЛЯРНОЙ БИОЛОГИИ....................................................................................... 111 ГОРМОНЫ. ОБЩИЙ МЕХАНИЗМ ДЕЙСТВИЯ ГОРМОНОВ....................................................................................... 113 ГОРМОНЫ — ПРОИЗВОДНЫЕ БЕЛКОВ, ПЕПТИДОВ И АМИНОКИСЛОТ........................................................... 118 СТЕРОИДНЫЕ ГОРМОНЫ...................................................................................................................................................... 125 БИОХИМИЯ ПИТАНИЯ (МИКРО- И МАКРОЭЛЕМЕНТЫ).......................................................................................... 129 БИОХИМИЯ ПИТАНИЯ. ВИТАМИНЫ И ДРУГИЕ НЕЗАМЕНИМЫЕ ФАКТОРЫ ПИТАНИЯ. БИОХИМИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ И ОРГАНОВ ПОЛОСТИ РТА................................................................ 141 БИОХИМИЯ РОТОВОЙ ЖИДКОСТИ................................................................................................................................... 144 БИОХИМИЯ ПЕЧЕНИ................................................................................................................................................................ 149 БИОХИМИЯ МЫШЕЧНОЙ ТКАНИ...................................................................................................................................... 154
ПРЕДИСЛОВИЕ
Необходимость в составлении данного учебно-методического пособия вызвана стремлением преподавателей кафедры облегчить усвоение лекционного материала по биологической химии иностранными студентами стоматологического факультета. С этой целью в данном учебно-методическом пособии было решено сконцентрировать рисунки, схемы, графики, основные понятия, определения, изложенный простым языком краткий текст лекций, то есть все то, что призвано максимально облегчить понимание изучаемого материала. В издание включены все лекции курса для студентов стоматологического факультета (30). Однако приводимый материал ни в коей мере не подменяет присутствие иностранных студентов на лекциях. Во-первых, есть возможность поработать с текстом накануне прослушивания лекции. Это поможет иностранным учащимся преодолеть трудности в понимании излагаемого материала. Во-вторых, во время чтения лекций данное издание может быть использовано для записи не вошедшего в него материала. Авторы будут благодарны всем, кто посчитает возможным высказать свое мнение о пользе и целесообразности настоящего пособия, сделать критические замечания и высказать пожелания по его улучшению.
От имени авторского коллектива зав. кафедрой биологической химии, профессор А.Д. Таганович СТРУКТУРА И ФУНКЦИИ БЕЛКОВ И ПЕПТИДОВ. Белки — высокомолекулярные природные полимеры, состоящие из аминокислотных остатков, соединенных пептидной связью; являются главной составной частью живых организмов и молекулярной основой процессов жизнедеятельности.
КЛАССИФИКАЦИЯ БЕЛКОВ
I. Функциональная (по функции, выполняемой в организме) 1. Каталитическая (более 3000 белков — ферменты). 2. Сократительная (актин, миозин и т. д.). 3. Структурная (белки плазматических мембран, коллаген, эластин и др.). 4. Транспортная (транспорт веществ в крови и клетке: гемоглобин, цитохром с, липопротеины и др.). 5. Защитная (антитела, иммуноглобулины). 6. Регуляторная (факторы роста и дифференцировки клеток и др.). 7. Гормональная (гормоны гипоталамуса, гормон роста и др.). 8. Буферная (гемоглобиновый белковый буфер, поддержание рН крови). 9. Резервная или запасная (казеин, овальбумин и др.). 10. Токсины (ботулинический, холерный). 11. Антибиотики (неокарциностатин и др.). 12. Рецепторная (родопсин, хеморецепторы и др.). 13. Белки, поддерживающие онкотическое давление в клетках и крови. 14. Энергетическая (в очень малой степени, т. к. продукты гидролиза белка служат источником энергии только в особых условиях, например, при голодании). II. По форме молекулы 1. Глобулярные или шаровидные (альбумины, глобулины). 2. Фибриллярные или нитевидные (коллаген).
|
|||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 410; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.36.4 (0.018 с.) |

 Главные составные части белка — аминокислоты.
Главные составные части белка — аминокислоты.
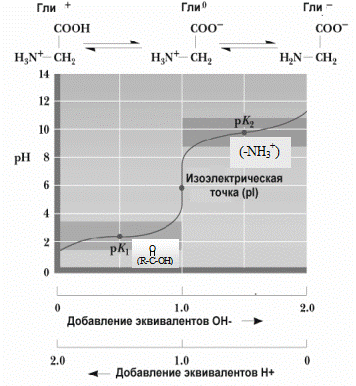 Диаминомонокарбоновые аминокислоты реагируют в водном растворе как слабые основания, так как один протон, который освобождается при диссоциации карбоксильной группы таких аминокислот, связывается с одной из аминогрупп, а вторая аминогруппа связывает протон из водного окружения, в результате увеличивается количество OH– групп и повышается pH. Заряд иона таких аминокислот будет положительным.
Диаминомонокарбоновые аминокислоты реагируют в водном растворе как слабые основания, так как один протон, который освобождается при диссоциации карбоксильной группы таких аминокислот, связывается с одной из аминогрупп, а вторая аминогруппа связывает протон из водного окружения, в результате увеличивается количество OH– групп и повышается pH. Заряд иона таких аминокислот будет положительным. Стереоизомерия
Стереоизомерия АК могут быть L- или D-стереоизомеры. В состав белков организма входят L-стереоизомеры аминокислот.
АК могут быть L- или D-стереоизомеры. В состав белков организма входят L-стереоизомеры аминокислот.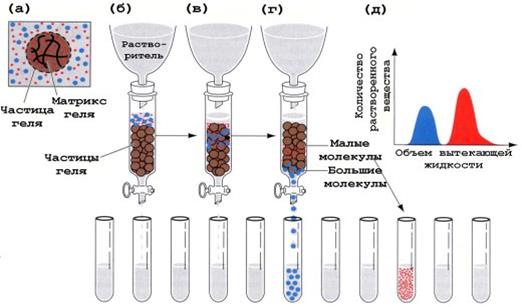


 Додецилсульфат натрия (ДДС-Na)
Додецилсульфат натрия (ДДС-Na)

 Изоэлектрофокусирование
Изоэлектрофокусирование




