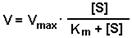Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Единицы измерения активностиСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Катал — это количество фермента, которое обеспечивает превращение 1 моля субстрата за 1 секунду. Стандартная единица (U) — это количество фермента, которое превращает 1 мкмоль субстрата за 1 минуту. 1 U = 16,67 нкатал (нанокатал). В медицине активность ферментов выражают чаще всего в единицах активности на Удельная активность — выражается в единицах активности, рассчитанной на 1 мг белка.
Наивысшую активность ферменты обычно проявляют в очень узком интервале температур (40–50°С). До этого интервала с повышением температуры скорость катализируемой ферментами реакции повышается. Выше оптимальной температуры активность ферментов снижается, а при температуре 50–60°С совершенно прекращается — фермент инактивируется (существуют термоустойчивые ферменты).
Для каждого фермента существует определенное значение рН, при котором его действие оптимально. Объясняется это зависимостью диссоциации ионогенных групп фермента или субстрата от реакции среды. Активность фермента зависит от определенного состояния (ионизированного или неионизированного) активного центра. На рисунке показаны два фермента с различными рН оптимумами. Влияние концентрации субстрата
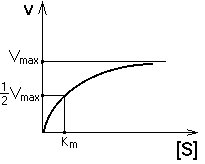 Исследование влияния концентрации субстрата на активность фермента позволило во многом объяснить механизм действия фермента. При постоянной концентрации фермента начальная скорость реакции растет пропорционально увеличению концентрации субстрата (реакция первого порядка для низких концентраций субстрата). При высоких концентрациях скорость реакции достигает своего максимального значения (Vmax) и не зависит от концентрации субстрата (реакция нулевого порядка). Эта кривая описывается уравнением Михаэлиса-Ментен: Исследование влияния концентрации субстрата на активность фермента позволило во многом объяснить механизм действия фермента. При постоянной концентрации фермента начальная скорость реакции растет пропорционально увеличению концентрации субстрата (реакция первого порядка для низких концентраций субстрата). При высоких концентрациях скорость реакции достигает своего максимального значения (Vmax) и не зависит от концентрации субстрата (реакция нулевого порядка). Эта кривая описывается уравнением Михаэлиса-Ментен:
Км — это константа Михаэлиса. Она численно равна той концентрации субстрата, при которой скорость реакции составляет половину от максимального значения. С помощью Км можно характеризовать сродство данного фермента к данному субстрату. Чем меньше Км, тем больше сродство фермента к данному субстрату. Если Км высока, то это означает, что сродство фермента к такому субстрату низкое и реакция при небольших концентрациях субстрата протекает неэффективно. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ Принципы регуляции химических процессов в клетке Изменить скорость химического процесса в клетке можно путем: а) изменения количества субстрата или продукта реакции (регуляция проницаемости мембран); б) изменения количества фермента (регуляция синтеза белков); в) изменения активности фермента. Ниже будут приведены механизмы регуляции активности фермента. Можно выделить три основных принципа специфической регуляции активности ферментов: изостерическая регуляция, аллостерическая регуляция и ковалентная модификация структуры ферментов. Влияние ингибиторов Ингибиторы ферментов — это вещества, замедляющие ферментативные реакции.
Конкурентные (изостерические) ингибиторы имеют следующие характеристики: а) они похожи по структуре на субстрат (изо — подобный); б) эффект конкурентного ингибитора может быть устранен избытком субстрата (Vmax не изменяется, а соответствующая Km увеличивается). Как субстрат, так и ингибитор связываются с ферментом в одном и том же участке, и связывание там одного из них исключает связывание второго. Неконкурентные ингибиторы имеют следующие характеристики: а) ингибитор не похож по структуре на субстрат; б) эффект неконкурентного ингибитора не может быть устранен избытком субстрата (Vmax уменьшается, а Km остается неизменной). Связывание ингибитора с ферментом не влияет на связывание субстрата с ферментом. Ингибитор может связываться как с ферментом, так и с фермент-субстратным комплексом, но только ES-комплекс (а не ESI-комплекс) ведет к образованию продукта. По аналогии с изостерическими этот вид ингибиторов должен быть назван аллостерическим (аллос — иной, другой), однако термин «аллостерический» закрепился за регуляторами, действующими на мультимерные ферменты, субъединицы которых кооперативно реагируют на присоединение или удаление регулятора.
|
|||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 699; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.234.68 (0.008 с.) |

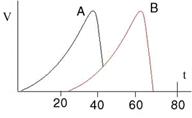 Влияние температуры
Влияние температуры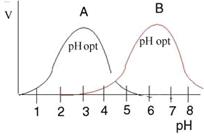 Влияние рН
Влияние рН