
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Превращение белков в желудке. Роль соляной кислоты в переваривании белков. Показать действие пептидгидролаз. Качественный и количественный анализ желудочного содержимого.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Расщепление белков до аминокислот начинается в желудке, продолжается в двенадцатиперстной кишке и заканчивается в тонком кишечнике. В некоторых случаях распад белков и превращения аминокислот могут происходить также в толстом кишечнике под влиянием микрофлоры. Протеолитические ферменты подразделяют по особенности их действия на экзопептидазы, отщепляющие концевые аминокислоты, и эндопептидазы, действующие на внутренние пептидные связи. В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся две группы протеаз с разным оптимумом рН, которые упрощенно называют пепсин и гастриксин. У грудных детей основным ферментом является реннин. Одним из компонентов желудочного сока является соляная кислота. В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, образующие ионы Н+. Источником ионов Н+ является угольная кислота, образуемая ферментом карбоангидразой. При ее диссоциациии, кроме ионов водорода, образуются карбонат-ионы НСО3–. Они по градиенту концентрации движутся в кровь в обмен на ионы Сl–. В полость желудка ионы Н+ попадают энергозависимым антипортом с ионами К+(Н+,К+-АТФаза), хлорид-ионы перекачиваются в просвет желудка также с затратой энергии.При нарушении нормальной секреции HCl возникают гипоацидный или гиперацидныйгастрит, отличающиеся друг от друга по клиническим проявлениям, последствиям и требуемой схеме лечения. Функции соляной кислоты: денатурация белков пищи; бактерицидное действие; высвобождение железа из комплекса с белками и перевод в двухвалентную форму, что необходимо для его всасывания; превращение неактивного пепсиногена в активный пепсин; снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина; после перехода в 12-перстную кишку – стимуляция секреции панкреатического сока. 32. Переваривание белков в кишечнике. Покажите действие трипсина, карбокси-и аминопептидазы на конкретных примерах. Покинув желудок, пища подвергается действию панкреатического сока, кишечного сока и желчи. Сок поджелудочной железы содержит проферменты – трипсиноген, химотрипсиноген, прокарбоксипептидазы, проэластазу. Проферменты в просвете кишечника активируются до трипсина, химотрипсина, карбоксипептидаз и эластазы, соответственно, способомограниченного протеолиза. Указанные ферменты осуществляют основную работу по перевариванию белков. В кишечном соке активны дипептидазы и аминопептидазы. Они заканчивают переваривание белков. Трипсин, химотрипсин, эластаза являются эндопептидазами. Карбоксипептидазы и аминопептидазы – экзопептидазы. Синтезируемый в поджелудочной железе трипсиноген в двенадцатиперстной кишке подвергается частичному протеолизу под действием фермента энтеропептидазы, секретируемой клетками кишечного эпителия. От профермента отделяется гексапептид (Вал-Асп-Асп-Асп-Асп-Лиз), что приводит к формированию активного центра трипсина. Трипсин специфичен к пептидным связям, образованным с участием карбоксильных групплизина и аргинина. Трипсин может осуществлять аутокатализ, т.е. превращение последующих молекул трипсиногена в трипсин, также он активирует остальные протеолитические ферменты панкреатического сока – химотрипсиноген, проэластазу, прокарбоксипептидазу.Параллельно трипсин участвует в переваривании пищевых липидов, активируя фермент переваривания фосфолипидов – фосфолипазу А2, и колипазу фермента липазы, отвечающей за гидролиз триацилглицеролов. Карбоксипептидазы являются экзопептидазами, т.е. гидролизуют пептидные связи с С-конца пептидной цепи. Различают два типа карбоксипептидаз – карбоксипептидазы А и карбоксипептидазы В. Карбоксипептидазы А отщепляют с С-конца остатки алифатическихи ароматических аминокислот, карбоксипептидазы В – остатки лизина и аргинина. Являясь экзопептидазами, аминопептидазы отщепляют N-концевые аминокислоты. Важными представителями являются аланинаминопептидаза и лейцинаминопептидаза, обладающие широкой специфичностью. Например, лейцинаминопептидаза отщепляет с N-конца белка не только лейцин, но и ароматические аминокислоты и гистидин. 33. Гниение белков и аминокислот в кишечнике. Пути образования продуктов гниения. Примеры. Аминокислоты и недопереваренные фрагменты белков достигают толстого кишечника, где подвергаются воздействию кишечной микрофлоры. Такой процесс получил названиегниение белков в кишечнике. При этом образуются продукты разложения аминокислот, представляющие собой как токсины (кадаверин, путресцин, крезол, фенол, скатол, индол, пиперидин, пирролидин, сероводород, метилмеркаптан (СН3SН) и другие), так инейромедиаторы (серотонин, гистамин, октопамин, тирамин). Всасываясь в кровь, эти вещества вызывают общую интоксикацию, колебания артериального давления, головные боли, понижение аппетита, понижение болевой чувствительности, анемии, миокардиодистрофии, нарушение желудочной секреции, в тяжелых случаях возможны
34. Механизм обезвреживания продуктов гниения белков. Роль ФАФС и УДФ-ГК в этом процессе (конкретные примеры). В процессе распада серосодержащих аминокислот (цистин,цистеин, метионин) в кишечнике образуются сероводород H2S и метил-меркаптан CH3SH. Диаминокислоты –орнитин и лизин – подвергаются процессу декарбоксилирования с образованием аминов – путресцина и кадаверина. Из ароматических аминокислот: фенилаланин, тирозин и триптофан – при аналогичном бактериальномдекарбоксилировании образуются соответствующие амины: фенилэтиламин, параоксифенилэтиламин (или тира-мин) и индолилэтиламин (триптамин). Кроме того, микробные ферменты кишечника вызывают постепенное разрушение боковых цепей циклических аминокислот, в частности тирозина и триптофана, с образованием ядовитых продуктов обмена – соответственно крезола и фенола, скатола и индола. После всасывания эти продукты через воротную вену попадают в печень, где подвергаются обезвреживанию путем химического связывания с серной или глюкуроновой кислотой с образованием нетоксичных, так называемых парных, кислот (например, фенолсерная кислота или ска-токсилсерная кислота). Последние выделяются с мочой. Механизм обезвреживания этих продуктов изучен детально. В печени содержатся специфические ферменты – арилсульфотрансфераза и УДФ-глюкоронилтран-сфераза, катализирующие соответственно перенос остатка серной кислоты из ее связанной формы – 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) и остатка глюкуроновой кислоты также из ее связанной формы – уридил-дифосфоглюкуроновой кислоты (УДФГК) на любой из указанных продуктов. Индол (как и скатол) предварительно подвергается окислению в индоксил (соответственно скатоксил), который взаимодействует непосредственно в ферментативной реакции с ФАФС или с УДФГК. Так, индолсвязывается в виде эфиросерной кислоты. Калиевая соль этой кислоты получила название животного индикана, который выводится с мочой (см. главу 18). По количеству индикана в моче человека можно судить не только о скорости процесса гниения белков в кишечнике, но и о функциональном состоянии печени. О функции печени и ее роли в обезвреживании токсичных продуктов часто также судят по скорости образования и выделения гип-пуровой кислоты с мочой после приема бензойной кислоты. Таким образом, организм человека и животных обладает рядом защитных механизмов синтеза, биологическая роль которых заключается в обезвреживании токсичных веществ, поступающих в организм извне или образующихся в кишечнике из пищевых продуктов в результате жизнедеятельности микроорганизмов. Переаминирование и декарбоксилирование аминокислот. Химизм процессов, характеристика ферментов и коферментов. Образование амидов. Механизм реакции трансаминирования (переаминирования) непрост и протекает по типу "пинг-понг". Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6).В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию.
Чаще всего аминокислоты взаимодействуют со следующими кетокислотами:пировиноградной с образованием аланина; щавелевоуксусной с образованием аспартата; α-кетоглутаровой с образованием глутамата. Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты. Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование. Аммиак непрерывно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы. Основными источниками аммиака являются следующие реакции:неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени; окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках; дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и почках; катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани;жизнедеятельность бактерий толстого кишечника; распад пуриновых и пиримидиновых оснований – во всех тканях. 36. Дезаминирование аминокислот. Виды дезаминирования. Окислительное дезаминирование. Непрямое дезаминирование аминокислот на примере тирозина. Превращение аминокислот с участием NH2-группы сводится к ее отщеплению от углеродного скелета – реакции дезаминирования.
внутримолекулярное – с образованием ненасыщенной жирной кислоты:
восстановительное – с образованием насыщенной жирной кислоты:
гидролитическое – с образованием карбоновой гидроксикислоты:
окислительное – с образованием кетокислот:
У человека окислительное дезаминирование является основным путем катаболизма аминокислот. Однако такие аминокислоты как серин и гистидин могут терять аминогруппу с использованием других типов дезаминирования, а треонин сразу подвергается прямому расщеплению до глицина и ацетальдегида. У человека основным способом дезаминирования является окислительное дезаминирование. Выделяют два варианта окислительного дезаминирования: прямое инепрямое.
2. Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой, превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). Этот тип дезаминирования теснейшим образом связан с трансаминированием аминокислот и формирует с ним процесстрансдезаминирования (см ниже). Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма. Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты – этот перенос называется трансаминирование и его механизм довольно сложен. В качестве кетокислоты-акцептора в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат. В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О. При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться для синтеза глюкозы в глюконеогенезе. Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование. В организме человека дезаминированию подвергается только глутаминовая кислота. Второй этап осуществляется глутаматдегидрогеназой.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование. Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза.
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1692; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.01 с.) |

 угнетение дыхания, сердечной деятельности и кома.
угнетение дыхания, сердечной деятельности и кома.
 Весь перенос аминогруппы совершается в две стадии:к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат. На второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфатрегенерирует.
Весь перенос аминогруппы совершается в две стадии:к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат. На второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфатрегенерирует. Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота.
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота.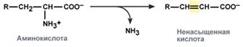 Типы дезаминирования
Типы дезаминирования


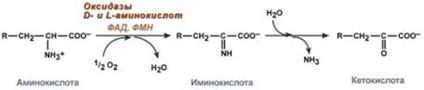 Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное) и не нуждаться в кислороде (анаэробное).
Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное) и не нуждаться в кислороде (анаэробное). 1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. В организме человека эти ферменты присутствуют, но практически неактивны.
1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. В организме человека эти ферменты присутствуют, но практически неактивны.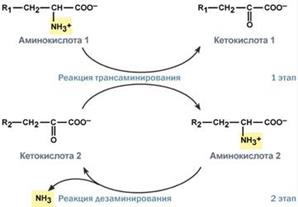 В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма, кроме мышечных.
В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма, кроме мышечных. Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН.


