Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Небелковые азотистые компоненты крови (остаточный азот).Содержание книги
Поиск на нашем сайте
Состав и функции крови. Кровь - жидкая подвижная ткань, циркулирующая в замкнутой системе кровеносных сосудов, транспортирующая различные химические вещества к органам и тканям, и осуществляющая интеграцию метаболических процессов, протекающих в различных клетках. Кровь состоит из плазмы и форменных элементов (эритроцитов, лейкоцитов и тромбоцитов). Сыворотка крови отличается от плазмы отсутствием фибриногена. 90% плазмы крови составляет вода, 10% - сухой остаток, в состав которого входят белки, небелковые азотистые компоненты (остаточный азот), безазотистые органические компоненты и минеральные вещества. Белки плазмы крови. Плазма крови содержит сложную многокомпонентную (более 100) смесь белков, различающихся по происхождению и функциям. Большинство белков плазмы синтезируется в печени. Иммуноглобулины и ряд других защитных белков иммунокомпетентными клетками. Содержание общего белка в сыворотке крови здорового человека составляет 65 - 85 г/л (в плазме крови этот показатель на 2 – 4 г/л выше за счёт фибриногена). 30.2.1. Белковые фракции. При помощи высаливания белков плазмы можно выделить альбуминовую и глобулиновую фракции. В норме соотношение этих фракций составляет 1,5 – 2,5. Использование метода электрофореза на бумаге позволяет выявить 5 белковых фракций (в порядке убывания скорости миграции): альбумины, α 1 -, α 2 -, β- и γ-глобулины. При использовании более тонких методов фракционирования в каждой фракции, кроме альбуминовой, можно выделить целый ряд белков (содержание и состав белковых фракций сыворотки крови см. рисунок 1).
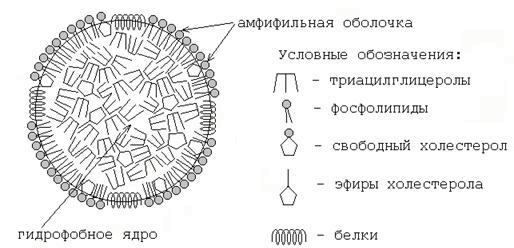
Рисунок 1. Электрофореграмма белков сыворотки крови и состав белковых фракций. Альбумины – белки с молекулярной массой около 70000 Да. Благодаря гидрофильности и высокому содержанию в плазме играют важную роль в поддержании коллоидно-осмотического (онкотического) давления крови и регуляции обмена жидкостей между кровью и тканями. Выполняют транспортную функцию: осуществляют перенос свободных жирных кислот, желчных пигментов, стероидных гормонов, ионов Са 2 +, многих лекарств. Альбумины также служат богатым и быстро реализуемым резервом аминокислот. α 1 -Глобулины: Кислый α 1 -гликопротеин (орозомукоид) – содержит до 40% углеводов, изоэлектрическая точка его находится в кислой среде (2,7). Функция этого белка до конца не установлена; известно, что на ранних стадиях воспалительного процесса орозомукоид способствует образованию коллагеновых волокон в очаге воспаления (Я.Мусил, 1985). α 1 -Антитрипсин – ингибитор ряда протеаз (трипсина, химотрипсина, калликреина, плазмина). Врождённое снижение содержания α 1 -антитрипсина в крови может быть фактором предрасположенности к бронхо-лёгочным заболеваниям, так как эластические волокна лёгочной ткани особенно чувствительны к действию протеолитических ферментов. Ретинолсвязывающий белок осуществляет транспорт жирорастворимого витамина А. Тироксинсвязывающий белок – связывает и транспортирует иодсодержащие гормоны щитовидной железы. Транскортин – связывает и транспортирует глюкокортикоидные го рмоны (кортизол, кортикостерон). α 2 -Глобулины: Гаптоглобины (25% α 2 -глобулинов) – образуют стабильный комплекс с гемоглобином, появляющимся в плазме в результате внутрисосудистого гемолиза эритроцитов. Комплексы гаптоглобин-гемоглобин поглощаются клетками РЭС, где гем и белковые цепи подвергаются распаду, а железо повторно используется для синтеза гемоглобина. Тем самым предотвращается потеря железа организмом и повреждение почек гемоглобином. Церулоплазмин – белок, содержащий ионы меди (одна молекула церулоплазмина содержит 6-8 ионов Cu 2+), которые придают ему голубую окраску. Является транспортной формой ионов меди в организме. Обладает оксидазной активностью: окисляет Fe 2+ в Fe 3+, что обеспечивает связывание железа трансферрином. Способен окислять ароматическиеамины, участвует в обмене адреналина, норадреналина, серотонина. β-Глобулины: Трансферрин – главный белок β-глобулиновой фракции, участвует в связывании и транспорте трёхвалентного железа в различные ткани, особенно в кроветворные. Трансферрин регулирует содержание Fe 3+ в крови, предотвращает избыточное накопление и потерю с мочой. Гемопексин – связывает гем и предотвращает его потерю почками. Комплекс гем-гемопексин улавливается из крови печенью. С-реактивный белок (С-РБ) – белок, способный преципитировать (в присутствии Са 2 +) С-полисахарид клеточной стенки пневмококка. Биологическая роль его определяется способностью активировать фагоцитоз и ингибировать процесс агрегации тромбоцитов. У здоровых людей концентрация С-РБ в плазме ничтожно мала и стандартными методами не определяется. При остром воспалительном процессе она увеличивается более чем в 20 раз, в этом случае С-РБ обнаруживается в крови. Исследование С-РБ имеет преимущество перед другими маркерами воспалительного процесса: определением СОЭ и подсчётом числа лейкоцитов. Данный показатель более чувствителен, его увеличение происходит раньше и после выздоровления быстрее возвращается к норме. γ-Глобулины: Иммуноглобулины (IgA, IgG, IgM, IgD, IgE) представляют собой антитела, вырабатываемые организмом в ответ на введение чужеродных веществ с антигенной активностью. Подробнее об этих белках см. 1.2.5. 30.2.2. Количественные и качественные изменения белкового состава плазмы крови. При различных патологических состояниях белковый состав плазмы крови может изменяться. Основными видами изменений являются: Гиперпротеинемия - увеличение содержания общего белка плазмы. Причины: потеря большого количества воды (рвота, диарея, обширные ожоги), инфекционные заболевания (за счёт увеличения количества γ-глобулинов). Гипопротеинемия - уменьшение содержания общего белка в плазме. Наблюдается при заболеваниях печени (вследствие нарушения синтеза белков), при заболеваниях почек (вследствие потери белков с мочой), при голодании (вследствие недостатка аминокислот для синтеза белков). Диспротеинемия - изменение процентного соотношения белковых фракций при нормальном содержании общего белка в плазме крови, например, снижение содержания альбуминов и увеличение содержания одной или нескольких глобулиновых фракций при различных воспалительных заболеваниях. Парапротеинемия - появление в плазме крови патологических иммуноглобулинов - парапротеинов, отличающихся от нормальных белков по физико-химическим свойствам и биологической активности. К таким белкам относятся, например, криоглобулины, образующие друг с другом преципитаты при температуре ниже 37° С. Парапротеины обнаруживаются в крови при макроглобулинемии Вальденстрема, при миеломной болезни (в последнем случае они могут преодолевать почечный барьер и обнаруживаться в моче как белки Бенс-Джонса). Парапротеинемия, как правило, сопровождается гиперпротеинемией. 30.2.3. Липопротеиновые фракции плазмы крови. Липопротеины - сложные соединения, осуществляющие транспорт липидов в крови. В состав их входят: гидрофобное ядро, содержащее триацилглицеролы и эфиры холестерола, и амфифильная оболочка, образованная фосфолипидами, свободным холестеролом и белками-апопротеинами (рисунок 2). В плазме крови человека содержатся следующие фракции липопротеинов:
Рисунок 2. Схема строения липопротеина плазмы крови. Липопротеины высокой плотности или α-липопротеины, так как при электрофорезе на бумаге они движутся вместе с α-глобулинами. Содержат много белков и фосфолипидов, транспортируют холестерол из периферических тканей в печень. Липопротеины низкой плотности или β-липопротеины, так как при электрофорезе на бумаге они движутся вместе с β-глобулинами. Богаты холестеролом; транспортируют его из печени в периферические ткани. Липопротеины очень низкой плотности или пре-β-липопротеины (на электрофореграмме расположены между α- и β-глобулинами). Служат транспортной формой эндогенных триацилглицеролов, являются предшественниками липопротеинов низкой плотности. Хиломикроны - электрофоретически неподвижны; в крови, взятой натощак, отсутствуют. Являются транспортной формой экзогенных (пищевых) триацилглицеролов. 30.2.4. Белки острой фазы воспаления. Это белки, содержание которых увеличивается в плазме крови при остром воспалительном процессе. К ним относятся, например, следующие белки: гаптоглобин; церулоплазмин; С-реактивный белок; α 1 -антитрипсин; фибриноген (компонент свёртывающей системы крови; см. 30.7.2). Скорость синтеза этих белков увеличивается прежде всего за счёт снижения образования альбуминов, трансферрина и альбуминов (небольшая фракция белков плазмы, обладающая наибольшей подвижностью при диск-электрофорезе, и которой соответствует полоса на электрофореграмме перед альбуминами), концентрация которых при остром воспалении снижается. Биологическая роль белков острой фазы: а) все эти белки являются ингибиторами ферментов, освобождаемых при разрушении клеток, и предупреждают вторичное повреждение тканей; б) эти белки обладают иммунодепрессорным действием (В.Л.Доценко, 1985). 30.2.5. Защитные белки плазмы крови. К белкам, выполняющим защитную функцию, относятся иммуноглобулины и интерфероны. Иммуноглобулины (антитела) - группа белков, вырабатываемых в ответ на попадание в организм чужеродных структур (антигенов). Они синтезируются в лимфоузлах и селезёнке лимфоцитами В. Выделяют 5 классов иммуноглобулинов - IgA, IgG, IgM, IgD, IgE.
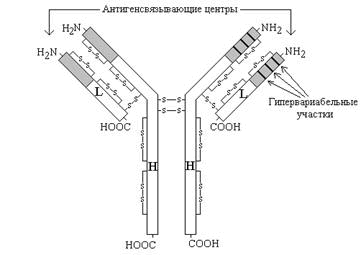
Рисунок 3. Схема строения иммуноглобулинов (серым цветом показана вариабельная область, не закрашена - константная область). Молекулы иммуноглобулинов имеют единый план строения. Структурную единицу иммуноглобулина (мономер) образуют четыре полипептидные цепи, соединённые между собой дисульфидными связями: две тяжёлые (цепи Н) и две лёгкие (цепи L) (см. рисунок 3). IgG, IgD и IgЕ по своей структуре, как правило, являются мономерами, молекулы IgM построены из пяти мономеров, IgA состоят из двух и более структурных единиц, или являются мономерами. Белковые цепи, входящие в состав иммуноглобулинов, можно условно разделить на специфические домены, или области, имеющие определённые структурные и функциональные особенности. N-концевые участки как L-, так и Н-цепей называются вариабельной областью (V), так как их структура характеризуется существенными различиями у разных классов антител. Внутри вариабельного домена имеются 3 гипервариабельных участка, отличающихся наибольшим разнообразием аминокислотной последовательности. Именно вариабельная область антител ответственна за связывание антигенов по принципу комплементарности; первичная структура белковых цепей в этой области определяет специфичность антител. С-концевые домены Н- и L-цепей обладают относительно постоянной первичной структурой в пределах каждого класса антител и называются константной областью (С). Константная область определяет свойства различных классов иммуноглобулинов, их распределение в организме, может принимать участие в запуске механизмов, вызывающих уничтожение антигенов. Интерфероны - семейство белков, синтезируемых клетками организма в ответ на вирусную инфекцию и обладающих противовирусным эффектом. Различают несколько типов интерферонов, обладающих специфическим спектром действия: лейкоцитарный (α-интерферон), фибробластный (β-интерферон) и& иммунный (γ-интерферон). Интерфероны синтезируются и секретируются одними клетками и проявляют свой эффект, воздействуя на другие клетки, в этом отношении они подобны гормонам. Механизм действия интерферонов показан на рисунке 4.
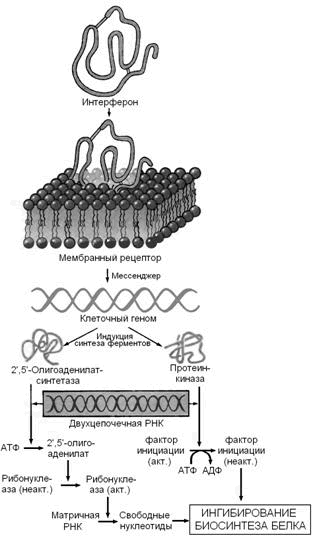
Рисунок 4. Механизм действия интерферонов (Ю.А.Овчинников, 1987). Связываясь с клеточными рецепторами, интерфероны индуцируют синтез двух ферментов — 2',5'-олигоаденилатсинтетазы и протеинкиназы, вероятно, за счет инициации транскрипции соответствующих генов. Оба образующихся фермента проявляют свою активность в присутствии двухцепочечных РНК, а именно такие РНК являются продуктами репликации многих вирусов или содержатся в их вирионах. Первый фермент синтезирует 2',5'-олигоаденилаты (из АТФ), которые активируют клеточную рибонуклеазу I; второй фермент фосфорилирует фактор инициации трансляции IF2. Конечным результатом этих процессов является ингибирование биосинтеза белка и размножения вируса в инфицированной клетке (Ю.А.Овчинников, 1987). 30.2.6. Ферменты плазмы крови. Все ферменты, содержащиеся в плазме крови, можно разделить на три группы: секреторные ферменты - синтезируются в печени, выделяются в кровь, где выполняют свою функцию (например, факторы свёртывания крови); экскреторные ферменты - синтезируются в печени, в норме выделяются с желчью (например, щелочная фосфатаза), их содержание и активность в плазме крови возрастает при нарушении оттока желчи; индикаторные ферменты - синтезируются в различных тканях и попадают в кровь при разрушении клеток этих тканей. В разных клетках преобладают различные ферменты, поэтому при повреждении того или иного органа в крови появляются характерные для него ферменты. Это может быть использовано в диагностике заболеваний. Например, при повреждении клеток печени (гепатит) в крови возрастает активность аланинаминотраноферазы (АЛТ), аспартатаминотрансферазы (ACT), изофермента лактатдегидрогеназы ЛДГ 5, глутаматдегидрогеназы, орнитинкарбамоилтрансферазы. При повреждении клеток миокарда (инфаркт) в крови возрастает активность аспартатаминотрансферазы (ACT), иэофермента лактатдегидрогеназы ЛДГ 1, изофермента креатинкиназы MB. При повреждении клеток поджелудочной железы (панкреатит) в крови возрастает активность трипсина, α-амилазы, липазы. Состав и функции крови. Кровь - жидкая подвижная ткань, циркулирующая в замкнутой системе кровеносных сосудов, транспортирующая различные химические вещества к органам и тканям, и осуществляющая интеграцию метаболических процессов, протекающих в различных клетках. Кровь состоит из плазмы и форменных элементов (эритроцитов, лейкоцитов и тромбоцитов). Сыворотка крови отличается от плазмы отсутствием фибриногена. 90% плазмы крови составляет вода, 10% - сухой остаток, в состав которого входят белки, небелковые азотистые компоненты (остаточный азот), безазотистые органические компоненты и минеральные вещества. Белки плазмы крови. Плазма крови содержит сложную многокомпонентную (более 100) смесь белков, различающихся по происхождению и функциям. Большинство белков плазмы синтезируется в печени. Иммуноглобулины и ряд других защитных белков иммунокомпетентными клетками. Содержание общего белка в сыворотке крови здорового человека составляет 65 - 85 г/л (в плазме крови этот показатель на 2 – 4 г/л выше за счёт фибриногена). 30.2.1. Белковые фракции. При помощи высаливания белков плазмы можно выделить альбуминовую и глобулиновую фракции. В норме соотношение этих фракций составляет 1,5 – 2,5. Использование метода электрофореза на бумаге позволяет выявить 5 белковых фракций (в порядке убывания скорости миграции): альбумины, α 1 -, α 2 -, β- и γ-глобулины. При использовании более тонких методов фракционирования в каждой фракции, кроме альбуминовой, можно выделить целый ряд белков (содержание и состав белковых фракций сыворотки крови см. рисунок 1).
Рисунок 1. Электрофореграмма белков сыворотки крови и состав белковых фракций. Альбумины – белки с молекулярной массой около 70000 Да. Благодаря гидрофильности и высокому содержанию в плазме играют важную роль в поддержании коллоидно-осмотического (онкотического) давления крови и регуляции обмена жидкостей между кровью и тканями. Выполняют транспортную функцию: осуществляют перенос свободных жирных кислот, желчных пигментов, стероидных гормонов, ионов Са 2 +, многих лекарств. Альбумины также служат богатым и быстро реализуемым резервом аминокислот. α 1 -Глобулины: Кислый α 1 -гликопротеин (орозомукоид) – содержит до 40% углеводов, изоэлектрическая точка его находится в кислой среде (2,7). Функция этого белка до конца не установлена; известно, что на ранних стадиях воспалительного процесса орозомукоид способствует образованию коллагеновых волокон в очаге воспаления (Я.Мусил, 1985). α 1 -Антитрипсин – ингибитор ряда протеаз (трипсина, химотрипсина, калликреина, плазмина). Врождённое снижение содержания α 1 -антитрипсина в крови может быть фактором предрасположенности к бронхо-лёгочным заболеваниям, так как эластические волокна лёгочной ткани особенно чувствительны к действию протеолитических ферментов. Ретинолсвязывающий белок осуществляет транспорт жирорастворимого витамина А. Тироксинсвязывающий белок – связывает и транспортирует иодсодержащие гормоны щитовидной железы. Транскортин – связывает и транспортирует глюкокортикоидные го рмоны (кортизол, кортикостерон). α 2 -Глобулины: Гаптоглобины (25% α 2 -глобулинов) – образуют стабильный комплекс с гемоглобином, появляющимся в плазме в результате внутрисосудистого гемолиза эритроцитов. Комплексы гаптоглобин-гемоглобин поглощаются клетками РЭС, где гем и белковые цепи подвергаются распаду, а железо повторно используется для синтеза гемоглобина. Тем самым предотвращается потеря железа организмом и повреждение почек гемоглобином. Церулоплазмин – белок, содержащий ионы меди (одна молекула церулоплазмина содержит 6-8 ионов Cu 2+), которые придают ему голубую окраску. Является транспортной формой ионов меди в организме. Обладает оксидазной активностью: окисляет Fe 2+ в Fe 3+, что обеспечивает связывание железа трансферрином. Способен окислять ароматическиеамины, участвует в обмене адреналина, норадреналина, серотонина. β-Глобулины: Трансферрин – главный белок β-глобулиновой фракции, участвует в связывании и транспорте трёхвалентного железа в различные ткани, особенно в кроветворные. Трансферрин регулирует содержание Fe 3+ в крови, предотвращает избыточное накопление и потерю с мочой. Гемопексин – связывает гем и предотвращает его потерю почками. Комплекс гем-гемопексин улавливается из крови печенью. С-реактивный белок (С-РБ) – белок, способный преципитировать (в присутствии Са 2 +) С-полисахарид клеточной стенки пневмококка. Биологическая роль его определяется способностью активировать фагоцитоз и ингибировать процесс агрегации тромбоцитов. У здоровых людей концентрация С-РБ в плазме ничтожно мала и стандартными методами не определяется. При остром воспалительном процессе она увеличивается более чем в 20 раз, в этом случае С-РБ обнаруживается в крови. Исследование С-РБ имеет преимущество перед другими маркерами воспалительного процесса: определением СОЭ и подсчётом числа лейкоцитов. Данный показатель более чувствителен, его увеличение происходит раньше и после выздоровления быстрее возвращается к норме. γ-Глобулины: Иммуноглобулины (IgA, IgG, IgM, IgD, IgE) представляют собой антитела, вырабатываемые организмом в ответ на введение чужеродных веществ с антигенной активностью. Подробнее об этих белках см. 1.2.5. 30.2.2. Количественные и качественные изменения белкового состава плазмы крови. При различных патологических состояниях белковый состав плазмы крови может изменяться. Основными видами изменений являются: Гиперпротеинемия - увеличение содержания общего белка плазмы. Причины: потеря большого количества воды (рвота, диарея, обширные ожоги), инфекционные заболевания (за счёт увеличения количества γ-глобулинов). Гипопротеинемия - уменьшение содержания общего белка в плазме. Наблюдается при заболеваниях печени (вследствие нарушения синтеза белков), при заболеваниях почек (вследствие потери белков с мочой), при голодании (вследствие недостатка аминокислот для синтеза белков). Диспротеинемия - изменение процентного соотношения белковых фракций при нормальном содержании общего белка в плазме крови, например, снижение содержания альбуминов и увеличение содержания одной или нескольких глобулиновых фракций при различных воспалительных заболеваниях. Парапротеинемия - появление в плазме крови патологических иммуноглобулинов - парапротеинов, отличающихся от нормальных белков по физико-химическим свойствам и биологической активности. К таким белкам относятся, например, криоглобулины, образующие друг с другом преципитаты при температуре ниже 37° С. Парапротеины обнаруживаются в крови при макроглобулинемии Вальденстрема, при миеломной болезни (в последнем случае они могут преодолевать почечный барьер и обнаруживаться в моче как белки Бенс-Джонса). Парапротеинемия, как правило, сопровождается гиперпротеинемией. 30.2.3. Липопротеиновые фракции плазмы крови. Липопротеины - сложные соединения, осуществляющие транспорт липидов в крови. В состав их входят: гидрофобное ядро, содержащее триацилглицеролы и эфиры холестерола, и амфифильная оболочка, образованная фосфолипидами, свободным холестеролом и белками-апопротеинами (рисунок 2). В плазме крови человека содержатся следующие фракции липопротеинов:
Рисунок 2. Схема строения липопротеина плазмы крови. Липопротеины высокой плотности или α-липопротеины, так как при электрофорезе на бумаге они движутся вместе с α-глобулинами. Содержат много белков и фосфолипидов, транспортируют холестерол из периферических тканей в печень. Липопротеины низкой плотности или β-липопротеины, так как при электрофорезе на бумаге они движутся вместе с β-глобулинами. Богаты холестеролом; транспортируют его из печени в периферические ткани. Липопротеины очень низкой плотности или пре-β-липопротеины (на электрофореграмме расположены между α- и β-глобулинами). Служат транспортной формой эндогенных триацилглицеролов, являются предшественниками липопротеинов низкой плотности. Хиломикроны - электрофоретически неподвижны; в крови, взятой натощак, отсутствуют. Являются транспортной формой экзогенных (пищевых) триацилглицеролов. 30.2.4. Белки острой фазы воспаления. Это белки, содержание которых увеличивается в плазме крови при остром воспалительном процессе. К ним относятся, например, следующие белки: гаптоглобин; церулоплазмин; С-реактивный белок; α 1 -антитрипсин; фибриноген (компонент свёртывающей системы крови; см. 30.7.2). Скорость синтеза этих белков увеличивается прежде всего за счёт снижения образования альбуминов, трансферрина и альбуминов (небольшая фракция белков плазмы, обладающая наибольшей подвижностью при диск-электрофорезе, и которой соответствует полоса на электрофореграмме перед альбуминами), концентрация которых при остром воспалении снижается. Биологическая роль белков острой фазы: а) все эти белки являются ингибиторами ферментов, освобождаемых при разрушении клеток, и предупреждают вторичное повреждение тканей; б) эти белки обладают иммунодепрессорным действием (В.Л.Доценко, 1985). 30.2.5. Защитные белки плазмы крови. К белкам, выполняющим защитную функцию, относятся иммуноглобулины и интерфероны. Иммуноглобулины (антитела) - группа белков, вырабатываемых в ответ на попадание в организм чужеродных структур (антигенов). Они синтезируются в лимфоузлах и селезёнке лимфоцитами В. Выделяют 5 классов иммуноглобулинов - IgA, IgG, IgM, IgD, IgE.
Рисунок 3. Схема строения иммуноглобулинов (серым цветом показана вариабельная область, не закрашена - константная область). Молекулы иммуноглобулинов имеют единый план строения. Структурную единицу иммуноглобулина (мономер) образуют четыре полипептидные цепи, соединённые между собой дисульфидными связями: две тяжёлые (цепи Н) и две лёгкие (цепи L) (см. рисунок 3). IgG, IgD и IgЕ по своей структуре, как правило, являются мономерами, молекулы IgM построены из пяти мономеров, IgA состоят из двух и более структурных единиц, или являются мономерами. Белковые цепи, входящие в состав иммуноглобулинов, можно условно разделить на специфические домены, или области, имеющие определённые структурные и функциональные особенности. N-концевые участки как L-, так и Н-цепей называются вариабельной областью (V), так как их структура характеризуется существенными различиями у разных классов антител. Внутри вариабельного домена имеются 3 гипервариабельных участка, отличающихся наибольшим разнообразием аминокислотной последовательности. Именно вариабельная область антител ответственна за связывание антигенов по принципу комплементарности; первичная структура белковых цепей в этой области определяет специфичность антител. С-концевые домены Н- и L-цепей обладают относительно постоянной первичной структурой в пределах каждого класса антител и называются константной областью (С). Константная область определяет свойства различных классов иммуноглобулинов, их распределение в организме, может принимать участие в запуске механизмов, вызывающих уничтожение антигенов. Интерфероны - семейство белков, синтезируемых клетками организма в ответ на вирусную инфекцию и обладающих противовирусным эффектом. Различают несколько типов интерферонов, обладающих специфическим спектром действия: лейкоцитарный (α-интерферон), фибробластный (β-интерферон) и& иммунный (γ-интерферон). Интерфероны синтезируются и секретируются одними клетками и проявляют свой эффект, воздействуя на другие клетки, в этом отношении они подобны гормонам. Механизм действия интерферонов показан на рисунке 4.
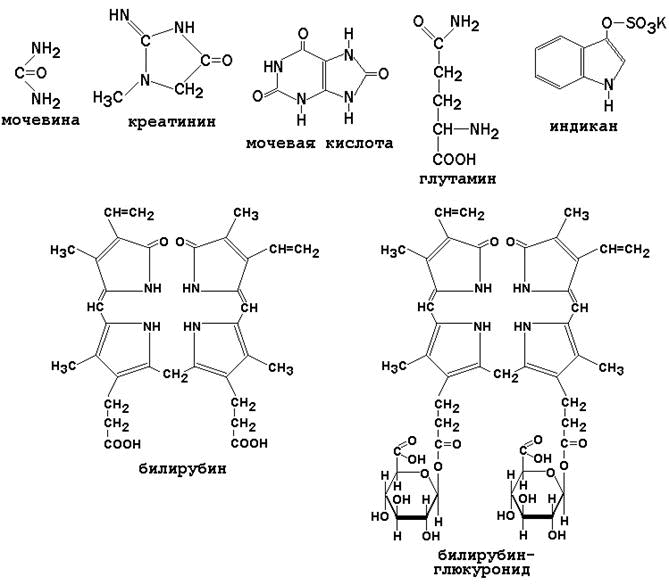
Рисунок 4. Механизм действия интерферонов (Ю.А.Овчинников, 1987). Связываясь с клеточными рецепторами, интерфероны индуцируют синтез двух ферментов — 2',5'-олигоаденилатсинтетазы и протеинкиназы, вероятно, за счет инициации транскрипции соответствующих генов. Оба образующихся фермента проявляют свою активность в присутствии двухцепочечных РНК, а именно такие РНК являются продуктами репликации многих вирусов или содержатся в их вирионах. Первый фермент синтезирует 2',5'-олигоаденилаты (из АТФ), которые активируют клеточную рибонуклеазу I; второй фермент фосфорилирует фактор инициации трансляции IF2. Конечным результатом этих процессов является ингибирование биосинтеза белка и размножения вируса в инфицированной клетке (Ю.А.Овчинников, 1987). 30.2.6. Ферменты плазмы крови. Все ферменты, содержащиеся в плазме крови, можно разделить на три группы: секреторные ферменты - синтезируются в печени, выделяются в кровь, где выполняют свою функцию (например, факторы свёртывания крови); экскреторные ферменты - синтезируются в печени, в норме выделяются с желчью (например, щелочная фосфатаза), их содержание и активность в плазме крови возрастает при нарушении оттока желчи; индикаторные ферменты - синтезируются в различных тканях и попадают в кровь при разрушении клеток этих тканей. В разных клетках преобладают различные ферменты, поэтому при повреждении того или иного органа в крови появляются характерные для него ферменты. Это может быть использовано в диагностике заболеваний. Например, при повреждении клеток печени (гепатит) в крови возрастает активность аланинаминотраноферазы (АЛТ), аспартатаминотрансферазы (ACT), изофермента лактатдегидрогеназы ЛДГ 5, глутаматдегидрогеназы, орнитинкарбамоилтрансферазы. При повреждении клеток миокарда (инфаркт) в крови возрастает активность аспартатаминотрансферазы (ACT), иэофермента лактатдегидрогеназы ЛДГ 1, изофермента креатинкиназы MB. При повреждении клеток поджелудочной железы (панкреатит) в крови возрастает активность трипсина, α-амилазы, липазы. Небелковые азотистые компоненты крови (остаточный азот). К этой группе веществ относятся: мочевина, мочевая кислота, аминокислоты, креатин, креатинин, аммиак, индикан, билирубин и другие соединения (см. рисунок 5). Содержание остаточного азота в плазме крови здоровых людей - 15-25 ммоль/л. Повышение содержания остаточного азота в крови называется азотемией. В зависимости от причины, азотемия подразделяется на ретенционную и продукционную. Ретенционная азотемия возникает при нарушении выведения продуктов азотистого обмена (в первую очередь мочевины) с мочой и характерна для недостаточности функции почек. В этом случае до 90% небелкового азота крови приходится на азот мочевины вместо 50% в норме. Продукционная азотемия развивается при избыточном поступлении азотистых веществ в кровь вследствие усиленного распада тканевых белков (длительное голодание, сахарный диабет, тяжёлые ранения и ожоги, инфекционные заболевания). Определение остаточного азота проводят в в безбелковом фильтрате сыворотки крови. В результате минерализации безбелкового фильтрата при нагревании с концентрированной Н 2 SO 4 азот всех небелковых соединений переходит в форму (NH 4) 2 SO 4. Ионы NH 4 + определяют с помощью реактива Несслера. Мочевина - главный конечный продукт обмена белков в организме человека. Образуется в результате обезвреживания аммиака в печени, выводится из организма почками. Поэтому содержание мочевины в крови снижается при заболеваниях печени и возрастает при почечной недостаточности. Аминокислоты - поступают в кровь при всасывании из желудочно-кишечного тракта или являются продуктами распада тканевых белков. В крови здоровых людей среди аминокислот преобладают аланин и глутамин, которые наряду с участием в биосинтезе белков являются транспортными формами аммиака. Мочевая кислота - конечный продукт катаболизма пуриновых нуклеотидов. Содержание её в крови возрастает при подагре (в результате усиленного образования) и при нарушениях функции почек (из-за недостаточного выведения). Креатин - синтезируется в почках и печени, в мышцах превращается в креатинфосфат - источник энергии для процессов мышечного сокращения. При заболеваниях мышечной системы содержание креатина в крови значительно возрастает. Креатинин - конечный продукт азотистого обмена, образуется в результате дефосфорилирования креатинфосфата в мышцах, выводится из организма почками. Содержание креатинина в крови снижается при заболеваниях мышечной системы, повышается при почечной недостаточности. Индикан - продукт обезвреживания индола, образуется в печени, выводится почками. Содержание его в крови снижается при заболеваниях печени, повышается - при усилении процессов гниения белков в кишечнике, при заболеваниях почек. Билирубин (прямой и непрямой) - продукты катаболизма гемоглобина. Содержание билирубина в крови увеличивается при желтухах: гемолитической (за счёт непрямого билирубина), обтурационной (за счёт прямого билирубина), паренхиматозной (за счёт обеих фракций).
Рисунок 5. Небелковые азотистые соединения плазмы крови.
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 631; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.120.64 (0.012 с.) |