
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизм действия буферных системСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Билет 16. Основные положения теории растворов сильных электролитов Дебая – Хюккеля. Активность, коэффициент активности ионов. Ионная сила раствора. Кажущаяся степень диссоциации. Электролиты в организме.
Основные положения теории Дебая – Хюккеля: 1. Ионы – материальные точки с зарядами, т.е. размеры их значительно меньше расстояний между ними (в разбавленных растворах) 2. Взаимодействие между ионами носит чисто кулоновский характер(ион – дипольное взаимодействие с молекулами растворителя и образование ассоциатов не учитывается) 3. Диэлектрическая проницаемость раствора равна диэлектрической проницаемости растворителя 4. Распределение ионов вокруг центрального иона подчиняется законам статистической термодинамики - распределение Больцмана (определяет распределение частиц в силовом поле в условиях теплового равновесия)
При движении ионов под действием электрического поля ион данного знака движется к противоположно заряженному электроду, а окружение его - «ионная атмосфера» тормозит движение и уменьшает подвижность иона. В результате тормозящего действия «ионных атмосфер» (межионного взаимодействия) снимается эффективность ионов в таких явлениях как перенос заряда (электрический ток) в растворах, уменьшается температура замерзания, увеличивается температура кипения. Именно поэтому определяемая, например, по электрической проводимости растворов степень диссоциации является кажущейся степенью диссоциации, т.к. онане соответствует действительной степени распада электролита на ионы.
Активность. Под активностью электролита понимают эффективную концентрацию, в соответствии с которой он участвует в различных процессах. a(X)= f(X) * c(X)
a(X) – активность электролита f(X) – коэффициент активности(величина безразмерная) c(X) – концентрация электролита
Коэффициент активности f(X) выражает отклонение раствора с концентрацией c(X) от поведения раствора при бесконечном разведении, т.е. в отсутствии межионных взаимодействий.
Если f(X) = 1, движение ионов не стеснено действием электрических сил и в этом случае ионы можно рассчитывать по формуле a(X)= f(X) * c(X)
Если f(X) < 1, на движение ионов оказывает влияние их электростат.взаимодействие и во все уравнения для закона действующих масс и вычисления коллигативных свойств раствора вместо концентрации с надо подставлять меньшую по значению активность а.
Ионной силой раствора называют величину, измеряемую полусуммой произведений концентрации всех находящихся в растворе ионов на квадрат их заряда. I=0,5[b(x1)z12 + b(x2)z22 +….+b(xn)zn2 ]
I – ионная сила b(x1), b(x2), b(x..) – моляльные концентрации ионов х1, х2, х.. z1, z2, z.. – заряды ионов х1, х2, х..
Содержанием слабых и сильных электролитов определяет кислотнощелочное равновесие в крови и биожидкостях: Na2HPO4, NaH2PO4, H2CO3, NaHCO3. Концентрация ионов регулирует распределение вод между внеклеточным пространством и мочой. Ионы играют определенную роль в создании осмотического давления различных биологических жидкостей. Особенности метаболического обмена ионов имеют большое значение для жизнедеятельности организма.
Пример: Обмен ионов К+ важен для работы нервных и мышечных клеток. При нарушении работы почек происходит уменьшение концентрации ионов К внутри клеток, что приводит к заболеванию - периодическому параличу. При восстановлении концентрации ионов паралич проходит.
Билет 17.
Теория: -кислотой называют всякое вещество молекулярные частицы которого (в том числе и ионы) способны отдавать протон, т.е.быть донором протонов. -основанием наз.всякое вещество. Молекулярные частицы которого (в т.ч. и ионы) способны присоединять протоны, т.е. быть акцептором протонов.
Согласно теории кислоты подразделяются на три вида
Основания:
Молекула и ион, отличающиеся по составу на один протон, называется сопряженной кислотно – основной парой
Теория Льюиса:
Кислотой называют вещества, частицы которых (молекулы, ионы) способны присоединять электронную пару (акцепторы электронной пары), а основаниями вещества, частицы которых способны отдаваь электронную пару (донор электронной пары).
Величина K a - это константа кислотности. Она является количественной характеристикой состояния протолитического равновесия обратимой реакции между кислотой HA и основанием HL. Величина K b - это константа оснόвности. Она является количественной характеристикой состояния протолитического равновесия в реакции между основанием B и кислотой HL. Тогда между величинами K a, K b и K s существует зависимость: K a . K b = K s = Const = f (T), в чем легко убедиться подстановкой. Это выражение позволяет рассчитывать значение K b для протолитического равновесия с участием A- и HL, если известны значения K a и K s.
Билет 18. Автопротолиз воды – одна молекула отдает протон, другая принимает, происходит автоионизация воды:
[H+] — концентрация ионов гидроксония (протонов); [OH−] — концентрация гидроксид-ионов; [H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде [H20], учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Уравнение (1) можно переписать как:
Обозначим произведение K·[H2O] = Kв (Кw)= [H+]·[OH−]=const=1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л (при 25 °C).
Константа К(H2O) называется ионным произведением или константой автоионизации воды. В чистой воде при любом водном растворе, при постоянной температуре произведение концентраций (активностей) водрод- и гидроксид – ионов есть величина постоянная называемая ионным произведением.
Водородный показатель(рН) среды:
рН = -lg [H+] или рН≈-lg[H+] отрицательный десятичный логарифм активности (концентрации) водород-ионов
К(Н2О) в водных растворах разных веществ остается неизменной, как бы не сменялись молярные концентрации ионов водрода и ионов гидроксила в водном растворе, их произведение концентрации остается неизменным.
Если водный раствор имеет нейтральную реакцию, то это означает что [H+]=[OH-]. Если концентрация ионов водорода выше, чем конц-ия ОН- ,то [H+]>[OH-], раствор имеет кислую реакцию. Наоброт – щелочную.
В качестве характеристики реакции используют концентрацию водород – тонов. Но на практике это неудобно:
В нейтр.среде [H+]=10-7 моль/л, рН=7
В кислой [H+]>10-7 моль/л, рН<7
В щелочной [H+]<10-7 моль/л, рН>7
рКW=14 – показатель константы автпротолиза
С ростом температуры степень диссоциации, а с ней и концентрации (активности) ионов водорода и ионов гидроксила, а также значение ионного произведения воды Кw увеличиваются.
Билет 19 Гидролиз солей – реакция обменногоразложения солей водой, в результате которого из ионов растворенной соли и водорода или гидроксила воды образуются молекулы слабых кислот или оснований (либо слабодиссоциирующие гидроанионыфскислых солей или гидроксикатионы основных солей) Константа гидролиза – произведение константы равновесия гидролиза на молярную концентрацию воды в разбавленном раствор
Степень гидролиза измеряется отношением количества гидролизованного вещества к общему количеству растворенного вещества: α г = nг/no nг- количество гидролизованной соли(моль) no – общее количество растворенного вещества
10) Соль образованная сильной кислотой НАn и слабым основанием KtOH гидролизуетя по катиону(рН<7) 11) Соль, образованная слабой кислотой и сильным основанием - гидролиз по аниону(pH>7)
12) Соль, образованная сильным основанием и сильной кислотой – гиролизу не повергается.
Константа гидролиза зависит от природы растворенной соли и температуры, но в области больших разбавлений практически не зависит от концентрации. Константа гидролиза покзывает насколько велика молярная коцентрация недиссоциированных молекул слабого основания или слабой кислоты в сравнении с концентрацией соответствующих катионов и анионов, оставшихся в растворе после установления равновесия в несвязочном с Н+ или ОН- ионами виде. Справедливы следующие закономерности: · Гидролиз соли должен усиливаться с повышением температуры и разбавлении равтвора. Для ослабления гидролиза растворы следует хранить концентрированными при низких температурах · При обратном гидролизе в соотвествии с принципом Ле Шателье процесс должен подавляться при подкислении (если эта соль образована сильной кислотой и слабым основанием, накапливаются ионы Н+) или при подщелачивании (если соль образована слабой кислотой и сильным основанием, накапливаются ионы ОН-) · Гидролиз солей, в результате которого образуются малорастворимые или газообразные продукты, удаляющиеся из сферы реакции(принцип смещеия равновесия) необратим. Например гидролиз Pb(SO4)2 протекает полностью вследствие образования осадка PbО2.
Состояние равновесия сил для реакции гидролиза может быть охарактеризовано количественно с помощью константы равновесия
Значение гидролиза в жизнедеятельности: 4) Ферментативный гидролиз – жиры, белки, углеводы расщепляются до мономеров в желудочно – кишечном тракте 5) Гидролиз АТФ – высвобождение энергии при гидролизе макроэргических веществ Гидролитические процессы вместе с процессами растворения играют важную роль в обмене веществ. С ними связано поддержание на определенном уровне кислотности крови и тканевых жидкостей. Действие многих химиотерапевтических средств связано с их кислотно – щелочными свойствами с той или иной подверженностью их гидролизу.
Билет 20
Гетерогенные реакции – химические реакции с участием веществ, находящихся в различных фазах и составляющих в совокупности гетерогенную систему.
Типичные гетерогенные реакции: термическое разложение солей с образованием газообразных и твердых продуктов, восстановление оксидов металлов водородом или углеродом, растворение Ме в кислотах и т.д.
Константа растворимости:
характеризует растворимость электролита при постоянной температуре в отсутствие посторонних веществ.
В общем случае для малорастворимого электролита KtmAnn, диссоциирующего на ионы по уравнению KtmAnn m Ktn+ + nAnm- произведение растворимости равно произведению молярных концентраций (активностей) ионов в насыщенном растворе, взятых в степенях соответствующих стехиометрических коэффициентов: (ПР) КS= [Ktn+]m [Anm-]n
с(Ktm+)n c(Ann-)m> Кs(KtnAnm)
с(Ktm+)n c(Ann-)m <Кs(KtnAnm)
21.Кислотно-основными буферными растворами называют такие растворы, рН которых сохраняется примерно постоянным при разбавлении и добавлении кислоты или основания. Буферные растворы играют большую роль в жизнедеятельности. К числу исключительных свойств живых организмов относят их способность поддерживать постоянство рН биологческихх жидкостей, тканей и органов- кислотно-основный гомеостаз. Это постоянство обусловлено наличием нескольких буферных систем, входящих в состав этих тканей. Соствав буферных систем.
БИОЛОГИЧЕСКАЯ РОЛЬ ЖЕЛЕЗА
Железо относится к тем микроэлементам, биологические функции которых изучены наиболее полно.
Значение железа для организма человека, как и в целом для живой природы, трудно переоценить. Подтверждением этому может быть не только большая распространенность его в природе, но и важная роль в сложных метаболических процессах, происходящих в живом организме. Биологическая ценность железа процессах, активным участием в клеточном дыхании, обеспечивающем нормальное функционирование тканей и организма человека.
Железо принадлежит к восьмой группе элементов периодической системы Д. И. Менделеева (атомный номер 26, атомный вес 55,847, плотность 7,86 г/см). Ценным его свойством является способность легко окисляться и восстанавливаться, образовывать сложные соединения со значительно отличающимися биохимическими свойствами, непосредственно участвовать вреакциях электронного транспорта. Гемоглобин, содержащийся в эритроцитах, выполняет важную для организма газотранспортную функцию - переносит экзогенный кислород и эндогенный углекислый газ. Эритроцит по отношению к гемоглобину играет роль буферной системы, способной регулировать общую величину газотранспортной функции.
Миоглобин - дыхательный белок сердечной и скелетной мускулатуры. Он состоит из единственной Полипептидной цепочки, содержащей 153 аминокислоты и соединенный с гемпростетической группой. Основной функцией миоглобина является транспортировка кислорода через клетку и регуляция егосодержания в мышце для осуществления сложных биохимических процессов, лежащих в основе клеточного дыхания. Он содержит 0,34% железа. Миоглобин депонирует кислород во время сокращения мышц, а при их поражении он может попадать в кровь и выделяться с мочой.
Железосодержащие ферменты и негеминовое железо клетки находится главным образом в митохондриях.
Каталаза, как и цитохромоксидаза, состоит из единственной полипептидной цепочки, соединенной с гем - группой. Она является одним из важнейших ферментов, предохраняющих эритроциты от окислительного гемолиза. Каталаза выполняет двойную функцию в зависимости от концентрации перекиси водорода в клетке. При высокой концентрации перекиси водорода фермент катализирует реакцию ее разложения, а при низкой - и в присутствии донора водорода (метанол
Пероксидаза содержится преимущественно в лейкоцитах и слизистой тонкого кишечника у человека. Она также Миелопероксидаза – железосодержащий геминовый фермент, находящийся, этанол и др.) становится
аналитические реакции ионов Fe2+ Гексацианоферрат(III) калия K3[Fe(CN)6] с катионом Fe2+ образует синий осадок «турнбулевой сини»: 3FeSO4 + 2K3[Fe(CN)6] → Fe3[Fe(CN)6]2↓+ 3K2SO4, 3Fe2+ + 2Fe(CN)63– → Fe3[Fe(CN)6]2↓. Осадок не растворяется в кислотах, но разлагается щелочами с образованием Fe(OH)2. При избытке реактива осадок приобретает зеленый оттенок. Реакции мешают ионы Fe3+, которые при большой концентрации дают с реактивом бурое окрашивание раствора, и ионы Мn2+ и Bi3+, дающие с реактивом слабоокрашенные осадки, растворимые в кислотах. Выполнение реакций. В пробирку поместить 1–2 капли раствора FeSO4 и прибавить 1 каплю реактива. Полученный осадок разделить на две части, к первой прибавить 1-2 капли 2 М раствора НС1, ко второй– 1-2 капли 2 М раствора щелочи. Условия проведения реакции – с разбавленными растворами в кислой среде, рН = 3. 1.5.2.> Окисление Fe2+ до Fe3+. Ион Fe2+ представляет собой довольно сильный восстановитель и способен окисляться при действии ряда окислителей, например, H2O2, KMnO4, K2Cr2O7 в кислой среде и др. 2Fe2+ + 4OH– + H2O2 → 2Fe(OH)3↓. При проведении систематического анализа Fe2+ следует открыть в предварительных испытаниях, т.к. в процессе разделения групп Fe2+ может окислиться до Fe3+. аналитические реакции ионов Fe3+ 1.5.3. Гексацианоферрат(II) калия K4[Fe(CN)6] с катионами Fe3+ образует темно-синий осадок «берлинской лазури»: 4Fe3+ + 3Fe(CN)64– → Fe4[Fe(CN)6]3↓. Осадок практически не растворяется в кислотах, но разлагается щелочами с образованием Fe(OH)3. В избытке реактива осадок заметно растворяется. Выполнение реакции. К 1–2 каплям раствора FeCl3 прибавить 1 каплю реактива. Полученный осадок разделить на две части. К одной части прибавить 2–3 капли 2 М раствора НС1, к другой –1-2 капли 2 М раствора NaOH, перемешать. 1.5.4. Тиоцианат (роданид) калия KNCS с ионами Fe3+ образует комплекс кроваво-красного цвета. В зависимости от концентрации тиоцианата могут образовываться комплексы различного состава: Fe3+ + NCS– ↔ Fe(NCS)2+, Fe3+ + 2NCS– ↔ Fe(NCS)2+, и т.д. до Fe3+ + 6NCS– ↔ Fe(NCS)63–, Реакция обратима, поэтому реактив берется в избытке. Определению мешают ионы, образующие с Fe3+ устойчивые комплексы, например, фторид-ионы, соли фосфорной, щавелевой и лимонной кислот.
37 Общая характеристика элементов р-блока Элементы у которых происходит достройка р-подуровня внешнего валентного уровня называют р-элементами. Электронное строение валентного уровня ns2p1-6. Валентными являются электроны s- и р-подуровней. В периодах слева направо возрастает заряд ядер, влияние которого превалирует над увеличением сил взаимного отталкивания между электронами. Поэтому потенциал ионизации, сродство к электрону, а, следовательно, и акцепторная способность и неметаллические свойства в периодах увеличиваются. Все элементы, лежащие на диагонали Вr – At и выше являются неметаллами и образуют только ковалентные соединения и анионы. Все остальные р-элементы (за исключением индия, талия, полония, висмута которые проявляют металлические свойства) являются амфотерными элементами и образуют как катионы, так и анионы, причем и те, и другие сильно гидролизуется. Большинство р-элементов-неметаллов – биогенные (исключение – благородные газы, теллур и астат). Из р-элементов - металлов – к биогенным относят только алюминий. Различия в свойствах соседних элементов, как внутри; так и по периоду: выражены значительно сильнее, чем у s-элементов. р-Элементы второго периода – азот, кислород, фтор обладают ярко выраженной способностью участвовать в образовании водородных связей. Элементы третьего и последующего периодов эту способность теряют. Их сходство заключается только в строении внешних электронных оболочек и тех валентных состояний, которые возникают за счет неспаренных электронов в невозбужденных атомах. Бор, углерод и особенно азот, сильно отличаются от остальных элементов своих групп (наличие d- и f-подуровней). Все р-элементы и в особенности р-элементы второго и третьего периодов (С, N, Р, О, S, Si, Cl) образуют многочисленные соединения между собой и с s-, d- и f-элементами. Большинство известных на Земле соединений – это соединения р-элементов. Пять главных (макробиогенных) р-элементов жизни – О, Р, С, N и S – это основной строительный материал, из которого сложены молекулы белков, жиров, углеводов и нуклеиновых кислот. Из низкомолекулярных соединений р-элементов наибольшее значение имеют оксоанионы: СО32-, НСО3-, С2O42-, СНзСОО-, РО43-, НРO42-, H2PO4-, SO42- и галогенид-ионы. р-Элементы имеют много валентных электронов, обладающих различной энергией. Поэтому в соединениях проявляют различную степень окисления. Например, углерод проявляет различные степени окисления от – 4 до +4. Азот – от -3 до +5, хлор – от -1 до +7. В процессе реакции р-элемент может отдавать и принимать электроны, выступая соответственно восстановителем или окислителем в зависимости от свойств элемента с которым вступает во взаимодействие. Это порождает широкий ассортимент образуемых ими соединений. Взаимопереход атомов р-элементов различных стпеней окисления, в том числе и за счет метаболических окислительно-восстановительвых процессов (например, окисление спиртовой группы в их альдегидную и далее в карбоксильную и так далее) вызывает богатство их химических превращений.
Фосфор в организме человека В теле человека массой 70 кг. Содержится около 780 г. фосфора. В виде фосфатов кальция фосфор присутствует в костях человека и животных. Входит он и в состав белков, фосфолипидов, нуклеиновых кислот; соединения фосфора участвуют в энергетическом обмене (аденизинтрифосфорная кислота, АТФ). Ежедневная потребность человеческого организма в фосфоре составляет 1,2 г. Основное его количество мы потребляем с молоком и хлебом (в 100 г. хлеба содержится примерно 200 мг. фосфора). Наиболее богаты фосфором рыба, фасоль и некоторые виды сыра. Интересно, что для правильного питания необходимо соблюдать баланс между количеством потребляемого фосфора и кальцием: оптимальное соотношение в этих элементах пищи составляет 1,5¸1. Избыток богатой фосфором пищи приводит к вымыванию кальция из костей, а при избытке кальция развивается мочекаменная болезнь.
Фосфор образует большое число различных оксидов и кислот. Среди них наиболее устойчивыми являются оксиды фосфора (III) и (V). Оксидфосфора (III) – Р2О3. Оксидфосфора (V), или фосфорный ангидрид P2O5 Химические свойства Р2О5:белое, сильно гигроскопичное вещество. Проявляет свойства кислотного оксида. Очень устойчив и не проявляет окислительных свойств. Фосфорнаякислота(ортофосфорная)H3PO4. Прозрачные кристаллы, tпл = 42,3 оС, с водой смешивается в любых соотношениях. Электролитсредней силы, диссоцирует ступенчато:
Cоли ортофосфорнойкислоты (фосфаты и гидрофосфаты). Являясь трехосновной кислотой, H3PO4 образует три вида солей. Все фосфаты щелочных металлов и аммония растворимы в воде. Из кальциевых солей фосфорной кислоты растворим в воде только дигидрофосфат кальция Са(H2PO4)2. Биологические свойства Высокая окисляющая способность озона и образование во многих реакциях с его участием свободных радикалов кислорода определяют его высокую токсичность. Воздействие озона на организм может приводить к преждевременной смерти[12]. Наиболее опасное воздействие высоких концентраций озона в воздухе: · на органы дыхания прямым раздражением Воздействие озона на организм может приводить к преждевременной смерти[12]; · на холестерин в крови человека с образованием нерастворимых форм, приводящим к атеросклерозу; · на органы размножения у самцов всех видов животных, в том числе и человека (вдыхание этого газа убивает мужские половые клетки и препятствует их образованию). При долгом нахождении в среде с повышенной концентрацией этот газ может стать причиной мужского бесплодия. Озон в Российской Федерации отнесён к первому, самому высокому классу опасности вредных веществ. Нормативы по озону: 3) максимальная разовая предельно допустимая концентрация (ПДК м.р.) в атмосферном воздухе населённых мест 0,16 мг/м³[13]; 4) среднесуточная предельно допустимая концентрация (ПДК с.с.) в атмосферном воздухе населённых мест 0,03 мг/м³[13]; 5) предельно допустимая концентрация (ПДК) в воздухе рабочей зоны 0,1 мг/м³. При этом, порог человеческого обоняния приближённо равен 0,01 мг/м³.[14] Озон эффективно убивает плесень и бактерии.
Применение озона Основная статья: Применение озона обусловлено его свойствами: · сильного окисляющего реагента: · для стерилизации изделий медицинского назначения · при получении многих веществ в лабораторной и промышленной практике · для отбеливания бумаги · для очистки масел · сильного дезинфицирующего средства: · для очистки воды и воздуха от микроорганизмов (озонирование) · для дезинфекции помещений и одежды · для озонирования растворов, применяемых в медицине (как для внутривенного, так и для контактного применения). Одним из существенных достоинств озонирования, по сравнению с хлорированием, является отсутствие[14] токсинов в обработанной воде, тогда как при хлорировании возможно образование существенного количества хлорорганических соединений, многие из которых токсичны, например,диоксина и лучшая, по сравнению с кислородом, растворимость в воде. По заявлениям озонотерапевтов, здоровье человека значительно улучшается при лечении озоном (наружно, перорально, внутривенно иэкстракорпорально), однако ни одно объективное клиническое исследование не подтвердило сколько-нибудь выраженный терапевтический эффект. Более того, при использовании озона в качестве лекарственного средства (особенно при непосредственном воздействии на кровьпациента) доказанный риск его мутагенного, канцерогенного и токсического воздействия перевешивает любые теоретически возможные положительные эффекты, поэтому практически во всех развитых странах озонотерапия не признаётся лекарственным методом, а её применение в частных клиниках возможно исключительно с информированного согласия пациента[15].
Биологическая роль серы Биологическая роль серы исключительно велика. Сера является постоянной составной частью растений и содержится в них в виде различных неорганических и органических соединений. Многие растения образуют содержащие серу гликозиды и другие органические соединения серы (напр., аминокислоты - цистеин, цистин, метионин). Известны также бактерии, обладающие способностью вырабатывать серу. Некоторые микроорганизмы, в качестве продуктов жизнедеятельности, образуют специфические соединения серы (так, например, грибки синтезируют серосодержащий антибиотик пенициллин). В организмах животных и человека сера выполняет незаменимые функции: обеспечивает пространственную организацию молекул белков, необходимую для их функционирования, защищает клетки, ткани и пути биохимического синтеза от окисления, а весь организм - от токсического действия чужеродных веществ. В организме человека сера непременная составная часть клеток, ферментов, гормонов, в частности инсулина, вырабатываемого поджелудочной железой, и серосодержащих аминокислот. Много серы содержится в нервной и соединительной тканях, а также в костях. Сера входит в состав серосодержащих аминокислот - цистеина, цистина, незаменимой аминокислоты метионина, биологически активных веществ (гистамина, биотина, липоевой кислоты и др.). В активные центры молекул ряда ферментов входят SH - группы, участвующие во многих ферментативных реакциях, в том числе в создании и стабилизации нативной трехмерной структуры белков, а в некоторых случаях - непосредственно как каталитические центры ферментов. Сера обеспечивает в клетке такой тонкий и сложный процесс, как передача энергии: переносит электроны, принимая на свободную орбиталь один из неспаренных электронов кислорода. Этим объясняется высокая потребность организма в данном элементе. Сера участвует в фиксации и транспорте метильных групп. Она является также частью различных коэнзимов, включая коэнзим А. Очень важна детоксикационная роль серы.
Применение соединений серы Для медицинских целей люди издавна использовали дезинфицирующие свойства серы, которую применяли при лечении кожных болезней, а также бактерицидное действие сернистого газа, образующегося при горении серы. При приеме внутрь элементарная сера действует как слабительное. Порошок очищенной серы используют в качестве противоглистного средства при энтеробиозе. Соединения серы в виде сульфаниламидных препаратов (бисептол, сульфацил-натрия,сульгин и др.) обладают противомикробной активностью. Сера и ее неорганические соединения применяются при хронических артропатиях, при заболеваниях сердечной мышцы (кардиосклероз), при многих хронических кожных и гинекологических заболеваниях, при профессиональных отравлениях тяжелыми металлами (ртуть, свинец) - Тиосульфат натрия. Очищенную и осажденную серу применяют наружно в мазях и присыпках при кожных заболеваниях (себорея, сикоз); при лечении себореи волосистой части головы используют селена дисульфид. Тиосульфат натрия также применяется как наружное средство при лечении больных чесоткой и некоторыми грибковыми заболеваниями кожи. Сера входит в состав многих других лекарственных фармпрепаратов седативного, нейролептического, противоопухолевого действия (тиопентал, тиопроперазин, тиоридазин и др.).
Аналитические реакции сульфат-иона SO42-
1.Реакция с катионами бария (фармакопейная). Ва2+ + SO42- —> BaSO4 (белый мелкокристаллический) Выпадает белый осадок сульфата бария. 2.Реакция с катионами свинца. РЬ2т + SO42- -> PbSO4J. (белый кристаллический)
Аналитические реакции тиоиианат - иона (роданид - иона) SCN- SCN- - ион - анион сильной роданистоводородной кислоты HSCN. Тиоцианат - ион в водных растворах бесцветен, не гидролизуется, обладает окислительно - восстановительными свойствами, с солями различных металлов образует устойчивые тиоцианатные комплексы, например, [Co(NCS)4]2-, [Fe (NCS)]3- и т.д. Тиоцианаты щелочных и большинства других металлов хорошо растворяются в воде, за исключением тиоцианатов меди (II) Cu(SCN)2, меди (I) CuSCN, серебра (I) AgSCN, ртути (II) Hg(SCN)2, свинца (II) Pb(SCN)2, таллия (I) T1SCN, которые мало растворимы в воде. 1. Реакция с нитратом серебра. SCN- + Ag+ = AgSCN (белый творожистый) Проба на растворимость. Осадок AgSCN нерастворим в минеральных кислотах и в растворе карбоната аммония. Растворяется в водном аммиаке, в растворах тиосульфата натрия, цианида калия, при избытке тиоцианат - ионов с образованием соответствующих растворимых комплексов серебра: AgSCN + 2 NH3 — [Ag(NH3)2]+ + SCN- AgSCN +nS2O32-= [Ag(S2O3)n]1-2n + SCN- (n= 2 и 3) AgSCN +2 CN- = [Ag(CN)2]- + SCN' AgSCN + (n-1) SCN- -> [Ag(SCN)n]'-n (n=3 и 4) 2.Реакция с солями кобальта (II). 4 NCS' + Со2+ <-> [Co(NCS)4]2- тетратиоцианатокобальтат (II) - ион (синий)
3.Реакция с солями железа (III). Тиоцианат- ионы образуют с катионами железа (III)в кислой (для подавления гидролиза железа (III)) среде тиоцианатные комплексы железа (III) красного цвета состава [FefNCS)n(H2O)6.n]3--, где п=1,2.,.,6. 4.Реакция с иодат - ионами. - В кислой среде тиоцианат - ионы окисляются иодат - ионами с выделением свободного йода: 5SCN- + 6 Юз' + Н+ + 2 Н2О -> 5 SO42' + 5 HCN + ЗЬ Методика. Фильтровальную бумагу смачивают свежеприготовленным раствором крахмала и высушивают. Получают крахмдльную бумагу. На нее наносят кашпо разбавленного раствора НС1, каплю раствора KNCS и каплю раствора иодата калия, КЮз. Бумага окрашивается в синий цвет вследствие образования синего молекулярного комплекса крахмала с йодом, выделяющимся в процессе реакции. 5.Другие реакции тиоцианат - ионов. С нитратом ртути (II) Hg(NO3)2 они образуют белый осадок тиоцианата ртути (II) Hg(SCN)2, растворимый при избытке SCN- - ионов; с катионами Си-' - растворимые комплексы изумрудно - зеленого цвета или (при избытке катионов Си2+)черный осадок тиоцианата меди (II) Cu(SCN)2, который при нагревании превращается в белый тиоцианат меди (I) СиЗСЫ.Тиоцианат — ионы разлагаются растворами H2SO4,1INO3 и сильных окислителей, вступают в многочисленные реакции комплексообразоваиия, осаждения и т.д.
Химия биогенных элементов p-блока. Общая характеристика элементов VIIA группы. Электронные структуры атомов элементов. Галогены. Галогеноводородные кислоты, галогениды. Биологическая роль соединений фтора, хлора, брома, йода. Аналитические реакции на ионы Сl—, Br—, I—. К p-блоку относят 30 элементов IIIA-VIIIA- групп периодической системы. Общая формула строения внешних электронных оболочек атомов элементов р-блока: ns^2np^a, где а=1-6)
В группах радиус атомов увеличивается, энергия ионизации сродства к электрону уменьшается, неметаллические свойства ослабляются. Большинство известных на Земле соединений, это соединения р-элементов, т. К. они образуют многочисленные соединения с собой и с s-, f-, d- элементами. Элементы фтор F, хлор Cl, бром Br, иод I, астат At, входящие в VII-группу, называются галогенами(«солепорождающие»). На валентных орбиталях атомов галогенов находится по семь электронов – два на s- и пять на р-орбиталях. Электронная формула валентной оболочки ns^2ns^5, где n-номер периода. До завершения оболочки благородных газов недостает одного электрона, поэтому галогены обладают большим сродством к электрону и являются сильными окислителями. Атомы галогенов, присоединяя электрон, образуют однозарядные галогенид-ионы, с электронной структурой соответствующего благородного газа ns^2np^6. Такая склонность к присоединению электронов характеризует галогены как типичные неметаллы. С повышением заряда ядра в группе от F к At увеличиваются радиусы атомов, уменьшаются энергия ионизации и сродства к электрону, электроотрицательность и стандартный потенциал восстановления элементных веществ. Элементные галогены -вещества общей формулы Г2, т. е. состоят из двухатомных молеку
|
||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 544; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.96 (0.018 с.) |

 H2O + H2O H30+ + OH-; ∆Ho = 56,5 кДж/моль
H2O + H2O H30+ + OH-; ∆Ho = 56,5 кДж/моль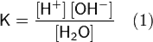
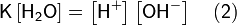


 В периодах слева направо радиус атомов уменьшается, энергия ионизации сродства к электрону увеличивается, металлические свойства ослабляются.
В периодах слева направо радиус атомов уменьшается, энергия ионизации сродства к электрону увеличивается, металлические свойства ослабляются.


