
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Буферные системы и механизм их действия. Буферная емкость и факторы ее определяющие.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Буферные растворы — это растворы, величина рН которых мало изменяется при добавлении к ним небольших количеств сильных кислот или щелочей, а также при разбавлении. Классификация буферных систем Механизм действия буферных систем: 1. Разбавление. При разбавлении водой происходит уменьшение концентрации обоих компонентов в буферной системе в одинаковой степени, поэтому величина их соотношения не изменится. рК(кислоты) и рК(основания) являются постоянными при данной температуре и не зависят от разбавления. Действительно, одновременное понижение концентраций кислоты и соли в ацетатной буферной системе от 0,1М до 0,001М при разбавлении водой изменяет рН буферного раствора с 4,63 до 4,73. Следовательно,разбавление в конечном итоге мало изменяет рН буферных систем. 2. Добавление кислот и оснований. При добавлении небольших количеств сильных кислот или оснований рН буферных систем изменяется незначительно. Например, рассмотрим ацетатный буфер: СН3СООН / СН3СОО– При добавлении к ацетатному буферу небольшого количества HCl, происходит взаимодействие ионов Н+ с основным компонентом буферного раствора: При добавлении небольшого количества NaOH, OH-– ионы нейтрализуются кислотным компонентом буферного раствора: В результате этого, добавленное сильное основание заменяется эквивалентным количеством слабого сопряженного основания (СН3СОО–), которое в меньшей степени влияет на реакцию cреды. рН буферного раствора увеличивается, но незначительно. Таким образом, если к ацетатному буферу добавить У моль/л NaOH, то уравнение для расчета рН буферной системы принимает вид: Буферная емкость (В) - это число молей эквивалента сильной кислоты или щелочи, которое необходимо добавить к 1 л буферного раствора, чтобы сместить его рН на единицу. Буферная емкость системы определяется по отношению к добавляемым кислоте (Вкисл.) или основанию (щелочи) (Восн.) и рассчитывается по формулам:
39. Уравнение Гендерсона-Гассельбаха для расчета pH буферных систем (вывод). При больших концентрациях H и OH значительно изменяется соотношение компонентов буферной смеси –Cк/Сс увеличивается или уменьшается и pH может измениться. Подтверждением этого является уравнение Гендерсона-Гассельбаха, которое устанавливает зависимость [H], Kи, α и Ск/Сс. На примере буферной системы кислотного типа – смеси уксусной кислоты и ее соли CH3COONa. Концентрация ионов водорода в буферном растворе определяется константой ионизации уксусной кислоты: CH3COOH↔CH3COO+H Kи= Преобразуем к виду:
Буферные системы крови. Буферные системы крови представлены буферными системами плазмы крови и буферными системами эритроцитов. Буферные системы плазмы – гидрокарбонатная, белковая и фосфатная, роль последней незначительна. На их долю приходится» 44% буферной емкости крови. Буферные системы эритроцитов – гемоглобиновая, гидрокарбонатная, система органических фосфатов (фосфатная). На их долю приходится»56% буферной емкости крови. Так как в плазме крови основную роль в связывании ионов Н+ играет гидрокарбонат – анион, его концентрация в плазме обусловливает резервную щелочность крови. Гемоглобиновая буферная система находится только в эритроцитах. Механизм ее действия связан с присоединением и отдачей кислорода. В связи с этим гемоглобин (Нв) имеет окисленную ННвО2 и восстановленную ННв формы. Гемоглобиновая буферная система в организме эффективно функционирует только в сочетании с гидрокарбонатной системой.
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 2797; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.219.68 (0.008 с.) |



 Восн.=
Восн.= 
 =1.75*10-5
=1.75*10-5 =Kи
=Kи 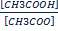 или
или 


