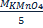Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретические основы объемного анализа. Классификация методов объемного анализа по реакции, лежащей в их основе и по способу титрования. Расчеты, применяемые в объемном анализе.Содержание книги
Поиск на нашем сайте
Концентрация в объемном анализе может выражаться молярностью, нормальностью и титром раствора. Молярность показывает сколько молей вещества содержится в 1л. раствора. При одинаковой молярности разные объемы растворов содержат одинаковое число молей растворенного вещества. Нормальность показывает сколько эквивалентов растворенного вещества содержится в 1л. раствора. Растворы с одинаковой нормальностью реагируют между собой одинаковыми объемами. Растворы с различной нормальностью реагируют разными объемами. Это обратнопропорционально нормальностям. NAVA=NBVB или Титр - это количество грамм вещества, содержащееся в 1 мл. раствора. T= От нормальной концентрации к титру можно перейти по формуле: T= Кислотно-основное титрование основано на применении реакций нейтрализации. Основным уравнением процесса нейтрализации в водных растворах является взаимодействие ионов гидроксония с ионами гидроксида, сопровождающееся образованием слабодиссоциированных молекул воды: Н3O+ + ОН- = 2Н2О. Перманганатометрическое титрование основано на взаимодействии стандартного раствора перманганата калия с раствором восстановителя. В основе йодометрического метода титрования лежит реакция: I2+2е-=2I-
Кислотно-основный метод титрования. Индикаторы, применяемые в этом методе. Кривые титрования. Точка эквивалентности. Стандартные и рабочие растворы. Определение общей кислотности желудочного сока. Кислотно-основное титрование основано на применении реакций нейтрализации. Основным уравнением процесса нейтрализации в водных растворах является взаимодействие ионов гидроксония с ионами гидроксида, сопровождающееся образованием слабодиссоциированных молекул воды: Н3O+ + ОН- = 2Н2О. Точку эквивалентности определяют кислотно-основными индикаторами. Изменение окраски индикатора должно быть обратимым. Это означает, что они способны менять свою окраску практически любое число раз по мере изменения pH в зависимости от кислой или щелочной реакции среды. В зависимости от ингредиента различают ацидиметрию и алкалиметрию. В ацидиметрии в качестве титранта применяют растворы сильных кислот (HCl,H2SO4). Этим методом определяют сильные и слабые основания, основные соли, соли слабых кислот. В алкалиметрии используются растворы щелочей в качестве титрантов, а определяют сильные и слабые кислоты, кислые соли, соли слабых оснований. Стандартные растворы получают растворением твердого вещества в колбе, после чего доводят объем водой до метки и по формуле T= Концентрация рабочего раствора устанавливается стандартизацией. Он используется для проведения титриметрического анализа. Кислотность желудочного сока определяется количеством мл. точно 0,1н. раствора щелочи, которое необходимо для нейтрализации 100 мл. профильтрованного желудочного содержимого. Объем NaOH, пошедший на оба титрования, умноженный на 10, показывает общую кислотность желудочного сока. 4. Перманганатометрия. Определение активности каталазы крови. Перманганатометрическое титрование основано на взаимодействии стандартного раствора перманганата калия с раствором восстановителя. Окисление перманганатом калия можно проводить в кислой, щелочной и нейтральной средн, причем продукты восстановления KMnO4 в разных средах различны. В кислой среде. ЭKMnO4= В щелочной среде. ЭKMnO4= В нейтральной среде. ЭKMnO4= Перманганатометрическое титрование рекомендуется проводить в кислой среде, т.к. одна избыточная капля титранта окрасит титруемый раствор в розовый цвет и окислительная способность перманганата калия в кислой среде намного больше, чем в щелочной и нейтральной. Титрованием раствора крови перманганатом калия можно определить активность каталазы крови. По результатам титрований определяем каталазное число, которое в норме должно колеблется от 10 до 15 единиц.
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 463; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.135.201 (0.007 с.) |

 =
= 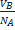
 (гр/мл.) где: m- навеска в граммах, V- объем раствора в мл., T- титр.
(гр/мл.) где: m- навеска в граммах, V- объем раствора в мл., T- титр. .
.