
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрохимия и электрохимические методы исследованияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте В БИОЛОГИИ И МЕДИЦИНЕ
1. Жидкости и ткани организма как проводники второго рода. Удельная и эквивалентная электропроводности, их изменение с концентрацией раствора. Эквивалентная электропроводность при бесконечном разведении. Абсолютная скорость движения и подвижность ионов. Закон Кольрауша.
Под прохождением электрического тока через вещество подразумевают направленное движение (перенос) электрических зарядов. В зависимости от природы их носителя различают проводники первого рода и проводники второго рода. В проводниках первого рода перенос электрического заряда осуществляется за счет направленного движения электронов. К ним относятся главным образом сплавы металлов, металлы и их расплавы. В проводниках второго рода перенос электрического заряда осуществляется за счет направленного движения ионов. К ним относятся все электролиты. Причем в большинстве случаев используются растворы или расплавы данных соединений, так как именно в таких системах за счет действия растворителя или высокой температуры образуются в достаточных количествах свободные ионы, способные перемещаться под действием внешнего электрического поля. Ткани организма человека относятся к проводникам второго рода, поэтому прохождение через них электрического тока связано с перемещением положительно заряженных частиц (катионов) к отрицательному полюсу - катоду, а отрицательно заряженных частиц (анионов) - к положительному полюсу - аноду. Электропроводность растворов электролитов обусловлена перемещением ионов в электрическом поле (в отличие от электронной проводимости проводников первого рода). Электропроводность - математическая оценка способности раствора проводить электрический ток, зависит в основном от степени минерализации исследуемого раствора и его температуры.
Способность вещества проводить электрический ток количественно характеризуется электропроводностью L, которую можно предсказать как величину, обратную сопротивлению проводника R:
где ρ – удельное сопротивление; Х - удельная электрическая проводимость; S – площадь сечения проводника; l – длина проводника. Электрическая проводимость в растворах электролита зависит от числа ионов в объёме раствора между электродами и скорости их движения.
Для оценки проводимости растворов и влияния на неё различных факторов применяют две величины: удельную (Χ) и молярную (эквивалентную) (λ) электрическую проводимость. Удельной электрической проводимостью (Χ) называют электропроводность раствора, находящегося между параллельными электродами площадью 1 см2, расположенными на расстоянии 1 см (измеряется в См·см-1 или См·м-1). χ=1/R*l/S
Удельная электрическая проводимость раствора электролита зависит от природы электролита, концентрации раствора и температуры.
Молярная электрическая проводимость – мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при данной концентрации. (электропроводимость раствора, содержащего 1 моль эквивалентов растворенного электролита при расстоянии между электродами Молярная электрическая проводимость равна электрической проводимости такого объёма (V,см3) раствора, в котором содержится 1 моль растворённого электролита, причём электроды расположены на расстоянии 1 см друг от друга. Из определения удельной и молярной электрических проводимостей следует, что они связаны соотношением:
где С – концентрация, моль/дм3; λ – молярная электрическая проводимость, См×см2/моль; Χ – удельная электрическая проводимость, См/см. Молярная электрическая проводимость слабых электролитов меньше, чем сильных; так как даже при низких концентрациях степень диссоциации слабых электролитов мала (α‹1). Следовательно, несмотря на то, что в объёме раствора, заключённого между электродами, содержится 1 моль электролита, переносчиков электрического тока – ионов в данном объёме меньше, чем в растворе сильного электролита. Повышение молярной электрической проводимости слабых электролитов при разбавлении растворов связано с увеличением степени диссоциации.
Для слабых электролитов отношение молярной электропроводности раствора при данном разбавлении (λ) к молярной электропроводности при бесконечно большом разбавлении (λº) характеризует истинную степень электролитической диссоциации. У слабых электролитов с разбавлением раствора увеличивается степень электролитической диссоциации и молярная электропроводность; константа же диссоциации при неизменной температуре остаётся постоянной величиной (закон разбавления Оствальда). Константа диссоциации Кдис, α, λ и концентрация (разбавление) подобных растворов связаны между собою следующими уравнениями: Кдис = Кдис = или Кдис = где V=1/C – разбавление раствора, л/г-экв. Для сильных электролитов, диссоциирующих полностью (α=1),
Уменьшение молярной электрической проводимости при переходе от бесконечно разбавленного раствора к растворам конечных концентраций у сильных электролитов связано только с уменьшением скоростей движения ионов. Сильные электролиты не подчиняются закону разбавления. Закон Кольрауша (или закон аддитивности электропроводности при бесконечном разбавлении электролитов) гласит, что в бесконечно разбавленном растворе перенос электричества осуществляется всеми ионами независимо друг от друга; при этом общая молярная электропроводность раствора равна сумме молярных электропроводностей отдельных ионов.
При достижении предельной электропроводимости прекращается межионное взаимодействие, и ионы движутся независимо друг от друга:
где Подвижности ионов пропорциональны их абсолютным скоростям движения и рассчитываются по формулам:
где F – постоянная Фарадея; V – абсолютная скорость движения иона.
Абсолютная скорость движения иона – это скорость передвижения иона к электроду, отнесенная к единице напряженности электрического поля. Скорость движения ионов в растворе зависит от их природы, температуры и природы растворителя, а именно: 1. Природа иона определяется его радиусом r и зарядом Z. Эти два фактора характеризуют поляризующую способность ионов по отношению к растворителю. В растворах скорость движения ионов определяется размерами сольватированных (гидратированных) ионов. Чем меньше радиус иона и больше заряд, тем большим поляризующим действием ион обладает. 2. Природа растворителя характеризуется диэлектрической постоянной D Е. С уменьшением величины D Е падает способность растворителя сольватировать ионы в растворе; электропроводимость раствора уменьшается, поскольку происходит уменьшение степени диссоциации веществ в малополярных растворителях. 3. С ростом температуры электропроводимость увеличивается на каждый градус на 2 % (вследствие уменьшения сольватной оболочки).
Биоткани — это проводники II рода. При прохождении постоянного тока через тело человека возникает постоянное электрическое поле, т.е. человеческий организм становится сложным электрическим проводником. Организм в целом, а также его различные ткани представляют собой сложный электролитический раствор. Величина электропроводности зависит от содержания в тканях жидкости. Жидкие среды организма: кровь, лимфа, моча, спинномозговая жидкость - обладают наибольшей электропроводностью. К хорошим проводникам также относятся внутренние органы и мышечная ткань, а к плохим - кость, жировая ткань. Большим сопротивлением проводимости обладает кожа, особенно ее роговой слой. В коже ток проходит в основном через протоки потовых и сальных желез, межклеточные пространства эпидермиса.
2. Кондуктометрия. Кондуктометрическое титрование, его сущность и использование в количественном анализе и медико-биологических исследованиях. Электрическая проводимость биологических жидкостей и тканей в норме и патологии.
Кондуктометрия – физико-химический метод исследования различных систем, основанный на измерении их электрической проводимости. К-м находит применение в биохимических, физиологических, санитарно-гигиенических и клинических исследованиях. Этот метод используют для определения общего содержания и состояния электролитов в различных биологических объектах: плазме и сыворотке крови, желудочном соке, моче, тканевой жидкости, а также в водах минеральных источников и в продуктах питания. Кондуктометрия является одним из наиболее точных методов измерения констант диссоциации физиологически важных электролитов, ИЭТочек аминокислот, пептидов и белков. Сущность всех кондуктометрических методов изучения различных свойств проводников сводится к измерению их сопротивления или электрической проводимости
Кондуктометрическое титрование широко применяют для количественного определения кислот, оснований и солей в различных жидкостях, в том числе и биологического происхождения. Анализ значений молярной подвижности ионов позволяет сформулировать следующие правила: 1. При равных концентрациях электрическая проводимость растворов сильной кислоты или сильного основания больше электрической проводимости растворов их солей. 2. При равных концентрациях электрическая проводимость раствора слабой кислоты меньше электрической проводимости раствора её соли. Поэтому при титровании растворов кислот растворами оснований в точке эквивалентности наблюдается резкое изменение электрической проводимости. Пусть раствор сильной кислоты HCl неизвестной концентрации титруется раствором сильного основания NaOH. Идёёт реакция нейтрализации: HCl+NaOH çèNaCl + H2O Водородные ионы Н+, обладающие большей подвижностью, в растворе замещаются менее подвижными катионами основания Na+. Электрическая проводимость вследствие этого уменьшается и в точке эквивалентности становится минимальной. Добавление избытка щёлочи приводит к появлению в растворе избытка высокоподвижных гидроксид-ионов. Это вновь приводит к увеличению электрической проводимости. При титровании раствора слабой уксусной кислоты раствором сильного основания NaOH CH3COOH + NaOHç èCH3COONa+H 2O Происходит замещение слабого электролита (кислоты), плохо диссоциирующего на ионы, на сильный электролит (соль) полностью диссоциирующий на ионы. Так как соль диссоциирует на малоподвижные ионы, то электрическая проводимость возрастает незначительно. Появление избытка щёлочи приводит к появлению высокоподвижных гидроксид-ионов, вследствие чего электрическая проводимость резко возрастает.
Живой организм с точки зрения электрохимии можно рассматривать как систему, состоящую из клеток и межклеточного пространства, заполненного раствором электролитов. Удельная электрическая проводимость клеток составляет приблизительно 10-3- 10-9 Ом-1*м-1, а межклеточной жидкости – 10-3 Ом-1*м-1. По электрической проводимости биологические ткани и жидкости можно расположить в такой последовательности: кровь, лимфа, ликвор, желчь> мышечная ткань, серое вещество мозга>ткань лёгких, сердечная мышца, ткань печени> жировая ткань, костная>роговой слой эпидермиса кожи. Изменение электрической проводимости тканей и клеток широко используют для диагностических целей. Паталогические процессы, а также отмирание тканей приводят к изменению проницаемости клеточных мембран. Это, в свою очередь, приводит к тому, что уменьшается зависимость электрической проводимости от частоты тока, а при полной гибели клеток она вообще перестаёт зависеть от частоты тока. Так как электрическая проводимость клеток и тканей определяется концентрацией свободных ионов, по электрической проводимости судят о проницаемости клеточных мембран для ионов. Повышение электрической проводимости указывает на увеличение содержания свободных ионов, а уменьшение – на то, что их концентрация падает.
3. Потенциометрия. Измерение электродных потенциалов. Хлорсеребряный электрод, стеклянный электроды; ионоселективные электроды. Потенциометрическое титрование и его использование в количественном анализе и медико-биологических исследованиях (рН–метрия).
Потенциометрия (от лат. potentia — сила, действие и греч. metreo — измеряю) — совокупность методов исследования систем основанных на измерении электродвижущих сил (ЭДС гальванических элементов (цепей), составленных из соответствующим образом подобранных электродов. Широко применяется в биохимических, физиологических, клинических лабораториях для определения активности (концентрации) ионов в растворах, водородного показателя, окислительно-восстановительного потенциала, биоэлектрических потенциалов для потенциометрического титрования и др. Для измерения потенциала исследуемого электрода составляют цепь:
2Н+ + 2e− = H2 то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде. Измеряя ЭДС гальванического электрода при стандартных условиях (см. выше) определяют стандартный электродный потенциал определяемой химической реакции. ВЭ применяют для измерения стандартного электродного потенциала электрохимической реакции, для измерения концентрации (активности) водородных ионов, а также любых других ионов. Применяют ВЭ так же для определения произведения растворимости, для определения констант скорости некоторых электрохимических реакций. Наиболее важные требования к электродам сравнения: 1) Электрод должен работать в интервале температур. 2) Стабильность работы. 3) Воспроизводимость результатов. 4) Должен быть совместим с исследуемым расплавом. 5) Отсутствие стационарных потенциалов. В этом случае составляют водородно-каломельную цепь:
4. Электродные и окислительно-восстановительные (ОВ) потенциалы. Механизм возникновения электродных и ОВ-потенциалов. Уравнение Нернста, уравнение Петерса.
Электро́дный потенциа́л —это ЭДС элемента, составленного из данного электрода и стандартного водородного электрода, электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как "разность потенциалов на границе электрод – раствор", т.е. считают его тождественным потенциалу ДЭС, что не вполне правильно (хотя эти величины взаимосвязаны).. Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз. Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически. Измерение потенциалов. Практическое значение имеют относительные электродные потенциалы, обычно называемые просто электродные потенциалы, представляющие собой разность электродных потенциалов рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, электродный потенциал которого условно принимается равным нулю (для водных систем).
Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода являются: Pt/Fe3+,Fe2+ Определение величины редокс-потенциала. Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением: Aox + n·e− → Ared, то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей) реагирующих веществ выражается уравнением Нернста. Окислительно-восстановительный потенциал определяют электрохимическими методами с использованием стеклянного электрода с red-ox функцией[2] и выражают в милливольтах (мВ) относительно стандартного водородного электрода в стандартных условиях Применение в биохимии. В биохимии для обозначения передаваемого от донора к акцептору одного электронного эквивалента (электрона, либо электрона и протона и др.) часто используют термин восстановительный эквивалент. Этот термин ничего не говорит о том, что именно передается — электрон как таковой, водородный атом, гидрид-ион (Н-) или же передача происходит в реакции с кислородом, приводящей к образованию окисленного продукта. Способность восстановителя отдавать электроны окислителю выражается величиной окислительно-восстановительного потенциала (стандартного восстановительного потенциала) или редокс-потенциала. Редокс-потенциал определяют измерением электродвижущей силы (э. д. с.) в вольтах, возникающей в полуэлементе, в которомвосстановитель и окислитель, присутствующие в концентрациях равных 1 моль/литр при 25°С и рН 7,0, находятся в равновесии с электродом, способным приниматьэлектроны от восстановителя и передавать их окислителю. В качестве стандарта принят редокс-потенциал реакции Н2 → 2Н+ + 2e−, который при давлении газообразного водорода в 1 атмосферу при концентрации ионов Н+ равной 1 моль/литр (что соответствует рН = 0) и при 25°С условно принят за нуль. В условиях значения рН, принятого в качестве стандарта при биохимических расчетах, то есть при рН 7,0, редокс-потенциал (Е°´) водородного электрода (системы Н2 / 2Н+) равен -0,42 В. Значения редокс-потенциала (Е°´) для некоторых окислительно-восстановительных пар, играющих важную роль при переносе электронов в биологических системах:
Система с более отрицательным редокс-потенциалом обладает большей способностью отдавать электроны системе с более положительным редокс-потенциалом. Например, пара НАД • Н / НАД+, редокс-потенциал которой равен -0,32 В будет отдавать свои электроны окислительно-восстановительной паре флавопротеин (восстановл.) / флавопротеин (окислен.), имеющей потенциал −0,12 В, то есть более положительный. Большая положительная величина редокс-потенциала окислительно-восстановительной пары вода/кислород (+0,82 В) указывает на то, что у этой пары способность отдавать электроны (то есть способность образовывать молекулярный кислород) выражена очень слабо. Иначе можно сказать, что у молекулярного кислорода очень велико сродство к электронам или водородным атомам.
При соприкосновении двух химически или физически разнородных материалов между ними возникает разность потенциалов. Наибольший интерес представляют контакты проводников: металл (1) - металл (2), металл - раствор соли металла, раствор электролита (1) - раствор электролита (2) и т. д. (рисунок 24). Изменение потенциала при переходе через границу происходит резко, поэтому говорят, что имеет место скачок потенциала.
Рисунок 24 – Контакты различных проводников
Возникновение скачка потенциала вызывается различными причинами, зависящими от природы контактирующих материалов. Главной причиной является обмен заряженными частицами, в результате которого создается избыток носителей электричества данного знака по одну сторону и их недостаток по другую сторону границы раздела. Обмен заряженных частиц приводит к возникновению двойного электрического слоя. Двойной электрический слой подобен заряженному конденсатору с определенной разностью потенциалов между обкладками. Иногда перенос заряженных частиц через границу раздела фаз невозможен (водный раствор электролита — воздух, водный раствор ПАВ — воздух и т. д.). В этом случае скачок потенциала возникает в результате адсорбции растворенных веществ на границе раздела, причем обе «обкладки» конденсатора находятся в этом случае в жидкой фазе. Механизм возникновения электродного потенциала.При контакте металлической пластинки с водой расположенные на поверхности катионы металла гидратируются полярными молекулами воды (рисунок 25, а). Выделяющаяся при этом энергия гидратации Егидет на разрыв связи ионов с кристаллической решеткой металла Eм. Вследствие этого расположенные на поверхности катионы переходят в водную фазу. Металлическая пластинка при этом приобретает отрицательный заряд, а близлежащий слой воды — положительный. Таким образом, на границе раздела металл — вода возникает двойной электрический слой (рисунок 25, б).
Рисунок 25– Рисунок 26 Рисунок 25 Возникновение скачка потенциала на границе раздела металл – вода
Скачок потенциала, возникающий на границе раздела металл — раствор его соли, называется электродным потенциалом φ. С возрастанием заряда скорость перехода Vм→ж ионов из металла в жидкость уменьшается. В то же время скорость обратного процесса Vж→м возрастает. При определенном заряде металла устанавливается равновесие, которое характеризуется равенством скоростей прямого и обратного процесса Vм→ж = Vж→м. Устанавливающаяся при этом разность потенциалов в двойном электрическом слое зависит от природы металла, растворителя и температуры. Более сложную картину наблюдают, когда металл контактирует не с чистой водой, а с раствором соли этого металла (рисунок 26). Например, в случае элемента Якоби - Даниэля цинковая пластинка погружена в раствор цинка сульфата (рисунок 26, а), а медная - в раствор меди сульфата (рисунок 26, б). Возникновение электродного потенциала обусловлено обратимым переходом катионов Мz+ из металла М в раствор его соли и обратно Мz+металл↔*Мz+ раствор.
Рисунок 26 – Возникновение скачка потенциала на границе раздела металл - раствор его соли
Пусть Vм→р - скорость перехода ионов Мz+ из металла в раствор, а Vp→м - скорость перехода тех же ионов из раствора на поверхность металла. В общем случае Vм→р и Vp→мнеодинаковы. Они становятся равными, когда между жидкой и твердой фазами устанавливается равновесие.
|
|||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 2032; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.013 с.) |


 = 1 м)
= 1 м)



 ,
,
 ,
, и
и  – предельные электропроводимости или подвижности ионов (катиона и аниона) (табл. 13).
– предельные электропроводимости или подвижности ионов (катиона и аниона) (табл. 13). ;
; 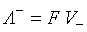 ,
,





