
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физико-химические основы кинетики биохимических реакцийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1. Предмет химической кинетики. Химическая кинетика как основа для изучения скоростей и механизмов биохимических процессов. Реакции одностадийные (простые), многостадийные (сложные), гомогенные, гетерогенные. Примеры. Термодинамика предсказывает лишь возможность протекания процесса. На вопрос о том, как быстро осуществится эта возможность, отвечает химическая кинетика. Химическая кинетика – это есть учение о скорости и механизме химических реакций и зависимости их от различных условий (температуры, концентрации реагирующих веществ, влияния катализатора и так далее). Скорости химических реакций изучают, чтобы управлять химическим процессом.
Химические реакции по сложности делятся на простые и сложные. Простые (элементарные) реакции – это реакции, протекающие в одну стадию и необратимо. Продукты простой реакции образуются в результате непосредственного взаимодействия молекул или ионов реагентов. Уравнение этой стадии совпадает со стехиометрическим уравнением реакции в целом. Например, разложение молекул йода и нитрозилхлорида. I2 NOCl → NO + Cl (3.8) К простым реакциям относятся реакции изомеризации или, например, реакция взаимодействия катиона и аниона: Ag + Cl – → AgCl. Большинство химических реакций являются сложными. Сложные реакции состоят из двух или большего числа простых реакций, в той или иной форме связанных между собой через исходные вещества и промежуточные продукты. К сложным реакциям относятся: · Параллельные · Последовательные · Сопряженные · Обратимые Теория сложных реакций основывается на положении, что при протекании в системе одновременно нескольких простых реакций каждая из них протекает самостоятельно и к каждой из них в отдельности применимы уравнения кинетики простых реакций. Параллельными называются реакции, в которых данное исходное вещество или исходные вещества могут реагировать одновременно в различных направлениях. (разложение хлората калия при умеренных температурах) ┌→ 2KCl + 3O2 6KClO3 └→ 3KClO4 + KCl Последовательные реакции – это реакции, состоящие из нескольких стадий, следующие друг за другом. В этих реакциях какой-либо продукт, образующийся в одной из промежуточных стадий, расходуется в другой стадии. В общем виде последовательные реакции можно записать следующим образом: А где вещество В является промежуточным продуктом в процессе получения вещества С, а к1 и к2 – константы скорости двух стадий сложной реакции. Последовательные реакции широко распространены и большинство реакций протекает через промежуточные стадии. (Реакции термического крекинга углеводородов, которые протекают с последовательным превращением высокомолекулярных углеводородов во все более низкомолекулярные.) Обратимые реакции – это реакции, протекающие одновременно в двух противоположных направлениях. Почти все реакции являются в той или иной степени обратимыми, но практически обратимыми называются реакции, в которых равновесие устанавливается не при ничтожно малых, а при ощутимых количествах исходных веществ. Например, синтез иодоводорода и аммиака из простых веществ: H2 + J2 Скорость обратимой реакции равна разности скоростей прямой и обратной реакций. Сопряженными реакциями называются реакции такого типа: А + В → Д, А + С → Е, из которых одна реакция может протекать самостоятельно, а другая реакция, например, вторая протекает лишь совместно с первой реакцией, то есть вторая реакция не может протекать без вещества В первой реакции и это вещество называется индуктором, так как оно индуцирует вторую реакцию. Вещество С второй реакции называется акцептором. Вещество А участвует в обоих реакциях и называется актором. Гомогенная химическая реакция – это реакция, протекающая в пределах одной фазы, то есть когда реагирующие вещества находятся в одной фазе. (Любая реакция в растворе (например, реакция нейтрализации между кислотой и щелочью) или когда все компоненты находятся в газообразном состоянии, например: 2Н2 + О2 Гомогенная реакция протекает во всем объеме системы и её скорость зависит от объема системы. Гетерогенная химическая реакция – это реакция, протекающая на поверхности раздела фаз, то есть когда реагирующие вещества находятся в различных агрегатных состояниях или же любая реакция, идущая на поверхности твердого катализатора, например, С(т) + О2 → СО2. Следует отметить, что в гетерогенном процессе оба реагирующих вещества могут находиться в одной фазе. Так, гидрирование этилена С2Н4 + Н2 идет на поверхности катализатора, например, никеля. Однако оба реагирующих вещества находятся в одной фазе (в газовой фазе над поверхностью катализатора). Скорость гетерогенной химической реакции зависит от площади поверхности раздела фаз.
2. Скорость гомогенных химических реакций и методы её измерения. Закон действующих масс для скорости гомогенных и гетерогенных реакций. Константа скорости реакции, её определение.
Скорость реакции является количественной мерой быстроты протекания химического превращения во времени. Чтобы произошла химическая реакция, реагирующие частицы должны столкнуться. Только при столкновении активных частиц, обладающих необходимой энергией, происходит реакция, то есть активное столкновение, при котором исходные вещества превращаются в продукты реакции.
|
||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 1328; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.102.163 (0.008 с.) |

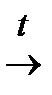 2I (3.7.)
2I (3.7.)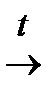 │ (3.9)
│ (3.9) В
В  С
С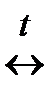 2HJ, N2 + 3H2
2HJ, N2 + 3H2 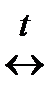 2NH3.
2NH3. C2H6
C2H6 , (3.2.)
, (3.2.)


