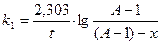Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Формальная химическая кинетика
Знание закономерностей, которым подчиняется скорость химических реакций, позволяет контролировать и направлять течение химических процессов.
ПЛАН 1. Предмет химической кинетики и ее задачи. 2. Основные принципы химической кинетики. 3. Кинетические кривые различных химических реакций. 4. Скорость химической реакции и ее определение. По изменению концентрации какого из веществ обычно определяют скорость реакции? 5. Средняя, истинная (мгновенная), удельная скорости реакции. Какой физический смысл имеет константа скорости химической реакции? От чего зависит и от чего не зависит константа скорости химической реакции? 6. Молекулярность реакции. Порядок химической реакции. Всегда ли молекулярность и порядок реакции имеют одинаковые значения? Привести примеры. Какие реакции называют псевдомолекулярными? ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Приведите определение понятия “скорость химической реакции”. 2. Запишите аналитическое выражение для расчета: а) средней скорости химической реакции, б) мгновенной скорости химической реакции. 3. Приведите графическую зависимость: а) изменения концентрации исходных веществ во времени; б) изменения концентрации конечных продуктов во времени. 4. Используя графическую зависимость изменения концентрации исходных веществ во времени, проиллюстрируйте:нахождение средней и мгновенной скорости реакции. 5. На графике С = f(t) представлены две кривые, описывающие изменение концентрации реагирующих веществ во времени. Скорость какой реакции (I ил II) больше?
t 6. Разложение закиси азота при высоких температурах протекает по уравнению: а) в каком случае начальная скорость разложения закиси азота будет выше: при С0 = 1,5 моль/дм3 или С0 = 3,2 моль/дм3? Почему? б) при одной и той же начальной концентрации при t1 = 9000С или при t2 = 12000С. Почему? 7. Разложение закиси азота протекает по уравнению 8. Реакция между веществами А и В протекает по уравнению: А + 2В →С. Концентрация вещества А = 1,5 моль/ моль/дм3, а вещества В = 3 моль/дм3. Константа скорости реакции = 0,4. Вычислите скорость химической реакции при указанной температуре в начальный момент времени.
9. Дайте определение понятия «константа скорости химической реакции». 10. Назовите два фактора, влияющие на величину константы скорости химической реакции. 11. Дайте определение понятий «молекулярность», «порядок» реакции. 12. Приведите классификацию химических реакций по молекулярности. 13. Приведите классификацию химических реакций по порядку. 14. Какими свойствами обладают реакции: а) I-го порядка, б) II-го порядка, в) III-го порядка, г) дробного порядка, д) нулевого порядка. 15.По какому признаку выделяют реакции: а) одномолекулярные, двумолекулярные, тримолекулярные. 16.Почему молекулярность реакции обычно не бывает больше трех. 17.назовите три основные условия, выполнение которых необходимо для осуществления акта химического взаимодействия. 18.По какому признаку выделяют псевдомолекулярные реакции? 19.Приведите пример реакций I и II порядков. 20.Приведите пример реакций: а) одномолекулярной, б) двумолекуляной, в) тримолекулярной, г) псевдомолекулярной.
ЛИТЕРАТУРА:
1. Евстратова К. И., Купина Н. А., Малахова Е. Е. "Физическая и коллоидная химия" - стр.260-266. 2. Стромберг А. Г., Семченко Д. П. "Физическая химия" - стр. 284-300. 3. Голиков Г.А. «Руководство по физической химии». М. 1988. стр.253-258, 265-274. 4. Лекционный материал. ЛАБОРАТОРНАЯ РАБОТА ИЗУЧЕНИЕ КИНЕТИКИ РЕАКЦИИ ВОССТАНОВЛЕНИЯ ГЕКСАЦИАНОФЕРРАТА (III) КАЛИЯ АСКОРБИНОВОЙ КИСЛОТОЙ При окислении аскорбиновой кислоты слабым окислителем гекса- цианоферратом (III) образуется дегидроаскорбиновая кислота. Реакция протекает по уравнению: С6Н8О6 + 2 [Fe (CN) 6]3- = C6H6O6 + 2 [Fe (CN) 6]4-+ 2H+. Реакция идет в кислой среде и является многоступенчатой. В зависимости от соотношения исходных концентраций аскорбиновой кислоты и гексацианоферрата (III) реакция может протекать по I-му или II-му порядку. За скоростью реакции можно следить по изменению количества израсходованного гексацианоферрата (III) во времени. Содержание [Fe(CN)]3- определяется на фотоэлектроколориметре при длине волны 400-450 нм.
СХЕМА ВЫПОЛНЕНИЯ ЛАБОРАТОРНОЙ РАБОТЫ
Приложение 1.
Оформить работу, сделать вывод.
Приложение 2. ОПРЕДЕЛЕНИЕ ОПТИЧЕСКОЙ ПЛОТНОСТИ РАСТВОРА НА ФОТОЭЛЕКТРОКОЛОРИМЕТРЕ КФК-2.
1. Колориметр включить в сеть за 15 мин до начала измерений для прогрева прибора. 2. Ввести светофильтр, соответствующий длине волны 400-440 нм. 3. Установить минимальную чувствительность колориметра, для чего ручку "ЧУВСТВИТЕЛЬНОСТЬ" установить в положение "I", ручку "УСТАНОВКА" 100 "ГРУБО" в крайнее левое положение. 4. Проверить установку стрелки колориметра на "О" по шкале коэффициентов пропускания Т при открытом кюветном отделении. 5. Если стрелка смещена от нулевого положения, ее подводят к нулю с помощью потенциометра "НУЛЬ", выведенного под шлиц. 6. Заполнить одну кювету дистиллированной водой (растворителем или контрольным раствором) и поместить ее в кюветодержатель. Крышку кюветного отделения закрыть. 7. Ручками "ЧУВСТВИТЕЛЬНОСТЬ" и "УСТАНОВКА 100 ГРУБО" и "ТОЧНО" установить отсчет 100 по шкале колориметра. Ручка "ЧУВСТВИТЕЛЬНОСТЬ" может находиться в одном из 3-х положений: "1", "2" или "3". 8. Во вторую кювету внести исследуемый раствор, поместить ее в кюветодержатель и поворотом ручки кюветодержателя до упора заменить кювету с контрольным раствором кюветой с исследуемым раствором. 9. Снять отсчет по шкале колориметра в единицах оптической плотности Д (нижняя шкала).
ЗАНЯТИЕ №12 КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ РАЗЛИЧНЫХ ПОРЯДКОВ
ПЛАН ИЗУЧЕНИЯ ТЕМЫ 1. Вывод уравнения кинетики реакции 0 порядка. Константа скорости и свойства реакций 0 порядка.
2. Вывод уравнения кинетики реакции 1 порядка. Константа скорости и свойства реакций 1 порядка. 3. Вывод уравнения кинетики реакции 2 порядка. Константа скорости и свойства реакций 2 порядка. 4. Реакции III порядка. 5. Реакции дробных порядков. 6. Обобщенное уравнение кинетики. 7. Сложные реакции. 8. Способы нахождения порядка химической реакции. 9. Решение задач.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ: 1. Приведите размерность для константы скорости реакции I порядка. 2. Приведите способ графического определения константы скорости химической реакции. 3. Приведите уравнение для расчета константы скорости химической реакции I порядка по результатам поляриметрических измерений при изучении реакции инверсии тростникового сахара. 4. Приведите уравнение для расчета константы скорости химической реакции I порядка по величинам концентрации реагирующих веществ. 5. Назовите основные свойства реакций I и II порядков. 6. Дайте определение понятия “период полупревращения”. 7. Приведите уравнение для расчета периода полупревращения для реакций I и II порядков. 8. Для реакции разложения пероксида водорода в водном растворе определили период полупревращения при различных исходных концентрациях. Были получены следующие данные:
Каков порядок реакции разложения пероксида водорода? 9. Время, за которое половина тросникового сахара, находящегося в 20% растворе, превратилась в глюкозу и фруктозу, оказалось равным 136 минут. За какое время подвергнется гидролизу на 50% сахар, находящийся в 10% растворе? 10. В сосуде имеется 0,025 г радона. Период полураспада его равен 3,82 дня. Какое количество радона останется через 7,64 дня. 11. Назовите четыре способа определения порядка реакции.
ЛИТЕРАТУРА: 1. Евстратова К. И., Купина Н. А., Малахова Е. Е. "Физическая и коллоидная химия". М. стр.260-269. 2. Стромберг А. Г., Семченко Д. П. "Физическая химия". М. стр. 300-314. 3. Голиков Г.А. «Руководство по физической химии». М. 1988. стр.258-265. 4. Лекционный материал.
ЛАБОРАТОРНАЯ РАБОТА ОПРЕДЕЛЕНИЕ КОНСТАНТЫ СКОРОСТИ РЕАКЦИИ ОКИСЛЕНИЯ ИОДИСТОВОДОРОДНОЙ КИСЛОТЫ ПЕРЕКИСЬЮ ВОДОРОДА.
Реакция протекает по уравнению Н2О2 + HJ à 2H2O + J2. Количество прореагировавшей Н2О2 oпределяют по эквивалентному количеству выделившегося иода, который титруют раствором тиосульфата натрия непосредственно в реакционной смеси. Иодистоводородную кислоту получают при взаимодейтсвии серной кислоты с иодидом натрия или калия.
2NaJ + H2SO4à Na2SO4 + 2HJ (а); H2O2 + 2HJà 2H2O + J2 (б); J2 + 2Na2S2O4à 2NaJ + Na2S4O6 (в). Реакции (а) и (в) протекают практически мгновенно так, что скорость всего процесса определяется скоростью реакции (б). Иодид натрия, прореагировавший в реакции (а) регенерируется в ре- акции (в); таким образом, концентрация NаJ и HJ остаются постоянными. Следовательно, скорость реакции между H2O2 и HJ зависит только от концентрации H2O2. Для вычисления константы скорости этой псевдомолекулярной реакции можно применить уравнение первого порядка. Упрощенно измерение скорости реакции можно проводить по определению времени t, необходимого для появления окраски свободного иода с крахмалом после добавления к раствору определенного количества тиосульфата натрия. ЗАДАНИЯ: 1. Определить изменение концентрации свободного иода во времени при двух температурах. 2. Рассчитать константу скорости по кинетическому уравнению и графически.
ВЫПОЛНЕНИЕ РАБОТЫ:
В колбу емкостью 200 мл влить 100 мл 0, 4 % раствора NaJ и 5 мл 2 N H2SO4. На горло колбы надеть утяжелитель, например, кольцо из толстой свинцовой проволоки. Поставить колбу в термостат при 250С. Туда же поместить пробирку с 15 мл 0, 05н Н2О2. Над колбой установить бюретку с 0, 05н Na2S2O3. Через 10-15 мин, когда растворы примут постоянную температуру, в колбу влить из бюретки 1 мл раствора Na2S2O3, 5 капель 0, 5%-ного раствора крахмала (индикатор на иод) и 15 мл 0, 05н Н2О2 из пробирки. Тщательно перемешать содержимое колбы. По секундомеру отметить и записать момент первого появления голубого окрашивая (t0). Быстро добавить еще 1 мл раствора Na2S2O3, перемешать до исчезновения окрашивания и вновь отметить момент появления окрашивания (t1). Эти операции повторить 6-8 раз при включенном секундомере. Промежутки времени t1, t2 и т. д. отсчитывать с момента первого появления окрашивания t0. При 250С реакция протекает медленно. Чтобы довести ее до конца в короткий срок, в смесь вводят катализатор - 5 капель 1н раствора молибдата аммония. Выделяется большое количество иода, которое оттитровывают тиосульфатом из той же бюретки до обесцвечивания раствора. Объем тиосульфата натрия, израсходованный на титрование, эквивалентен взятым для реакции 15 мл Н2О2. В момент времени t0 в растворе содержится (А-1) мл раствора Н2О2, так как к этому времени уже прореагирует ее количество, эквивалентное 1 мл раствора Na2S2O3. Tаким образом начальная концентрация раствора Н2О2: а = А - 1. К моменту второго появления окрашивания (t1) прореагирует еще 1 мл Na2S2O3, следовательно, количество прореагировавшего Н2О2: х = 1. К моменту третьего появления окрашивания: х = 2 и т. д. Тогда уравнение реакции первого порядка примет вид:
Данные занести в таблицу по форме:
Вычислить константу k1 для реакций I-го порядка по уравнению для каждого промежутка времени с точностью до 0, 001. Построить график в координатах lg[(a-1)-x]-t и рассчитать k1. Записать вывод.
ЗАНЯТИЕ №13
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 681; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.239.148 (0.047 с.) |
 С
С



 D0 - оптическая плотность в начальный момент. Эта величина пропорциональна начальной концентрации С0.
Dt - оптическая плотность в данный момент. Эта величина пропорциональна Сt.
t - время от начала реакции.
2. Сопоставить значения констант скоростей реакции, рассчитанных по кинетическим уравнениям реакций I и II порядков. О порядке реакции судить по близким значениям К, рассчитанным по соответствующему уравнению.
3. Вычислить среднее значение константы скорости Кcр изучаемой реакции.
D0 - оптическая плотность в начальный момент. Эта величина пропорциональна начальной концентрации С0.
Dt - оптическая плотность в данный момент. Эта величина пропорциональна Сt.
t - время от начала реакции.
2. Сопоставить значения констант скоростей реакции, рассчитанных по кинетическим уравнениям реакций I и II порядков. О порядке реакции судить по близким значениям К, рассчитанным по соответствующему уравнению.
3. Вычислить среднее значение константы скорости Кcр изучаемой реакции.