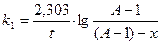Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Курский государственный медицинскийСодержание книги Поиск на нашем сайте
КУРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Кафедра общей и биоорганической химии
ЗАДАНИЯ
для самоподготовки к занятиям по физической химии для студентов биотехнологического факультета
Курск ТЕОРИИ РАСТВОРОВ ЭЛЕКТРОЛИТОВ I. П Л А Н И З У Ч Е Н И Я Т Е М Ы: 1. Теория электролитической диссоциации Аррениуса. 2. Закон разбавления Оствальда. 3. Теории Бренстеда-Лоури, Измайлова, Льюиса. 4. Теория Дебая-Хюккеля. 5. Современные представления о растворах электролитов.
II ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Перечислите основные положения теории Аррениуса. 2. Приведите классификацию Аррениуса электролитов по силе. 3. Сформулируйте теорию кислот-оснований Аррениуса. 4. Что такое константа диссоциации? Как это понятие связано с константой равновесия? 5. Что является ограничением в теории Аррениуса? 6. Запишите математическую формулировку закона разбавления Оствальда. 7. Каков физический смысл изотонического коэффициента Вант Гоффа? 8. Выведите уравнение, позволяющее понять физический смысл изотонического коэффициента. 9. Сформулируйте основные положения теории Бренстеда-Лоури. 10. Приведите классификацию растворителей по Бренстеду-Лоури. 11. В чем сущность количественной теории влияния растворителей на силу кислот, предложенной Н.А. Измайловым? Какую роль в этой теории играет водородная связь? 12. Каковы основные положения теории Льюиса? 13. Можно ли назвать теорию Льюиса "электронной"? 14. Что такое "ионная сила раствора"? Как может это понятие использоваться для описания свойств раствора? 15. Объясните физический смысл коэффициента активности? 16. Что является основной теоретической идеей теории Дебая - Хюккеля? 17. Приведите математическое выражение для расчета толщины ионной атмосферы. 18. Приведите математическое выражение для расчета коэффициента активности по Дебаю-Хюккелю в первом приближении. 19. Что такое "предельный закон" Дебая? 20. Приведите математическое выражение для расчета коэффициента активности во втором приближении по Дебаю-Хюккелю. 21. Приведите третье приближение теории Дебая-Хюккеля. III ЛИТЕРАТУРА: 1. Евстратова К. И., Купина Н. А., Малахова Е. Е. "Физическая и коллоидная химия". М. 1990 - стр.139-160. 2. Стромберг А. Г., Семченко Д. П. "Физическая химия" М. 1999. стр. 234-246. 3. Голиков Г.А. «Руководство по физической химии». М. 1988. стр. 215-225 4. Лекционный материал. ЗАНЯТИЕ №2 ЗАНЯТИЕ №3 КОНДУКТОМЕТРИЯ. Приложение ОПРЕДЕЛЕНИЕ СОПРОТИВЛЕНИЯ РАСТВОРА ЭЛЕКТРОЛИТА С ПОМОЩЬЮ ПРИБОРА "СПУТНИК РАДИОЛЮБИТЕЛЯ".
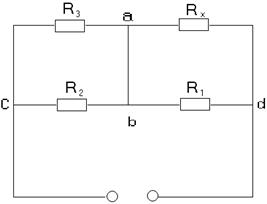
Прибор "Спутник радиолюбителя" состоит из 3-х блоков: 1. Измерительный блок 2. Звуковой генератор 3. Блок питания Измерительный блок служит для измерения омического (Rа), индуктивного (Rс) или емкостного (с) сопротивлений. Собран измерительный блок по мостиковой схеме, принципиально имеющий вид:
Диагональ моста "сd" питается от 2-го блока - звукового генератора, в диагональ "ав" включается телефон. Звуковой генератор генерирует 8 фиксированных частот, которые могут быть использованы в работе. При измерении сопротивления используется одна из частот, генерируемых звуковым генератором. Питание звукового генератора осуществляется блоком питания, который в свою очередь питается от сети переменного тока с частотой 50 гц и напряжением 220 в.
ПОСЛЕДОВАТЕЛЬНОСТЬ РАБОТЫ С ПРИБОРОМ: 1. Блок питания подключить в сеть переменного тока. 2. К клеммам "RL" измерительного блока подключить электролитическую ячейку. Электролитическая ячейка представляет собой два платиновых электрода с фиксированным расстоянием между открытой частью электродов, и опущенных в раствор, сопротивление которого хотят определить. Для определения сопротивления в сосуд электролитической ячейки наливают такое количество испытуемого раствора, чтобы электроды были погружены своей открытой частью на 50 мм ниже уровня жидкости в сосуде. 3. Установить переключатель частот звукового генератора на частоте 1 кгц. 4. Переключатель вида измерений (1-ый блок) установить на минимальное омическое сопротивление (R3). 5. Вращением ручки "множитель", стрелка указатель которой покажет значение R1/R2, добиться минимального звука в наушниках. Если при данном значении R3 минимальный звук отсутствует при всех возможных положениях переключателя "множитель", или имеет место, когда этот переключатель находится в одном из крайних положений, следует изменить величину сопротивления R3 и подобрать такое его значение, при котором минимальный звук в телефонных наушниках будет иметь место, когда стрелка-указатель множителя находится внутри шкалы. Перемножив показание переключателя вида измерений на показание множителя, получим значение измеряемого сопротивления:
III. ЛИТЕРАТУРА: 1. Евстратова К. И., Купина Н. А., Малахова Е. Е. "Физическая и коллоидная химия". М. 1990. стр.139-160. 2. Стромберг А. Г., Семченко Д. П. "Физическая химия". М. 1999. стр. 246-247. 3. Голиков Г.А. «Руководство по физической химии». М. 1988. стр. 225-227 4. Лекционный материал. При подготовке к занятию использовать методические рекомендации предыдущего занятия.
ЗАНЯТИЕ №4 ЗАНЯТИЕ № 5 ПОТЕНЦИОМЕТРИЯ
I. ПЛАН ИЗУЧЕНИЯ ТЕМЫ 1. Гальванический элемент: устройство, принцип работы. 2. Электродвижущая сила гальванического элемента (Е) определение понятию. Расчет величины Е по значениям электродных потенциалов электродов, составляющих элемент. 3. Уравнение Нернста для расчета величины ЭДС гальванического элемента (вывод). 4. Стандартная ЭДС гальванического элемента (Е0), ее связь с изменением энергии Гиббса в стандартных условиях ( 5. Расчет термодинамических характеристик химической реакции (DG, DH, DS, KР) по величине ЭДС гальванического элемента. 6. Применение измерений ЭДС гальванических элементов для определения различных физико-химических величин (изменение энергии Гиббса, константы равновесия, температурного коэффициента ЭДС и расчет теплового эффекта реакции, константы диссоциации слабой кислоты, коэффициента активности). 7. Обратимые и необратимые гальванические элементы. 8. Химические, концентрационные, окислительно-восстановительные гальванические элементы: схематическая запись элемента, уравнение химической реакции, протекающей при работе элемента, уравнение для расчета ЭДС. 9. Гальванические элементы с переносом и без переноса ионов. 10. Компенсационный метод измерения ЭДС гальванического элемента. Нормальный элемент Вестона. 11. Потенциометрия. Измерение рН потенциометрически. Принцип метода. Электроды определения, используемые для измерения рН. 12. Измерение рН "Иономером универсальным ЭВ - 74" с использованием стеклянного электрода.
ЛАБОРАТОРНАЯ РАБОТА: "ОПРЕДЕЛЕНИЕ рН РАСТВОРА ПРИ ПОМОЩИ СТЕКЛЯННОГО ЭЛЕКТРОДА".
рН – это отрицательный десятичный логарифм активности (концентрации) ионов водорода. Измерение рН основано на определении потенциала электрода, потенциал которого зависит от активности (концентрации) ионов водорода или на измерении ЭДС гальванического элемента, составленного из электрода сравнения и индикаторного электрода (электрода определения), потенциал которого зависит от активности или концентрации ионов водорода. В рН-метрии в качестве индикаторных электродов используют водородный электрод, хингидронный, стеклянный и др. электроды. В данной работе используется стеклянный электрод. Измерение рН проводят при помощи прибора "Иономера универсального ЭВ-74" (Описание прибора см. в приложении).
Приложение ОПИСАНИЕ ПРИБОРА. Прибор состоит из 2 узлов: гальванического элемента и потенциометра. В гальваническом элементе используют стеклянный электрод, опущенный в исследуемый раствор; электродом сравнения служит насыщенный хлорсеребряный электрод. Потенциометр служит для измерения ЭДС гальванического элемента. На передней панели потенциометра имеется шкала прибора, позволяющая сделать отсчет рН раствора (рХ) или ЭДС гальванического элемента. Шкала прибора имеет две подшкалы - нижнюю, позволяющую определить приблизительное значение рН (или Е) и рассчитанную на 20 единиц, и верхнюю, разбитую на 5 единиц, с помощью которой измеряют точное значение рН (или Е). Верхняя шкала имеет 3 ряда цифр: верхний ряд - измерение температуры раствора от 0°С до 100°С; нижний - от 0 до 5; им пользуются, если измеряют рН в интервалах от 4 до 9, от 9 до 14, от 14 до 19. Отсчет по этому ряду цифр производят следующим образом: определяют положение стрелки и к показанию стрелки прибавляют первую цифру предела. Например, интервал от 4 до 9; стрелка прибора дает показание 1, 8, следовательно рН = 1, 8 + 4 = 5, 8. Средним рядом цифр пользуются при измерении рН в интервале от 1 до 4. На передней панели прибора находятся также следующие органы управления: 1. Тумблер "сеть" 2. Ручка переменных резисторов "Калибровка" (ее используют для настройки прибора по буферным растворам с известным значением рН). 3. Ручка "температура раствора". 4. 5 клавиш выбора рода работы
Пять клавиш выбора диапазона измерений 1. диапазон грубого измерения: -1-19 2. диапазоны точных измерений от -1 до 4; от 4 до 9; от 9 до 14; от 14 до 19 Корректор нуля.
ЛИТЕРАТУРА: 1. Евстратова К. И., Купина Н. А., Малахова Е. Е. "Физическая и коллоидная химия". М. 1990 - стр.160-200. 2. Стромберг А. Г., Семченко Д. П. "Физическая химия". М. 1999 - стр. 265-275. 3. 3. Голиков Г.А. «Руководство по физической химии». М. 1988. стр. 245-248 3. Лекционный материал.
ЗАНЯТИЕ №6 ЗАНЯТИЕ №7 З А Н Я Т И Е №8 ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ: КОНДУКТОМЕТРИЯ, ПОТЕНЦИОМЕТРИЯ, ПОЛЯРОГРАФИЯ. (Итог)
При подготовке к итоговому занятию по электрохимии рекомендуется пользоваться методическими рекомендациями на предыдущие занятия по этой теме.
ЛИТЕРАТУРА
1. Евстратова К. И., Купина Н. А., Малахова Е. Е. "Физическая и коллоидная химия". М. 1990 - стр.160-200. 2. Стромберг А. Г., Семченко Д. П. "Физическая химия". М. 1999 - стр. 234-275. 3. Голиков Г.А. «Руководство по физической химии». М. 1988. стр. 215-248. 4. Лекционный материал.
ЗАНЯТИЕ №9 СВОЙСТВА БУФЕРНЫХ РАСТВОРОВ
I ПЛАН ИЗУЧЕНИЯ ТЕМЫ 1. Буферные растворы: определение понятия. 2. Состав буферных растворов. 3. Механизм буферного действия при добавлении к буферному раствору небольших количеств сильной кислоты, щелочи или при разведении. 4. Уравнение для расчета рН буферных растворов (уравнение Гендерсона-Гассельбаха), образованных слабой кислотой и солью этой кислоты и сильного основания или слабым основанием и солью этого основания и сильной кислот. Вывод уравнения. 5. Факторы, влияющие на величину рН буферных растворов. 6. Использование уравнения Гендерсона-Гассельбаха для: а. Объяснения механизма действия буферных растворов при разведении. б. Выделения факторов, от которых зависит рН буфера. в. Расчета рН буфера, рК слабого электролита, входящего в его состав, соотношения концентраций компонентов (или объемов компонентов), необходимого для приготовления буфера с заданным значением рН. 7. Зона буферного действия - качественная и количественная характеристика. Интервал соотношения концентрацией буферных растворов, определяемых зоной буферного действия. 8. Буферная емкость - качественная и количественная характеристика. 9. Зависимость величины буферной емкости от: а. Концентрации буферного раствора. б. Соотношения концентраций компонентов буферного раствора. в. Природы буфера. 10. Буферные кривые, их анализ. 11. Способы приготовления буферных растворов. 12. Практическое использование буферных растворов. 13. Значение буферных систем для биологии, медицины.
II. ЦЕЛЬ САМОПОДГОТОВКИ: 1. Изучить свойства буферных растворов 2. Научиться решать задачи с использованием уравнения Гендерсена-Гассельбаха и уравнений буферной ёмкости раствора. 3. Научиться моделировать буферные растворы. 4. Понять химические основы механизма коррекции рН жидкостей организма человека буферными растворами.
III. ИСХОДНЫЙ УРОВЕНЬ ЗНАНИЙ, НЕОБХОДИМЫХ ДЛЯ ИЗУЧЕНИЯ ДАННОЙ ТЕМЫ: 1. Свойства растворов сильных и слабых электролитов. 2. Равновесие, состояние равновесия, константа равновесия. 3. рН растворов и методы его вычисления. 4. Способы выражения концентрации растворов. 5. Нахождение логарифмов и антилогарифмов чисел для вычисления рН. 6. Кислотно-основные реакции. 7. Определение рН при помощи индикаторов. 8. Владение техникой титрования.
IV. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ: 1. Что такое буферный раствор (система)? 2. Из чего состоят буферные системы? 3. Какие виды буферных систем (растворов) вы знаете? 4.Назовите состав следующих буферных растворов: а) аммиачный б) ацетатный в) фосфатный г) карбонатный. 5. Напишите уравнения реакции взаимодействия компонентов буферных систем с кислотой (ионное и молекулярное). Какой компонент будет здесь в первую очередь использоваться? 6. Какой компонент буферного раствора используется при добавлении избытка основания или щёлочи? Приведите примеры в виде молекулярных и ионных уравнений. 7. Выведите уравнение Гендерсена-Гассельбаха для расчёта концентрации ионов водорода в буферном растворе в общем виде. Как будет выглядеть это уравнение в логарифмическом виде для ацетатной буферной системы? 8. Что произойдёт со значением рН буферной системы, если в уравнении Гендерсена-Гассельбаха соотношение кислоты и её соли (или основания и её соли) изменить в 10 раз? 9. Что называется буферной ёмкостью? По каким уравнениям её можно рассчитать? В каких единицах она выражается и от чего зависит? 10. При каких условиях в буферной системе ёмкость по кислоте совпадает численно с ёмкостью по основанию? 11. Перечислите основные буферные системы организма. Какова доля в % каждой из них в общей сумме буферных оснований? 12. Каков нормальный рН крови человека? Чем обусловлено постоянство рН крови человека? 13. Приведите примеры введения лечебных растворов (каких) при патологических сдвигах кислотно-щелочного равновесия. Продемонстрируйте это уравнениями соответствующих реакций.
V Лабораторная работа ПРИГОТОВЛЕНИЕ АЦЕТАТНОГО БУФЕРНОГО РАСТВОРА С ЗАДАННЫМ ЗНАЧЕНИЕМ рН И ИЗМЕРЕНИЕ ЕГО БУФЕРНОЙ ЕМКОСТИ Буферными называют растворы, способные поддерживать постоянство рН среды при добавлении небольших количеств кислоты, щелочи или при разведении. Буферные растворы используются для поддержания необходимой кислотности среды при проведении ряда химических реакций в лаборатории и в различных технологических процессах; как стандартные растворы при определении рН; при определении ИЭТ белков и др. Если необходимо приготовить буферный раствор, состоящий из слабой кислоты и соли, образованной этой кислотой и сильным основанием, то для расчета следует использовать уравнение в виде:
При равенстве концентраций растворов кислоты и соли, взятых для приготовления буферного раствора, уравнение будет иметь вид:
Задание №1: Приготовить 20 мл ацетатного буферного раствора с заданным преподавателем значением рН, используя растворы СН3СООН и СН3СООNa c концентрациями 0,1 моль/л. значение константы диссоциации СН3СООН принять равным 1,75 10–5. I. Рассчитать объемы растворов кислоты и соли, которые надо взять для смешивания. II. Приготовить буферный раствор. В сухую колбу или стакан внести, отмерив пипеткой рассчитанные объемы (мл) растворов СН3СООН и СН3СООNa с концентрациями 0,1 моль/л. Содержимое колбы перемешать. Задание №2 Определить буферную емкость полученного буферного раствора методом потенциометрии. VI. ЛИТЕРАТУРА: 1. К.И.Евстратова, Н.А.Купина, Е.Е.Малахова. Физическая и коллоидная химия. М., 1990, с.114-116, 123-131. 2. Методические рекомендации к формированию практических навыков по физической и коллоидной химии. Курск,1999. 3. М.И.Равич-Щербо, В.В.Новиков. Физическая и коллоидная химия. М., 1975, с.90-100. 4. Ленский А. С. Введение в бионеорганическую и биофизическую химию. М., Высшая школа, 1989г. 5. Зеленин Химия: Учебник для медицинских вузов.- Сп-Б.: Спецлитература, 1997, 163-178с. 6. Лекционный материал.
Список дополнительной литературы:
1. Ганг Р. Физическая химия с приложением к биологическим системам. М., Мир,1980. 2. Уильямc В., Уильямc Х. Физическая химия для биологов. М., Мир, 1980. 3. Бладугрен В. Физическая химия в медицине и биологии М., Иностр.лит-ра,
З А Н Я Т И Е №10 РЕФРАКТОМЕТРИЯ ПЛАН 1. Показатель преломления. 2. Факторы, влияющие на показатель преломления. 3. Связь показателя преломления с диэлектрической проницаемостью. 4. Зависимость показателя преломления от состава. 5. Рефрактометрия. Аппаратура, область применения. При подготовке к занятию использовать методические рекомендации предыдущего занятия.
Литература. 1. Евстратова К.И., Купина Н.А., Малахова Е.Е. "Физическая и коллоидная химия". М. 1990 - стр. 251-256. 2. Лекционный материал.
ЗАНЯТИЕ №11 ЛАБОРАТОРНАЯ РАБОТА ИЗУЧЕНИЕ КИНЕТИКИ РЕАКЦИИ ВОССТАНОВЛЕНИЯ ГЕКСАЦИАНОФЕРРАТА (III) КАЛИЯ АСКОРБИНОВОЙ КИСЛОТОЙ При окислении аскорбиновой кислоты слабым окислителем гекса- цианоферратом (III) образуется дегидроаскорбиновая кислота. Реакция протекает по уравнению: С6Н8О6 + 2 [Fe (CN) 6]3- = C6H6O6 + 2 [Fe (CN) 6]4-+ 2H+. Реакция идет в кислой среде и является многоступенчатой. В зависимости от соотношения исходных концентраций аскорбиновой кислоты и гексацианоферрата (III) реакция может протекать по I-му или II-му порядку. За скоростью реакции можно следить по изменению количества израсходованного гексацианоферрата (III) во времени. Содержание [Fe(CN)]3- определяется на фотоэлектроколориметре при длине волны 400-450 нм.
СХЕМА ВЫПОЛНЕНИЯ ЛАБОРАТОРНОЙ РАБОТЫ
Приложение 1.
Оформить работу, сделать вывод.
Приложение 2. ОПРЕДЕЛЕНИЕ ОПТИЧЕСКОЙ ПЛОТНОСТИ РАСТВОРА НА ФОТОЭЛЕКТРОКОЛОРИМЕТРЕ КФК-2.
1. Колориметр включить в сеть за 15 мин до начала измерений для прогрева прибора. 2. Ввести светофильтр, соответствующий длине волны 400-440 нм. 3. Установить минимальную чувствительность колориметра, для чего ручку "ЧУВСТВИТЕЛЬНОСТЬ" установить в положение "I", ручку "УСТАНОВКА" 100 "ГРУБО" в крайнее левое положение. 4. Проверить установку стрелки колориметра на "О" по шкале коэффициентов пропускания Т при открытом кюветном отделении. 5. Если стрелка смещена от нулевого положения, ее подводят к нулю с помощью потенциометра "НУЛЬ", выведенного под шлиц. 6. Заполнить одну кювету дистиллированной водой (растворителем или контрольным раствором) и поместить ее в кюветодержатель. Крышку кюветного отделения закрыть. 7. Ручками "ЧУВСТВИТЕЛЬНОСТЬ" и "УСТАНОВКА 100 ГРУБО" и "ТОЧНО" установить отсчет 100 по шкале колориметра. Ручка "ЧУВСТВИТЕЛЬНОСТЬ" может находиться в одном из 3-х положений: "1", "2" или "3". 8. Во вторую кювету внести исследуемый раствор, поместить ее в кюветодержатель и поворотом ручки кюветодержателя до упора заменить кювету с контрольным раствором кюветой с исследуемым раствором. 9. Снять отсчет по шкале колориметра в единицах оптической плотности Д (нижняя шкала).
ЗАНЯТИЕ №12 КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ РАЗЛИЧНЫХ ПОРЯДКОВ
ПЛАН ИЗУЧЕНИЯ ТЕМЫ 1. Вывод уравнения кинетики реакции 0 порядка. Константа скорости и свойства реакций 0 порядка. 2. Вывод уравнения кинетики реакции 1 порядка. Константа скорости и свойства реакций 1 порядка. 3. Вывод уравнения кинетики реакции 2 порядка. Константа скорости и свойства реакций 2 порядка. 4. Реакции III порядка. 5. Реакции дробных порядков. 6. Обобщенное уравнение кинетики. 7. Сложные реакции. 8. Способы нахождения порядка химической реакции. 9. Решение задач.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ: 1. Приведите размерность для константы скорости реакции I порядка. 2. Приведите способ графического определения константы скорости химической реакции. 3. Приведите уравнение для расчета константы скорости химической реакции I порядка по результатам поляриметрических измерений при изучении реакции инверсии тростникового сахара. 4. Приведите уравнение для расчета константы скорости химической реакции I порядка по величинам концентрации реагирующих веществ. 5. Назовите основные свойства реакций I и II порядков. 6. Дайте определение понятия “период полупревращения”. 7. Приведите уравнение для расчета периода полупревращения для реакций I и II порядков. 8. Для реакции разложения пероксида водорода в водном растворе определили период полупревращения при различных исходных концентрациях. Были получены следующие данные:
Каков порядок реакции разложения пероксида водорода? 9. Время, за которое половина тросникового сахара, находящегося в 20% растворе, превратилась в глюкозу и фруктозу, оказалось равным 136 минут. За какое время подвергнется гидролизу на 50% сахар, находящийся в 10% растворе? 10. В сосуде имеется 0,025 г радона. Период полураспада его равен 3,82 дня. Какое количество радона останется через 7,64 дня. 11. Назовите четыре способа определения порядка реакции.
ЛИТЕРАТУРА: 1. Евстратова К. И., Купина Н. А., Малахова Е. Е. "Физическая и коллоидная химия". М. стр.260-269. 2. Стромберг А. Г., Семченко Д. П. "Физическая химия". М. стр. 300-314. 3. Голиков Г.А. «Руководство по физической химии». М. 1988. стр.258-265. 4. Лекционный материал.
ЛАБОРАТОРНАЯ РАБОТА ОПРЕДЕЛЕНИЕ КОНСТАНТЫ СКОРОСТИ РЕАКЦИИ ОКИСЛЕНИЯ ИОДИСТОВОДОРОДНОЙ КИСЛОТЫ ПЕРЕКИСЬЮ ВОДОРОДА.
Реакция протекает по уравнению Н2О2 + HJ à 2H2O + J2. Количество прореагировавшей Н2О2 oпределяют по эквивалентному количеству выделившегося иода, который титруют раствором тиосульфата натрия непосредственно в реакционной смеси. Иодистоводородную кислоту получают при взаимодейтсвии серной кислоты с иодидом натрия или калия. 2NaJ + H2SO4à Na2SO4 + 2HJ (а); H2O2 + 2HJà 2H2O + J2 (б); J2 + 2Na2S2O4à 2NaJ + Na2S4O6 (в). Реакции (а) и (в) протекают практически мгновенно так, что скорость всего процесса определяется скоростью реакции (б). Иодид натрия, прореагировавший в реакции (а) регенерируется в ре- акции (в); таким образом, концентрация NаJ и HJ остаются постоянными. Следовательно, скорость реакции между H2O2 и HJ зависит только от концентрации H2O2. Для вычисления константы скорости этой псевдомолекулярной реакции можно применить уравнение первого порядка. Упрощенно измерение скорости реакции можно проводить по определению времени t, необходимого для появления окраски свободного иода с крахмалом после добавления к раствору определенного количества тиосульфата натрия. ЗАДАНИЯ: 1. Определить изменение концентрации свободного иода во времени при двух температурах. 2. Рассчитать константу скорости по кинетическому уравнению и графически.
ВЫПОЛНЕНИЕ РАБОТЫ:
В колбу емкостью 200 мл влить 100 мл 0, 4 % раствора NaJ и 5 мл 2 N H2SO4. На горло колбы надеть утяжелитель, например, кольцо из толстой свинцовой проволоки. Поставить колбу в термостат при 250С. Туда же поместить пробирку с 15 мл 0, 05н Н2О2. Над колбой установить бюретку с 0, 05н Na2S2O3. Через 10-15 мин, когда растворы примут постоянную температуру, в колбу влить из бюретки 1 мл раствора Na2S2O3, 5 капель 0, 5%-ного раствора крахмала (индикатор на иод) и 15 мл 0, 05н Н2О2 из пробирки. Тщательно перемешать содержимое колбы. По секундомеру отметить и записать момент первого появления голубого окрашивая (t0). Быстро добавить еще 1 мл раствора Na2S2O3, перемешать до исчезновения окрашивания и вновь отметить момент появления окрашивания (t1). Эти операции повторить 6-8 раз при включенном секундомере. Промежутки времени t1, t2 и т. д. отсчитывать с момента первого появления окрашивания t0. При 250С реакция протекает медленно. Чтобы довести ее до конца в короткий срок, в смесь вводят катализатор - 5 капель 1н раствора молибдата аммония. Выделяется большое количество иода, которое оттитровывают тиосульфатом из той же бюретки до обесцвечивания раствора. Объем тиосульфата натрия, израсходованный на титрование, эквивалентен взятым для реакции 15 мл Н2О2. В момент времени t0 в растворе содержится (А-1) мл раствора Н2О2, так как к этому времени уже прореагирует ее количество, эквивалентное 1 мл раствора Na2S2O3. Tаким образом начальная концентрация раствора Н2О2: а = А - 1. К моменту второго появления окрашивания (t1) прореагирует еще 1 мл Na2S2O3, следовательно, количество прореагировавшего Н2О2: х = 1. К моменту третьего появления окрашивания: х = 2 и т. д. Тогда уравнение реакции первого порядка примет вид:
Данные занести в таблицу по форме:
Вычислить константу k1 для реакций I-го порядка по уравнению для каждого промежутка времени с точностью до 0, 001. Построить график в координатах lg[(a-1)-x]-t и рассчитать k1. Записать вывод. ЗАНЯТИЕ №13 ЛАБОРАТОРНАЯ РАБОТА ИЗУЧЕНИЕ ВЛИЯНИЯ ТЕМПЕРАТУРЫ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ.
Выполняется работа "Определение константы скорости реакции окисления иодистоводородной кислоты перекисью водорода" (методические рекомендации занятия 2). Работу выполняют при значении температуры 350С и с учетом данных, полученных при выполнении лабораторной работы на занятии N 2, вычисляют энергию активации и температурный коэффициент реакции.
ЗАНЯТИЕ №14 ЛАБОРАТОРНАЯ РАБОТА СРАВНЕНИЕ КАТАЛИТИЧЕСКОГО ЭФФЕКТА ФЕРМЕНТА КАТАЛАЗЫ КРОВИ, ИОНОВ J- И Fe3+ НА РЕАКЦИЮ РАЗЛОЖЕНИЯ ПЕРЕКИСИ ВОДОРОДА.
В данной работе скорость реакции разложения перекиси водорода в присутствии различных катализаторов качественно регистрируется по высоте столба пены, образующейся вследствие выделения кислорода. В три стеклянные колонки высотой 25 см и диаметром 6-7 мм, запаянные с одного конца, наливают по 0, 5 мл 5% раствора Н2О2. Затем в каждую колонку с интервалом в 2-3 мин вносят катализаторы. В одну из колонок добавляют 0, 2 мл гемолизированной крови (0, 1 мл крови разводят в 50 раз). В остальные две колонки вносят по 1 капле поверхностно активного вещества (сыворотку крови, разведенную в 30 раз) и по 0, 2 мл 10%-ных растворов KJ и FeCl3. Перекись водорода и растворы катализаторов перемешивают, отмечают начало реакции и через 1 мин определяют высоту столба пены. На основании полученных данных сравнить скорость разложения перекиси водорода под действием каталазы и ионов Fe3+ и J- .
ЗАНЯТИЕ №15 ОСНОВЫ ФАРМАКОКИНЕТИКИ Фармакокинетика - наука о здоровье, исследующая кинетику всасывания, распределения, метаболизма и экскреции лекарственных веществ в сопоставлении с соответствующими фармакологическим, терапевтическим или токсическим эффектами у человека. Методы изучения фармакокинетических процессов лежат в основе терапевтического мониторинга, сущность которого заключается в рациональном, управляемом, контролируемом и безопасном назначении лекарственных средств конкретному больному по индивидуально
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 280; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.149.244 (0.015 с.) |


 G0).
G0).
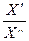



 D0 - оптическая плотность в начальный момент. Эта величина пропорциональна начальной концентрации С0.
Dt - оптическая плотность в данный момент. Эта величина пропорциональна Сt.
t - время от начала реакции.
2. Сопоставить значения констант скоростей реакции, рассчитанных по кинетическим уравнениям реакций I и II порядков. О порядке реакции судить по близким значениям К, рассчитанным по соответствующему уравнению.
3. Вычислить среднее значение константы скорости Кcр изучаемой реакции.
D0 - оптическая плотность в начальный момент. Эта величина пропорциональна начальной концентрации С0.
Dt - оптическая плотность в данный момент. Эта величина пропорциональна Сt.
t - время от начала реакции.
2. Сопоставить значения констант скоростей реакции, рассчитанных по кинетическим уравнениям реакций I и II порядков. О порядке реакции судить по близким значениям К, рассчитанным по соответствующему уравнению.
3. Вычислить среднее значение константы скорости Кcр изучаемой реакции.