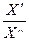Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамика гальванического элементаСодержание книги Поиск на нашем сайте
ПОТЕНЦИОМЕТРИЯ
I. ПЛАН ИЗУЧЕНИЯ ТЕМЫ 1. Гальванический элемент: устройство, принцип работы. 2. Электродвижущая сила гальванического элемента (Е) определение понятию. Расчет величины Е по значениям электродных потенциалов электродов, составляющих элемент. 3. Уравнение Нернста для расчета величины ЭДС гальванического элемента (вывод). 4. Стандартная ЭДС гальванического элемента (Е0), ее связь с изменением энергии Гиббса в стандартных условиях ( 5. Расчет термодинамических характеристик химической реакции (DG, DH, DS, KР) по величине ЭДС гальванического элемента. 6. Применение измерений ЭДС гальванических элементов для определения различных физико-химических величин (изменение энергии Гиббса, константы равновесия, температурного коэффициента ЭДС и расчет теплового эффекта реакции, константы диссоциации слабой кислоты, коэффициента активности). 7. Обратимые и необратимые гальванические элементы. 8. Химические, концентрационные, окислительно-восстановительные гальванические элементы: схематическая запись элемента, уравнение химической реакции, протекающей при работе элемента, уравнение для расчета ЭДС. 9. Гальванические элементы с переносом и без переноса ионов. 10. Компенсационный метод измерения ЭДС гальванического элемента. Нормальный элемент Вестона. 11. Потенциометрия. Измерение рН потенциометрически. Принцип метода. Электроды определения, используемые для измерения рН. 12. Измерение рН "Иономером универсальным ЭВ - 74" с использованием стеклянного электрода.
ЛАБОРАТОРНАЯ РАБОТА: "ОПРЕДЕЛЕНИЕ рН РАСТВОРА ПРИ ПОМОЩИ СТЕКЛЯННОГО ЭЛЕКТРОДА".
рН – это отрицательный десятичный логарифм активности (концентрации) ионов водорода. Измерение рН основано на определении потенциала электрода, потенциал которого зависит от активности (концентрации) ионов водорода или на измерении ЭДС гальванического элемента, составленного из электрода сравнения и индикаторного электрода (электрода определения), потенциал которого зависит от активности или концентрации ионов водорода. В рН-метрии в качестве индикаторных электродов используют водородный электрод, хингидронный, стеклянный и др. электроды. В данной работе используется стеклянный электрод. Измерение рН проводят при помощи прибора "Иономера универсального ЭВ-74" (Описание прибора см. в приложении).
Приложение ОПИСАНИЕ ПРИБОРА. Прибор состоит из 2 узлов: гальванического элемента и потенциометра. В гальваническом элементе используют стеклянный электрод, опущенный в исследуемый раствор; электродом сравнения служит насыщенный хлорсеребряный электрод. Потенциометр служит для измерения ЭДС гальванического элемента. На передней панели потенциометра имеется шкала прибора, позволяющая сделать отсчет рН раствора (рХ) или ЭДС гальванического элемента. Шкала прибора имеет две подшкалы - нижнюю, позволяющую определить приблизительное значение рН (или Е) и рассчитанную на 20 единиц, и верхнюю, разбитую на 5 единиц, с помощью которой измеряют точное значение рН (или Е). Верхняя шкала имеет 3 ряда цифр: верхний ряд - измерение температуры раствора от 0°С до 100°С; нижний - от 0 до 5; им пользуются, если измеряют рН в интервалах от 4 до 9, от 9 до 14, от 14 до 19. Отсчет по этому ряду цифр производят следующим образом: определяют положение стрелки и к показанию стрелки прибавляют первую цифру предела. Например, интервал от 4 до 9; стрелка прибора дает показание 1, 8, следовательно рН = 1, 8 + 4 = 5, 8. Средним рядом цифр пользуются при измерении рН в интервале от 1 до 4. На передней панели прибора находятся также следующие органы управления: 1. Тумблер "сеть" 2. Ручка переменных резисторов "Калибровка" (ее используют для настройки прибора по буферным растворам с известным значением рН). 3. Ручка "температура раствора". 4. 5 клавиш выбора рода работы
Пять клавиш выбора диапазона измерений 1. диапазон грубого измерения: -1-19 2. диапазоны точных измерений от -1 до 4; от 4 до 9; от 9 до 14; от 14 до 19 Корректор нуля.
ЛИТЕРАТУРА: 1. Евстратова К. И., Купина Н. А., Малахова Е. Е. "Физическая и коллоидная химия". М. 1990 - стр.160-200. 2. Стромберг А. Г., Семченко Д. П. "Физическая химия". М. 1999 - стр. 265-275. 3. 3. Голиков Г.А. «Руководство по физической химии». М. 1988. стр. 245-248 3. Лекционный материал.
ЗАНЯТИЕ №6
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 345; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.42.61 (0.006 с.) |

 G0).
G0).