
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электродные процессы. Классификация электродов.Содержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
I. ПЛАН ИЗУЧЕНИЯ ТЕМЫ: 1. Электродный потенциал. Механизм возникновения потенциала на металлической пластине, погруженной в раствор своей соли. 2. Схематическая запись электрода (полуэлемента). Уравнение окислительно-восстановительной реакции, сопровождающей образование электродного потенциала. 3. Факторы, влияющие на величину электродного потенциала. 4. Контактный и диффузионный потенциалы. 5. Стандартный электродный потенциал. 6. Уравнение Нернста для расчета величины электродного потенциала. 7. Классификация электродов по механизму возникновения электродного потенциала и по их применению. 8. Водородный электрод: устройство, механизм действия, уравнение окислительно-восстановительной реакции, сопровождающей образование электродного потенциала. Уравнение Нернста для расчета величины электродного потенциала. Недостатки водородного электрода.. 9. Электроды сравнения: хлорсеребряный и каломельный электроды. Устройство и механизм действия, уравнение окислительно-восстановительной реакции, сопровождающей образование электродного потенциала. Уравнение Нернста для расчета величины электродного потенциала. Их недостатки и преимущества. 10. Электроды определения (индикаторные), используемые для измерения рН: водородный, стеклянный. Устройство и механизм действия, уравнение окислительно-восстановительной реакции, сопровождающей образование электродного потенциала. Уравнение Нернста для расчета величины электродного потенциала. Их недостатки и преимущества.. 11. Ионоселективные электроды. 12. Уравнение Петерса для расчета величины электродного потенциала редокс-электродов.
II. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ: 1. На границе каких двух сред (фаз) возникают потенциалы: а) электродный; б) диффузионный; в) контактный? 2. Дайте определение: а) электродному потенциалу; б) стандартному электродному потенциалу; в) стандартному окислительно-восстановительному электродному потенциалу. 3. Назовите три фактора, от которых зависит величина электродного потенциала. 4. Приведите схему устройства, запишите уравнение окислительно-восстановительной реакции, сопровождающей образование потенциала, и уравнение для расчета величины электродного потенциала для электродов: а) водородного; б) хингидронного; в) каломельного; г) хлорсеребряного. 5. Что общего и чем отличаются стандартный водородный электрод и водородный электрод определения? 6. Приведите пример электрода, относящегося к: а) электродам I-го рода; б) электродам II-го рода; в) редокс-электродам. 7. Назовите основной признак электродов I-го рода, II-го рода, редокс-электродов. 8. Назовите основной признак и перечислите используемые в практике электроды сравнения. 9. Назовите основной признак электродов определения. 10. Назовите три электрода, используемые как электроды определения при измерении рН раствора. 11. Какие электроды можно использовать как электроды определения при измерении концентрации CuCl2 в растворе? 12. Можно ли измерить рН раствора с помощью цинкового электрода, опущенного в исследуемый раствор? Ответ обосновать. 13. Как можно измерить электродный потенциал? 14. ЭДС гальванического элемента, составленного из медного и цинкового электродов, опущенных соответственно в растворы солей меди и цинка, равна 1,1В. Потенциал медного электрода Рассчитайте потенциал цинкового электрода, учитывая, что
15. Приведите схему устройства стеклянного электрода.
III. ЛИТЕРАТУРА: 1. Евстратова К. И., Купина Н. А., Малахова Е. Е. "Физическая и коллоидная химия". М. 1990 - стр.160-179, 180-183. 2. Стромберг А. Г., Семченко Д. П. "Физическая химия". М. 1999 - стр. 247-265. 3. Голиков Г.А. «Руководство по физической химии». М. 1988. стр. 227-245. 4. Лекционный материал.
ЗАНЯТИЕ № 5
|
||||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 483; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.103.33 (0.005 с.) |

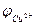 = + 0,34В.
= + 0,34В.



