
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятие об электродном потенциалеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Электроды – электрохимические системы, состоящие из металла или полупроводника, погруженного в раствор или расплав электролита. Фактически, это металлические или графитовые изделия (проводники первого рода), находящиеся в среде, проводящей электрический ток (проводники второго рода). Носителями свободных зарядов в проводниках первого рода являются электроны, а в проводниках второго рода – ионы обоих знаков. Металлы, как правило, имеют кристаллическое строение. В узлах кристаллической решетки расположены положительные ионы (катионы), находящиеся в равновесии с электронным газом: Me Á Men+ + nē. При погружении металла в раствор начинается сложное взаимодействие металла с компонентами раствора. Катионы металла выходят в электролит, а катионы электролита встраиваются в кристаллическую решетку металла. Со временем устанавливается равновесие между электродом и электролитом. В зависимости от того, куда смещено это равновесие, поверхность металла приобретает больший или меньший потенциал. В результате перераспределения зарядов на границе «металл – раствор» возникает двойной электрический слой (рис. 9.1) и возникает скачок потенциала между металлом и раствором.
Потенциал электрода, опущенного в электролит, называется электродным потенциалом. Его значения зависят от многих факторов: материала электрода, состава электролита, температуры, давления и т. д. Величину электродного потенциала измеряют относительно некоторого выбранного электрода сравнения, потенциал которого принимают равным нулю. В качестве электрода сравнения обычно принимают стандартный водородный электрод. Стандартным электродным потенциалом (j0) называется потенциал металла, погруженного в раствор собственной соли и измеренный относительно водородного электрода в стандартных условиях. Стандартные условия: концентрация ионов в растворе 1 моль/л, температура Т = 298 К, давление Р = 1,01325∙105 Па. По результатам измерений получен ряд стандартных электродных потенциалов (табл. 9.1), который позволяет дать количественную характеристику электрохимической активности металлов. Чем меньше значение φ0, тем сильнее выражены восстановительные свойства металла, т. е. он легче отдает электроны, легче окисляется. Чем больше значение φ0, тем сильнее окислительные свойства катиона металла, находящегося в растворе. Таблица 9.1 Стандартные электродные потенциалы φ0 некоторых металлов
Для вычисления электродных потенциалов в условиях, отличных от стандартных, используют уравнение Нернста:
где T – температура, К; F – число Фарадея, равное 96 500 Кл/моль; R – универсальная газовая постоянная, равная 8,314 Дж/(моль. К); n – число электронов, принимающих участие в элементарном акте окислительно-восстановительного процесса;
При T = 298 К формула Нернста приобретает вид:
Гальванический элемент Гальванический элемент – это химический источник тока, в котором энергия, выделяющаяся при протекании на электродах окислительно-восстановительной реакции, непосредственно преобразуется в электрическую энергию. Принцип работы гальванического элемента можно рассмотреть на примере элемента Даниэля – Якоби (рис 9.2).
Рис. 9.2. Схема гальванического элемента Даниэля – Якоби
Здесь I – стакан, содержащий раствор ZnSO4 в воде с погруженной в него цинковой пластинкой; II – стакан, содержащий раствор CuSO4 в воде с погруженной в него медной пластинкой; III – солевой мостик (электролитический ключ), который обеспечивает перемещение катионов и анионов между растворами; IV – вольтметр (нужен для измерения ЭДС, но в состав гальванического элемента не входит). Стандартный электродный потенциал цинкового электрода
Электрод, на котором идет реакция окисления или который посылает катионы в электролит, называется анодом. У рассматриваемого гальванического элемента в роли анода выступает цинковый электрод. Так как стандартный электродный потенциал цинка ниже, чем у меди, цинковому электроду приписывается условный заряд «–», а медному – «+». Электроны, освободившиеся в результате окисления, по внешней цепи переходят на медь (возникает электрический ток). На медном электроде происходит процесс восстановления катионов электролита Cu2+:
Электрод, на котором идет реакция восстановления или которыйпринимает катионы из электролита, называется катодом. Через электролитический ключ происходит движение ионов в растворе: анионов SO42– к аноду, катионов Zn2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Реакции (а) и (б) называются электродными реакциями. Складывая уравнения процессов, протекающих на электродах, получаем суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе:
или, с учетом анионов раствора:
В общем случае, суммарное уравнение окислительно-восстановительной реакции, протекающей в произвольном гальваническом элементе, можно представить в виде:
где индексы А и К относятся к металлам анода и катода соответственно. Реакции (в) – (д) называются токообразующими реакциями. Символическая запись (схема) гальванического элемента имеет вид:
Часто вместо растворов обозначают только катионы, содержащиеся в растворе:
Схема гальванического элемента Даниэля – Якоби имеет вид: Zn | ZnSO4 || CuSO4 | Cu Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента Е. Она вычисляется по формуле;
где φк и φа – электродные потенциалы катода и анода соответственно. Величина ЭДС элемента Даниэля – Якоби при стандартных условиях равна: Е = +0,34 – (–0,76) = 1,10 В. Электродвижущая сила Е характеризует способность гальванического элемента совершать электрическую работу во внешней цепи. Электрическая работа определяется максимальной полезной работой, совершаемой химической реакцией, которая равна изменению изобарно-изотермического потенциала ∆ G процесса. Связь между величиной ∆ G и ЭДС описывается уравнением:
где n – число электронов в элементарном окислительно-восстановительном акте, F – число Фарадея. Величина изменения изобарно-изотермического потенциала токообразующей реакции при стандартных условиях ∆ G 0 связана с константой равновесия этой реакции К равн соотношением
Гальванические элементы являются первичными (однократно используемыми) химическими источниками тока (ХИТ). Вторичными (многократно используемыми) ХИТ являются аккумуляторы. Процессы, протекающие при разряде и заряде аккумуляторов, взаимнообратны. Гальванические элементы, у которых электроды выполнены из одного и того же металла и опущены в растворы своих солей разной концентрации, называются концентрационными. Функцию анода в таких элементах выполняет металл, опущенный в раствор соли с меньшей концентрацией, например:
Пример 1. Составьте схему гальванического элемента, в основе которого лежит реакция: Mg + ZnSO4 = MgSO4 + Zn. Что является катодом и анодом в этом элементе? Напишите уравнения процессов, протекающих на этих электродах. Рассчитайте ЭДС элемента при стандартных условиях. Вычислите константу равновесия для токообразующей реакции. Решение В таблице находим значения стандартных электродных потенциалов систем Zn/Zn2+ и Mg/Mg2+:
Поскольку
На аноде идет процесс окисления:
На катоде – восстановление катионов среды:
Стандартная ЭДС гальванического элемента Е = φ0к – φ0а = –0,763 – (–2,37) = 1,607 В. По уравнениям (9.5) и (9.6) вычислим константу равновесия токообразующей реакции:
Потенцируя, находим К равн = 3,5 ∙1054. Поскольку К >>1, то токообразующая реакция практически необратима.
Пример 2. Составьте схему гальванического элемента, состоящего из цинкового и серебряного электродов, погруженных в растворы их солей. Концентрации ионов в растворах: C Zn2+ = 0,1 моль/л, C Ag+ = 0,01 моль/л. Укажите, какой электрод является катодом, а какой – анодом. Напишите уравнения реакций, протекающих на электродах, а также суммарное уравнение токообразующей реакции в гальваническом элементе. Рассчитайте ЭДС этого элемента. Решение Так как концентрации ионов не равны единице, то вначале рассчитаем потенциалы электродов, используя формулу Нернста. Если в условии задачи отсутствует значение температуры, то ее принимают равной стандартной температуре Т = 298 К. Поэтому будем использовать уравнение (9.2):
Подставим числовое значение концентрации в формулу Нернста, используя данные таблицы 9.1:
Из расчета видно, что Схема гальванического элемента:
Вычислим ЭДС элемента по формуле (9.4): Е = φк – φа = 0,741 – (-0,789) = 1,530 В. Теперь запишем электродные реакции. На аноде происходит процесс окисления:
а на катоде – процесс восстановления:
Складывая уравнения электродных процессов (с учетом равенства числа принимаемых и отдаваемых электронов), получаем суммарное уравнение токообразующей реакции: Zn + 2Ag+ = Zn2+ + 2Ag.
Задачи
221–226 Напишите уравнения катодного и анодного процессов и составьте схему гальванического элемента, при работе которого протекает следующая реакция (см. таблицу). На основании значений стандартных электродных потенциалов рассчитайте константу равновесия данной реакции и ЭДС элемента.
227–233 Рассчитайте значения электродных потенциалов металла, являющегося анодом, при различных концентрациях раствора: 10; 0,1; 0,01; 0,001 моль/л. Концентрация раствора, в который погружен катод, постоянна и равна 1 моль/л. Определите ЭДС. Постройте график зависимости ЭДС гальванического элемента от логарифма концентрации раствора, в который погружен анод. Напишите уравнение токообразующей реакции, протекающей в гальваническом элементе.
234–236 Одним из электродов гальванического элемента является металл (см. таблицу), погруженный в раствор своей соли с концентрацией ионов 0,01 моль/л, а другим – водородный электрод. ЭДС этого элемента составляет Е, В. Напишите уравнения катодной и анодной реакций, приведите схему гальванического элемента. Рассчитайте потенциал водородного электрода и концентрацию ионов водорода в растворе. Т = 298 K.
237–240 Запишите уравнения электродных реакций и составьте схему гальванического элемента, работа которого выражается уравнением, представленным в таблице. Укажите, какой электрод является катодом и анодом. Рассчитайте значения электродных потенциалов при концентрациях растворов анода С 1 и катода С 2 (см. таблицу). Определите ЭДС этого элемента.
241–244 Составьте схему гальванического элемента, состоящего из двух металлов Ме1 и Ме2, погруженных в раствор собственных солей с концентрацией ионов С 1 и С 2 (см. таблицу). Укажите, какой электрод является катодом и анодом. Напишите уравнения реакций, протекающих на данных электродах, а также суммарное уравнение токообразующей реакции в гальваническом элементе. Рассчитайте ЭДС этого элемента.
245 – 247 Рассчитайте значения электродных потенциалов металлов, приведенных в условии задачи, при концентрациях растворов С 1 (для 1-го металла) и С 2 (для 2-го металла). Определите анод и катод. Вычислите ЭДС элемента. Аналогичные расчеты проведите для концентраций растворов, уменьшенных в 10 раз. Изменится ли ЭДС? Приведите уравнения электродных реакций.
248 Какой гальванический элемент называется концентрационным? Составьте его схему. Напишите уравнения анодного и катодного процессов, вычислите ЭДС. Гальванический элемент состоит из серебряных электродов, опущенных: первый в 0,01 М, а второй в 0,1 М растворы AgNO3. Ответ: 0,059 В. 249 Составьте схему двух гальванических элементов, в одном из которых никель был бы анодом, в другом – катодом. Напишите для каждого из них уравнения реакций, протекающих на аноде и на катоде, и рассчитайте ЭДС гальванических элементов при стандартных условиях. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов уменьшить в 10 раз? 250 Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, проходящих на катоде и аноде.
КОРРОЗИЯ МЕТАЛЛОВ Коррозия – самопроизвольное разрушение металлов в результате взаимодействия с окислителями окружающей среды. Это окислительно-восстановительный процесс, в котором металл выступает в качестве восстановителя. Первопричиной коррозии является термодинамическая неустойчивость металла в окружающей среде и возможность его перехода в более устойчивое (окисленное) состояние. Иногда коррозию называют ржавлением. Ржавление – коррозия железа и его сплавов с образованием продуктов коррозии, состоящих в основном из гидроксидов железа разной степени гидратации, желто-коричневого цвета. Цветные металлы корродируют, но не ржавеют. По характеру разрушения коррозия делится на избирательную, сплошную (равномерную и неравномерную), локальную (пятнистую, питтинговую, или язвенную), коррозионное растрескивание и межкристаллическую коррозию. По виду среды, в которой протекает процесс, коррозия бывает почвенной, атмосферной, электролитической, газовой, под действием блуждающих токов. В зависимости от механизма протекания и внешних условий коррозию подразделяют на химическую и электрохимическую. Химическая коррозия протекает в газовой среде при повышенных температурах (в отсутствие влаги) или в жидких неэлектролитах. Сущность процессов коррозии этого вида сводится к окислительно-восстановительной реакции, осуществляемой при непосредственном переходе электронов металла на окислитель. В качестве окислителя могут выступать такие газы, как O Развитие коррозии происходит за счет переноса катионов металла, частиц окислителя или электронов через образовавшуюся пленку. Если пленка плотная, сплошная, хорошо сцепленная с металлом, то дальнейшее окисление металла протекает очень медленно. Такие пленки могут быть использованы для защиты металлов от коррозии. Наоборот, рыхлая пленка не способна защитить металл от последующего окислительно-восстановительного взаимодействия с окружающей средой. Защитные свойства образовавшихся продуктов коррозии определяется на основании расчета фактора рыхлости Ф:
где V V М – молярная масса продуктов коррозии; r n – число атомов металла в продукте коррозии; А – атомная масса металла; r Если Ф < 1, то образуется пленка, частично покрывающая поверхность металла (рыхлая пленка). Сплошная пленка, обладающая защитным действием, получается лишь при условии 1< Ф < 2,5. Если фактор рыхлости Ф > 2,5, то в пленке возникают напряжения, разрушающие ее и нарушающие сплошность (пленка вспучивается и растрескивается). Пример 1. При химической коррозии железа в атмосфере сухого воздуха, содержащего газообразные H2S и O2, образуются пленки FeS и FeO. Напишите уравнения образования этих соединений. Рассчитайте фактор рыхлости Ф и сделайте вывод о защитных свойствах пленок. Плотность r Решение Пленки образуются при взаимодействии металла с агрессивной средой в результате следующих реакций: 2Fe + 2H2S + O 2Fe + O2 = 2FeO. Подставив числовые значения в (10.1), находим фактор рыхлости:
Поскольку для сульфидной пленки Ф > 2,5, то возможно ее растрескивание и нарушение сплошности. Критерий Ф для оксидной пленки лежит в интервале 1 < Ф < 2,5. Следовательно, пленка FeO является сплошной и обладает хорошими защитными свойствами. Электрохимическая коррозия – самопроизвольное разрушение металлов в присутствии электролита в результате образования гальванических пар при контакте разнородных металлов, например запорной арматуры и трубопровода, или множества микрогальванических элементов на поверхности металлического сплава. К числу важнейших типов электрохимической коррозии относится коррозия атмосферная, подземная, в морской и пресной воде, сероводородная, кислотная, щелочная, в расплавленных солях, в водно-органических и органических средах. Основное отличие электрохимической коррозии от химической заключается в пространственном разделении реакций окисления металла и восстановления окислителя, протекающих на катодных и анодных участках. При электрохимической коррозии процессы окисления и восстановления протекают на участках, имеющих различное химическое строение или физическое состояние поверхности, то есть химическую и энергетическую неоднородность. Эта неоднородность может возникать при неодинаковом фазовом и химическом составе металла и сплава, при наличии примесей в металле, при неодинаковой химической обработке, при неодинаковой концентрации окружающего электролита, при неоднородности и разной толщине пленок продуктов коррозии и т. д. Количественно различную активность поверхностных участков можно охарактеризовать величиной электродного потенциала φ, который возникает на границе «металл – раствор» (табл. 9.1). Более активные участки поверхности имеют меньшее значение электродного потенциала (более отрицательное) и называются анодными участками. Участки с меньшей активностью называются катодными. На анодных участках происходит окисление металла, то есть его разрушение: Mе где Mе Ме0 – металл. Электроны остаются внутри металла и перемещаются от анодных участков к катодным участкам, с которыми они непосредственно контактируют и на которых происходит восстановление ионов и молекул окислителя, находящихся в коррозионной среде. В зависимости от состава среды протекают следующие процессы: – в кислой среде: 2Н – в нейтральной или слабощелочной среде: 2Н2O + 2ē = Н Наиболее вероятным катодным процессом в нейтральной среде при наличии растворенного в воде воздуха (атмосферная, почвенная коррозия, влажный воздух) является следующий: O2 + 2H2O + 4ē = 4OH Пример 2. Составьте электронные уравнения катодного и анодного процессов коррозии железного сплава с никелем в соляной кислоте и во влажном воздухе. Каков состав продукта коррозии? Решение Выпишем из таблицы 9.1 значения стандартных электродных потенциалов металлов: φ0 В кислой среде электронные уравнения процессов имеют вид: – анодная реакция: Fе0 – 2ē = Fе2+; – катодная реакция: 2Н+ + 2ē = Н02. Продуктами коррозии являются хлорид железа FeCl Во влажном воздухе на катодном и анодном участках происходят следующие реакции: – анодная реакция: Fе – катодная реакция: 2Н Продукты коррозии Fе В присутствии влаги и кислорода происходит дальнейшее окисление железа до трехвалентного состояния: 4Fе(OH) Для количественной оценки коррозионной стойкости металлов используют массовый (j) и глубинный (П) показатели. Скорость химической реакции определяется из соотношения:
где ∆ m – изменение массы образца, г;
S – площадь поверхности коррозии, м2. Глубинный показатель коррозии П равен:
где ∆ h – толщина металла, разрушенного в течение времени t. Величины П и j связаны соотношением:
или
где r – плотность металла, г /см3. По вышеприведенным показателям оценивается, как правило, общая коррозия системы. Защита от коррозии Поскольку, как отмечалось выше, процесс электрохимической коррозии заключается в протекании взаимосвязанных катодной и анодной реакций, то замедление одной из них приводит к снижению скорости коррозионного процесса в целом. Методы защиты от коррозии можно разделить на три группы: – воздействие на металл; – воздействие на агрессивную среду; – комбинированные методы защиты. К первой группе относятся: а) легирование металлов – создание экранирующего поверхностного слоя или введение элементов, понижающих катодную или анодную активность сплава; б) обработка поверхности металла – термическая обработка, напыление, механическая обработка (наклеп и т. п.), модифицирование ржавчины на поверхности; в) нанесение защитных покрытий; г) подбор коррозионно-стойких материалов; д) рациональное конструирование – вывод отдельных узлов конструкции из агрессивных сред. Вторая группа методов защиты включает: а) применение ингибиторов коррозии; б) деаэрация среды; в) создание искусственных сред (обработка водных сред, применение нейтральных сред, осушение воздуха). Третья группа методов защиты использует комбинацию вышеперечисленных методов. Защитные покрытия можно подразделить на органические (битум, краски, эмали, лаки), неорганические (оксидные, фосфатные, нитридные и другие пленки) и гальванические (металлические, полученные путем электролиза). Неорганические (химические) покрытия получают обработкой металла определенными химическими веществами. При взаимодействии этого вещества с поверхностью металла образуется пленка прочного неорганического соединения, которая предохраняет металл от разрушения. Гальванические покрытия делятся на катодные и анодные (рис. 10.1) в зависимости от соотношения стандартных электродных потенциалов защищаемого материала j0 Анодное покрытие очень эффективно, так как оно, разрушаясь, предохраняет защищаемый металл от разрушения. Примером анодного покрытия по отношению к железу являются цинковые и магниевые покрытия сталей. Если j0 среда среда
Рис. 10.1. Гальванические покрытия: а) анодное покрытие j01 > j02; б) катодное покрытие j01 < j02. Ме1 – защищаемый металл, Ме2 – металл покрытия (А – анод, В – катод) Электрохимическая защита подразделяется на катодную, протекторную и анодную. Первые два вида электрохимической защиты осуществляются с помощью создания гальванического элемента, в котором роль катода выполняет защищаемый металл. Это достигается с помощью контакта его с более активным металлом – протектором (имеющим меньшее значение стандартного электродного потенциала) или подключения изделия к отрицательному полюсу внешнего источника тока (катодная защита). Анодная защита происходит при подключении металла к положительному полюсу источника тока и формированию на его поверхности прочного оксидного слоя за счёт анодного окисления под действием электролиза (и смещении его электродного потенциала в область пассивного состояния). Ингибиторами называют добавляемые в небольших количествах в агрессивную среду вещества, которые накапливаются на границе «металл – электролит» и снижают скорость коррозии. Эффективность действия ингибиторов оценивается величинами коэффициента торможения К и степени защиты Z:
где ј ј – скорость коррозии в растворе с ингибитором. Величина К показывает, во сколько раз снижается скорость коррозии металла при введении ингибитора. Величина Z характеризует относительное понижение скорости коррозии. На защитное действие ингибиторов существенное влияние оказывает ряд внешних и внутренних факторов коррозии: кислотность среды, температура, природа кислоты и защищаемого материала, природа растворителя и самого ингибитора, концентрация ингибитора, перемешивание и др. Пример 3. Можно ли использовать цинковое покрытие для защиты стального изделия от коррозии во влажном воздухе? Составьте электронные уравнения катодного и анодного процессов коррозии, наблюдаемой при нарушении этого покрытия. Каков состав продуктов коррозии? Какой должна быть толщина покрытия, чтобы оно прослужило 5 лет, если величина его глубинного показателя П равна 0,16 мм/год? Покрытие считается недействующим, если его остаточная толщина составляет 18 % от первоначального значения. Решение Сопоставляя электродные потенциалы j0Zn/Zn2+ = –0,76 В и j0Fe/Fe2+= –0,44 В, видим, что j0Zn < j0Fe.Следовательно, цинк по отношению к железу является анодом. Цинковое покрытие – анодное покрытие. На аноде идет процесс окисления: Zn – 2ē = Zn2+. На катоде (Fe) – процесс восстановления частиц среды (во влажном воздухе это кислород и вода): 2Н Продукты коррозии: Zn2+ + 2OH- = Zn(OH)2. При нарушении покрытия сталь не растворяется, следовательно, цинковое покрытие использовать можно. Толщину покрытия ∆ h можно найти из уравнения:
откуда ∆ h = П×t = 0,16.5 = 0,8 мм. Но коррозии подвержено 82 % первоначальной толщины. Тогда вся толщина покрытия должна быть равна 100 %:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 7530; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.2.5 (0.014 с.) |


 ,
,
 – концентрация ионов металла в растворе, моль/л.
– концентрация ионов металла в растворе, моль/л. .
.

 . Стандартный электродный потенциал медного электрода
. Стандартный электродный потенциал медного электрода  . Так как
. Так как  , то атомы цинка будут окисляться:
, то атомы цинка будут окисляться:




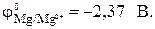
 , то магниевый электрод выполняет функцию анода, а цинковый – катода. Схема гальванического элемента имеет вид:
, то магниевый электрод выполняет функцию анода, а цинковый – катода. Схема гальванического элемента имеет вид:






 . Поэтому цинковый электрод выполняет функцию анода, а серебряный – катода.
. Поэтому цинковый электрод выполняет функцию анода, а серебряный – катода.

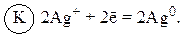
 , SO
, SO  ,
,
 – мольный (молярный) объем продуктов коррозии (оксида, хлорида, сульфида и др.);
– мольный (молярный) объем продуктов коррозии (оксида, хлорида, сульфида и др.); – мольный (молярный) объем металла, пошедшего на образование оксида;
– мольный (молярный) объем металла, пошедшего на образование оксида; = 7,87; r
= 7,87; r  = 4,7; r
= 4,7; r  = 5,7 г/см
= 5,7 г/см  .
. ,
, .
. – nē → Mе
– nē → Mе  ,
, + 2ē = Н
+ 2ē = Н  .
. = –0,44 В, φ0
= –0,44 В, φ0  = –0,25 В. Поскольку φ0
= –0,25 В. Поскольку φ0  ;
; .
. , г/м2.ч (или г/м2.год),
, г/м2.ч (или г/м2.год),
 – время коррозии, час или год;
– время коррозии, час или год; , мм/год,
, мм/год,
 , если j измеряется в г/м2.год,
, если j измеряется в г/м2.год, , если j измеряется в г/м2.ч,
, если j измеряется в г/м2.ч, и покрытия j0
и покрытия j0 


 – скорость коррозии в растворе без ингибитора;
– скорость коррозии в растворе без ингибитора; , мм/год,
, мм/год,



