
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая связь и строение молекулСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
При изучении этой темы [1–4] обратите внимание на основные свойства и физические причины образования химических связей. Химическая связь – это взаимодействие атомов в устойчивой многоатомной системе (молекуле, кристалле и т. д.), обусловленное перекрыванием их электронных оболочек. Как известно, взаимодействие атомов имеет электродинамическую природу, а формирование химической связи определяется законами квантовой механики. Напомним основные свойства химической связи: насыщаемость, направленность и поляризуемость. Для количественного описания связи вводят следующие характеристики: энергию и длину связи, валентные углы и др. Энергия связи – это энергия, которую необходимо затратить на разрыв связи. Ее величина характеризует прочность молекулы и зависит от характера связи, размеров взаимодействующих атомов, и др. Длина связи – это расстояние между ядрами взаимодействующих атомов. Длину связи измеряют в нанометрах (1 нм = 10–9м) или в ангстремах (1Å = 10–10 м). Она зависит от размеров атомов, а также от кратности связи, то есть количества электронных пар, связывающих два атома. Валентные углы – это углы между связями в молекуле. Основной химической характеристикой атома является его валентность, то есть способность образовывать определенное число химических связей. Валентность также является мерой насыщаемости химической связи, то есть способности атома присоединять ограниченное количество других атомов. Квантово-механический расчет межатомных взаимодействий осуществляется с помощью приближенных методов, среди которых следует выделить два основных: метод валентных схем (ВС) и метод молекулярных орбиталей (МО). Рассмотрим метод ВС, предполагающий, что атомные орбитали при взаимодействии атомов не изменяются. Благодаря взаимному перекрыванию внешних орбиталей атомов плотность электронного облака между ядрами повышается. Степень перекрытия АО зависит от симметрии атомных орбиталей. По учебнику [2] рассмотрите основные типы связи: s-, p-, d-. Обратите внимание, что именно s-связи в первую очередь определяют взаимное пространственное положение атомов в молекуле, валентные углы и геометрию молекулы в целом. Что касается p-связей, то они создают дополнительное упрочнение молекулы.
Электроны, принадлежащие двум взаимодействующим атомам и осуществляющие связь между ними, имеют противоположные направления спинов (обобществлённые электронные пáры). Образование таких пар возможно по двум различным механизмам. При обменном механизме происходит спаривание электронов, ранее принадлежавших двум разным атомам, сближающимся в процессе образования молекулы. Для возникновения таких пар необходимо наличие на внешних орбиталях каждого из атомов неспаренных электронов. В соответствии с этим валентность атома по обменному механизму (В
Из этой структуры видно, что атом фтора имеет один неспаренный электрон и его валентность в основном состоянии равна единице. Промотирование электронов на 3-й уровень (подуровни 2-го уровня исчерпаны) требует значительных затрат энергии и практически невозможно. По этой причине фтор, как правило, одновалентен. У атомов хлора идет заполнение 3-го квантового слоя, имеющего s-, p-, d- подуровни. Различие в их энергии намного меньше, чем между третьим и четвертым уровнями. Поэтому у атома хлора возможно промотирование электронов на свободные подуровни. Это видно из электронных структур:
Таким образом, у хлора может быть несколько разных валентностей. Отметим, что дополнительные валентности, обусловленные возбуждением атомов, характерны для всех элементов 3-го периода. Другой механизм образования химической связи – донорно-акцепторный. При его осуществлении пара электронов на внешней орбитали одного из атомов (донора) становится общей для двух атомов, если второй атом (акцептор) имеет свободную (вакантную) внешнюю орбиталь. Валентность атома по донорно-акцепторному механизму (B
Bобщ. = Bобм + Bд-а. Если в образовании химических связей от одного атома участвуют орбитали разных типов симметрии, но обладающие близкими энергиями и высокой плотностью, то часто используют их комбинации – гибридные орбитали. При этом достигается бóльшая наглядность в описании связи. Взаимную ориентацию гибридных орбиталей одного атома подбирают таким образом, чтобы обеспечить минимальную энергию взаимодействия электронов, находящихся на разных орбиталях. По учебнику [2] рассмотрите простейшие виды гибридизации, обратите внимание на вопросы устойчивости гибридных орбиталей. Гибридные орбитали, как правило, обладают более низкой симметрией, чем исходные (негибридизированные). При этом гибридные орбитали (будем использовать для них обозначение q) имеют промежуточные форму и энергию относительно исходных АО. Пример 1. Образование sp -гибридных орбиталей.
Следует подчеркнуть связь между положением элемента в периодической системе и устойчивостью гибридных состояний его атома: в рамках одного периода с ростом заряда ядра различие в энергиях s - и p -орбиталей возрастает. Следовательно, легче подвергаются гибридизации орбитали атомов, начинающих период. С ростом числа квантовых слоев различие в энергиях подуровней уменьшается. Однако при этом уменьшается плотность орбиталей, а значит, и степень их гибридизации. Следует отметить, что гибридизации может подвергаться лишь часть внешних орбиталей, а остальные остаются негибридизированными (см., например, электронную формулу в [4]). Различие в энергиях s -, p-, d -орбиталей влияет, в частности, на форму молекул хлоридов элементов IIА группы: молекулы MgCl Пример 2. Экспериментально установлено, что молекула BF Решение Вначале запишем электронные конфигурации атомов бора и фтора: 5B [He] 2 s 22 p 1 и 9F [He] 2 s 22 p 5.
Электронные структуры валентных орбиталей этих атомов имеют вид:
Центральным атомом является атом бора. В возбужденном состоянии электрон с 2 s -подуровня промотирует в свободную энергетическую ячейку 2 p -подуровня и в соответствии с правилом Гунда занимает свободную орбиталь.
Понятно, что валентность по обменному механизму Bобм = 3 (атом имеет 3 неспаренных электрона), по донорно-акцепторному – Bд-а = 1. При этом в образовании химических связей участвуют орбитали с различными типами симметрии (s и p). Поэтому происходит их гибридизация с образованием гибридных q -орбиталей:
s + p
Форма гибридной орбитали:
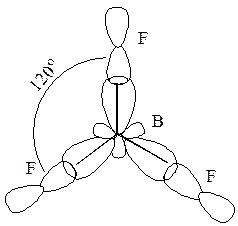
Оси трех гибридных орбиталей ориентированы к вершинам равностороннего треугольника так, чтобы отталкивание электронов на этих орбиталях было минимальным. Эти орбитали перекрываются с p -орбиталями атома фтора, образуя три s-связи:
Из электронной структуры атома В видно, что еще одна p -орбиталь может быть использована для образования донорно-акцепторной связи. Она ориентирована перпендикулярно плоскости, в которой находятся s-связи. Донорами электронных пар могут три равноценных атома фтора. При этом образуется p-связь с равномерно распределенной электронной плоскостью между атомами:
Это дополнительная, четвертая связь (p-связь) распределена между тремя атомами фтора. Она делокализована:
B
F F
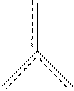
Надо заметить, что p -орбиталь, не участвуя в гибридизации, стабилизирует общую связь между атомами. За счет p-связи кратность связи повышается, что приводит к уменьшению длины связей B–F. У иона BF–4 ориентация атомов фтора отличается от рассмотренной в молекуле BF3. Ион F– имеет четыре электронные пары, одна из которых может перейти на свободную орбиталь атома В и образовать ковалентную связь по донорно-акцепторному механизму. Поскольку разность энергий двух подуровней в атоме бора сравнительно мала (∆ E2s–2p = 5,7 эВ) и атом бора имеет малый орбитальный радиус (0,077 нм), то все четыре орбитали в атоме бора подвергаются sp3- гибридизации: s + p Взаимная ориентация осей гибридных орбиталей – тетраэдрическая. Образующиеся s-связи неупрочнены p-связями, следовательно, длина связи B–F в ионе BF–4 больше, чем в молекуле BF Пример 3. Изобразите схему перекрытия орбиталей в молекуле CO Решение Валентность углерода в молекуле CO
Поскольку молекула линейна, в атоме С осуществляется sp -гибридизация, характерная для таких молекул. При этом только одна из трех p -орбиталей участвует в гибридизации, а две остаются негибридизированными: s + p 3 ® (sp) p 2 → q 2 p 2. Эти четыре орбитали ориентированы так, чтобы отталкивание между ними было минимальным: две q -орбитали ориентированы по линии связи (угол между их осями составляет 180°), а две p -орбитали расположены взаимно перпендикулярно, и угол между их осями и линией связи составляет 90°. Эта взаимная ориентация представлена на схеме:
Теперь изобразим электронную структуру атома кислорода:
У атома кислорода имеются две р -орбитали, содержащие неспаренные электроны. Эти орбитали расположены под углом 90°. Одна из них участвует в s-связывании с q -орбиталями атома углерода, а вторая образует p-связь с р -орбиталью атома углерода. При этом p-связывание двух атомов кислорода осуществляется с двумя взаимно перпендикулярными р -орбиталями атома С. Изобразим p-связывание волнистой линией. Тогда схема перекрытия орбиталей имеет вид:
Третьим основным свойством химической связи является поляризуемость. Она характеризует смещение электронного облака в сторону более электроотрицательного атома, участвующего в образовании связи. Причиной такого смещения является различие силовых полей взаимодействующих атомов, которое оценивается по величинам электроотрицательностей атомов (ЭО). Если взаимодействующие атомы вносят одинаковый вклад в межъядерное поле, то образуемая связь является неполярной. Такая связь возникает при взаимодействии одинаковых атомов. В остальных случаях связь носит полярный характер. Атомы приобретают эффективный заряд ± q, и возникает электрическая асимметрия, характеризуемая дипольным моментом m = qL.
где m – дипольный момент молекулы; L – длина диполя. В физике вектор дипольного момента направлен от отрицательного заряда к положительному. Химики часто применяют противоположное направление, которое указывает, куда смещается электронная плотность при образовании связи. Размерность дипольного момента – Кл×м. Величина L, как правило,меньше расстояния между ядрами атомов d. Дипольный момент всей молекулы является векторной суммой дипольных моментов отдельных связей. При сильной поляризации связь превращается в ионную. Ионная связь образуется при полном переходе электрона от одного атома к другому. Практически связь считают ионной, если разность ЭО > 1,9. Надо понимать, что и в этом случае связь является частично ковалентной. При полном смещении электронной пары к одному из атомов длина диполя L становится равной расстоянию между атомами. Степень диполярности (ионность) связи оценивается величиной:
Очевидно, что 0 ≤ i < 1. Ионность связи выражается в процентах или долях от единицы. Она характеризует эффективный заряд атома. Следует отметить, что не все электроны на внешних орбиталях атома обязательно участвуют в образовании связей. Например, у атома азота из пяти внешних электронов при образовании молекулы аммиака три электрона образуют s-связи, а два остаются несвязывающими (неподелённая электронная пара):
Несвязывающие электроны вызывают отталкивание q -орбиталей, изменяют валентные углы и существенно влияют на электрическую асимметрию молекул. Поэтому при рассмотрении строения молекул необходимо учитывать наличие таких электронов [4].
Пример 4. На основании электронного строения молекул провести сравнительный анализ основных характеристик связей и их полярности по данным таблицы.
Решение Прежде всего определим форму рассматриваемых молекул. Запишем электронные конфигурации атомов N, P, H, F.
N … 2 s Центральными атомами в молекулах являются N и P. Запишем схемы распределения электронов для этих атомов:
Общее число орбиталей каждого из этих атомов, участвующих в Проанализируем теперь электронное строение атомов-заместителей:
Очевидно, что эти атомы способны образовывать по одной s-связи с центральным атомом. Кроме того, атом F может участвовать и в образовании донорно-акцепторной связи. Рассматриваемые атомы резко отличаются по электроотрицательностям. Так как ЭО
В молекуле NF Сопоставим теперь валентные углы в молекулах NH Валентный угол в молекуле PF
Задачи
131 Допуская, что каждый атом вносит постоянный вклад в межатомное расстояние, вычислите его для молекул HF, HCl, HBr и HI, если d F–F = 0,142; d Cl–Cl = 0,199; d Br–Br = 0,228; d I–I = 0,267 и d H–H = 0,074 нм. Ответ: 0,108; 0,136; 0,151; 0,170 нм. 132 Почему для атома серы характерны четные валентности, а для атома хлора – нечетные? Ответ мотивируйте, построив электронные структуры внешних оболочек этих атомов. 133–134 Энергии ионизации при последовательном отрыве электронов от атома равны соответственно: 133) B – 8,3; 25,15; 37,9; 259,4; 340,2 эВ; 134) N – 14,5; 29,4; 47,4; 77,0; 97,3; 549,0; 663,0 эВ. Постройте график зависимости энергии ионизации от номера отрываемого электрона. Объясните ход кривой на графике и укажите границу между валентными и внутренними электронами. На основании электронных конфигураций определите высшие и низшие степени окисления атомов. 135–137 Составьте электронные формулы атомов: 135) Al, Mn, Ge; 136) Cl, Cr*, Se; 137) Mg, Cu*, Ga. На основании электронных структур внешних оболочек этих атомов определите валентность по обменному и донорно-акцепторному механизму. Рассмотрите возбужденные состояния и определите валентность атомов. У атомов, отмеченных звездочкой, наблюдается проскок электрона. 138–140 Изобразите схемы перекрывания атомных орбиталей при образовании s- и p-связей в молекулах: 138) N2 и CH2Cl2; 139) C2H2 и CO2; 140) AlI3 и C2H2. 141–142 Изобразите схемы перекрывания атомных орбиталей в молекулах: 141) H 141) H2O – H2S – H2Se – H2Te – 104,5 – 93 – 91,5 – 91˚; 142) NH3 – PH2 – AsH3 – SbH3 – 107,3 – 93,3 – 91,8 – 91,3˚. Чем объясняется уменьшение валентных углов? Почему во всех случаях они больше 90°? 143 Валентные углы в молекулах CH4, NH3 и H2O соответственно равны 109,5˚, 107,8˚ и 104,5˚. Изобразите схемы перекрывания орбиталей и объясните причины уменьшения валентного угла в этом ряду. 144 На основании электронных структур атомов Be, B, N и O определите их валентности по обменному и донорно-акцепторному механизмам в основном и возбужденном состояниях. Возможна ли донорная или акцепторная функция для центрального атома в молекулах BCl3 и NH3? 145–147 По данным табл. 6.1 постройте график зависимости энергии связи от межъядерного расстояния в рядах молекул. Используя табл. 6.2, постройте график зависимости энергии связи от разности электроотрицательностей атомов. На основании полученных данных сформулируйте выводы. 145) LiF, LiCl, LiBr, LiI; 146) HF, HCl, HBr, HI; 147) MgO, CaO, SrO, BaO.
Таблица 6.1 Межъядерные расстояния d (нм) и энергия связи Е св. (кДж/моль) для некоторых молекул
148 Укажите вид химической связи в молекулах Н2, Cl2, НCl. Приведите схему перекрывания электронных облаков. 149 Как изменяется прочность связи в ряду HF, HCl, HBr, HJ? Укажите причины этих изменений. Связь в каком из этих соединений наиболее полярная? 150 Дипольные моменты молекул галогеноводородов равны:
Таблица 6.2 Относительные электроотрицательности атомов (по Полингу)
РАСТВОРЫ
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 605; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.148.130 (0.01 с.) |

 ) определяется количеством неспаренных электронов в этом атоме. В ряде случаев валентность оказывается более высокой, чем та, которая прогнозируется на основании электронной структуры атома, находящегося в основном состоянии. Дело в том, что при образовании молекулы выделяется энергия, часть которой передается электронам. При этом электроны могут переходить на свободные орбитали, обладающие большей энергией (возбужденное состояние). Этот процесс называется промотированием. Благодаря ему число неспаренных электронов на орбиталях атома увеличивается, например, для атома фтора:
) определяется количеством неспаренных электронов в этом атоме. В ряде случаев валентность оказывается более высокой, чем та, которая прогнозируется на основании электронной структуры атома, находящегося в основном состоянии. Дело в том, что при образовании молекулы выделяется энергия, часть которой передается электронам. При этом электроны могут переходить на свободные орбитали, обладающие большей энергией (возбужденное состояние). Этот процесс называется промотированием. Благодаря ему число неспаренных электронов на орбиталях атома увеличивается, например, для атома фтора:




 ) определяется количеством свободных орбиталей или числом электронных пар на внешних орбиталях атома. Следует подчеркнуть, что связи, образующиеся по обоим механизмам, равноценны. Общая валентность атома равна:
) определяется количеством свободных орбиталей или числом электронных пар на внешних орбиталях атома. Следует подчеркнуть, что связи, образующиеся по обоим механизмам, равноценны. Общая валентность атома равна:
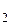 и CaCl
и CaCl  и sp
и sp  гибридизация. Появление d -орбиталей у элементов III и IV периодoв способствует возникновению sp
гибридизация. Появление d -орбиталей у элементов III и IV периодoв способствует возникновению sp  имеет треугольную форму, а ион BF–4 – тетраэдрическое строение. Длина связи B–F в молекуле BF
имеет треугольную форму, а ион BF–4 – тетраэдрическое строение. Длина связи B–F в молекуле BF 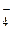 (0,143 нм). Чем объяснить это различие?
(0,143 нм). Чем объяснить это различие?




 F
F .
.


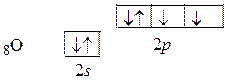

 .
.
 Кл×м
Кл×м
 = 0,102
= 0,102
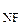 = 0,137
= 0,137
 = 0,142
= 0,142
 = 0,155
= 0,155
 ; F … 2 s
; F … 2 s  .
.

 = 4. В обоих случаях происходит
= 4. В обоих случаях происходит 
 = 3,0 > ЭО
= 3,0 > ЭО  = 2,1, то дипольный момент связей в молекуле NH
= 2,1, то дипольный момент связей в молекуле NH 
 = 4,0 > ЭО
= 4,0 > ЭО 



