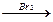Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаимосвязь предельных, непредельных и ароматических углеводородовСодержание книги
Поиск на нашем сайте
Вариант 1 1. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: CH4 → CH3Br → C2H6 → C2H4 → C2H2 → C6H6. Укажите условия их протекания. 2. Как получить 2-хлорметан исходя из: а) пропена, б) пропана? Напишите уравнения реакций. 3. При взаимодействии 0,672л алкена (н.у.) с хлором образуется 3,39г его дихлорпроизводного. Определите молекулярную формулу алкена, запишите его структурную формулу и название. Вариант 2 1. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: нитробензол ↑ метан→ацетилен→бензол→циклогексан ↓ бромбензол Укажите условия их протекания. 2. Какие из следующих веществ: C2H6, C3H4, C4H8, C5H12 – подвергаются гидрированию? Напишите уравнения реакций и назовите исходные и полученные вещества. 3. При взаимодействии 1,74г алкана с бромом образовалось 4,11г монобромпроизводного. Определите молекулярную формулу алкана, запишите структурные формулы и названия возможных изомеров. Вариант 3 1. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: С → CH4 → C2H2 → C2H4 → C2H5ОН. ↓ C2H6 Укажите условия их протекания. 2. Как получить хлорэтан исходя из: а) этана, б) этилена, в) ацетилена? Напишите уравнения реакций. 3. При взаимодействии 1,16г алкана с хлором образовалось 1,85г монохлорпроизводного. Определите молекулярную формулу алкана, запишите структурные формулы и названия возможных изомеров.
Контрольная работа №2 Кислородсодержащие органические соединения Вариант 1 1. а) Назовите по систематической номенклатуре соединение: СН3 – СН2 – СН – СН3 ↓ ОН б) Напишите структурную формулу 2,2-диметилбутаналя. 2. Определите, с какими из приведенных веществ и при каких условиях взаимодействует фенол: а) бром, б) хлороводород, в) азотная кислота, г) оксид меди (II), д) гидроксид натрия. Напишите уравнения соответствующих реакций, используя структурные формулы органических соединений, назовите полученные вещества. 3. Напишите уравнения реакций, при помощи которых можно осуществить превращения: Этилен → Х → этилацетат │ хлорэтан 4. Какую массу чистого этилового спирта необходимо взять для получения 37,4г этилацетата, если массовая доля выхода эфира составляет 85%. Вариант 2 1. Назовите по систематической номенклатуре соединение: О а) ClСН2 – СН2 – СООН б) СН3 – СН2 – СН2 – СН2 – С Н Для второго соединения напишите структурную формулу изомера и назовите его. 2. Определите, с какими из приведенных веществ и при каких условиях взаимодействует этанол: а) бромоводород, б) медь, в) бром, г) натрий, д) уксусная кислота. Напишите уравнения соответствующих реакций, используя структурные формулы органических соединений, назовите полученные вещества. 3. Напишите уравнения реакций, при помощи которых можно осуществить превращения: Ацетилен → Х → уксусная кислота ↓ этанол 4. Вычислите массу фенола, полученного из 134,4л (н.у) ацетилена. Массовая доля выхода продукта составила 60% от теоретически возможного.
Контрольная работа №3 Вещества живых клеток Вариант 1 1. а) Назовите по систематической номенклатуре соединение: О NH2– СН2 – СН2 – СН – С │ О – Н СН3 б) Напишите структурную формулу диэтиламина. 2. Напишите уравнения реакций, при помощи которых можно осуществить превращения: Карбид кальция → ацетилен → бензол → нитробензол → анилин. Укажите условия протекания реакций. 3. Определите массу анилина, которую можно получить из 500кг технического карбида кальция с массовой долей примесей 23,2%. Вариант 2 1. Назовите по систематической номенклатуре соединение: О О а) СН3 – СН2 – СН – С б) СН3 – СН2 – СН – С │ О – Н │ О –Н NH2 Cl Для аминокислоты изобразите структурную формулу изомера углеродной цепи и назовите его. 2. Напишите уравнения реакций, при помощи которых можно осуществить пре Циклогексан → бензол → нитробензол→ анилин 3. Через 20г смеси фенола и анилина пропустили хлороводород. При этом выпало 2,59г осадка. Определите массовую долю (в%) фенола в смеси.
Муниципальное автономное образовательное учреждение
Рабочая программа курса общей химии 11 класса общеобразовательной школы q Авторы: Н. Е. Кузнецова, И. М. Титова, Н.Н. Гара q Структура школьного химического образования, для которой подготовлена программа: концентрическая q Виды занятий, на которых реализуется программа: обязательные q Уровень усвоения программы: базовый q Вид образовательной программы, в которую входит данная программа: базовая q Учебно-методический комплект, обеспечивающий данную программу: 1. Программы по химии для 8-11 классов общеобразовательных учреждений. / Под редакцией Н.Е. Кузнецовой. – М.: Издательский центр «Вентана-Граф», 2006. 2. Сборник нормативных документов. Химия / Сост. Э. Д. Днепров, А. Г. Аркадьев. – М.: Дрофа, 2004. 3. Н. Е. Кузнецова, И. М. Титова, Н. Н. Гара. Химия. Учебник для учащихся 11 класса общеобразовательных учреждений. – М.: Вентана-Граф, 2008. 4.. М. Титова. Малый химический тренажёр: Технология организации адаптационно-развивающих диалогов. Комплект дидактических материалов для 8-11 классов общеобразовательной школы. – М.: Вентана-Граф, 2002. 5. О.С. Аранская. Проектная деятельность школьников в процессе обучения химии. – М.: Вентана-Граф, 2005 6. М.А. Шаталов, Н.Е. Кузнецова. Обучение химии. Решение интегративных учебных проблем. – М.: Вентана-Граф, 2006 7. Н.Е. Кузнецова, М.А. Шаталов. Обучение химии на основе межпрежметной интеграции. – М.: Вентана-Граф, 2004 8. Р.Г. Иванова, А.А. Каверина, А.С. Корощенко. Вопросы, упражнения и задания по химии 10-11 класс. – М.: Просвещение, 2004. 9. А.М. Радецкий, В.П. Горшкова, Л.Н. Кругликова. Дидактический материал по химии 10-11. – М.: Просвещение, 2002.
Учитель: ____________________, г. __________________, МОУ СОШ №__ ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Данная программа полностью соответствует Государственному стандарту среднего (полного) общего образования по химии, обязательному минимуму содержания образовательных программ и требованиям к уровню подготовки по химии выпускников полной средней школы. В программе учтены стратегия модернизации общего образования, современные концепции, в том числе авторская концепция построения учебников, а также достижения науки и практики в области развивающего обучения и результаты исследований авторов в области методики гуманистического развивающего обучения химии. Химическое образование и знания учебного предмета химии рассматриваются в программах и учебниках как обязательный компонент общей культуры человека, основа его научного миропонимания, средство социализации и личностного развития ученика. Основные цели изучения химии в 11 классе по данной программе: 1. Системное и сознательное усвоение основного содержания курсов химии, способов самостоятельного добывания, переработки, функционального и творческого применения знаний, необходимых для понимания научной картины мира. 2. Раскрытие роли химии в познании природы и ее законов, в материальном обеспечении развития цивилизации и повышения уровня жизни общества, в понимании необходимости школьного химического образования как элемента общей культуры и основы жизнеобеспечения человека в условиях ухудшения состояния окружающей среды. 3. Раскрытие универсальности и логики естественнонаучных законов и теорий, процесса познания природы и его возвышающего смысла, тесной связи теории и практики, науки и производства. 4. Развитие интереса и внутренней мотивации учащихся к изучению химии, к химическому познанию окружающего нас мира веществ. 5. Овладение методологией химического познания и исследования веществ, умениями характеризовать и правильно использовать вещества, материалы и химические реакции, объяснять, прогнозировать и моделировать химические явления, решать конкретные проблемы. 6. Выработка умений и навыков решать различных типов химические задачи, выполнять лабораторные опыты и проводить простые экспериментальные исследования, интерпретировать химические формулы и уравнения и оперировать ими. 7. Внесение значимого вклада в формирование целостной картины природы, научного мировоззрения, системного химического мышления, воспитание на их основе гуманистических ценностных ориентиров и выбора жизненных позиций. 8. Обеспечение вклада учебного предмета химии в экологическое образование и воспитание химической, экологической и общей культуры учащихся. 9. Использование возможностей учебного предмета как средства социализации и индивидуального развития личности. 10. Развитие стремления учащихся к продолжению естественнонаучного образования и адаптации к меняющимся условиям жизни в окружающем мире. Важнейшие принципы изучения химии в 11 классе: • преемственность раскрытия знаний и умений по химии на основном и профильном уровнях; • повышение системности, структурной организации и функциональности теоретических знаний, превращение их в средство добывания новых знаний; • развитие основных систем знаний (о веществе, о химической реакции, о технологиях и прикладной химии и др.) по спирали; • обеспечение внутри- и межпредметной интеграции знаний; • усиление методологической, мировоззренческой, экологической и практической направленности содержания курса химии; • организация уровневой дифференциации содержания текстов и заданий учебников для самостоятельной работы, повышение уровня обучения с учетом типологических, индивидуальных и возрастных особенностей учащихся; • наращивание развивающего и воспитательного потенциала содержания программ и учебников по химии. Особенности структуры и логики построения курса общей и неорганической химии: В структуре предлагаемых курсов общей и неорганической химии большое внимание уделено их методическому аппарату усвоения знаний учащимися. Структура представлена: предисловием, раскрывающим особенности построения курсов и цели их изучения, ориентирующим учащихся на активное усвоение учебного материала; разделами, представляющими крупные блоки содержания, которые включают темы; обобщающими послесловием и заключением. Содержание учебного материала распределено по уровням: обязательный минимум и информация, способствующая расширению и углублению знаний. А так же имеется дополнительный материал, отражающий новые достижения науки и ее связь с жизнью (он не обязателен для усвоения всеми учащимися, а предназначен для удовлетворения познавательных потребностей интересующихся данными вопросами). Кроме этого, в содержание включен химический эксперимент. В каждом из курсов изучение материала начинается с блока теоретических основ, что обеспечивает применение дедуктивного подхода к дальнейшему его раскрытию и обеспечивает теоретическое объяснение изучаемых явлений. Усилено внимание к методологии познания химических объектов и их закономерностей, к установлению причинно-следственных связей, к проблемному изучению материала, к обобщению и систематизации учебного материала курсов неорганической и органической химии, к раскрытию взаимосвязей теоретических и прикладных знаний, к их пониманию и применению. На протяжении всего изучения курсов общей и неорганической химии осуществляется развитие и оформление систем знаний о веществе, химической реакции и технологии как необходимом условии системного усвоения и функционального применения знаний, формирования естественнонаучной картины мира и мировоззрения. При изучении этого материала идет постоянное обращение к химическому эксперименту и к решению химических задач. Это способствует превращению теоретических знаний в убеждения, в средство дальнейшего познания химии и формирования необходимых общеучебных и предметных умений. Содержание курса пронизано основополагающими идеями химической науки (периодичности, химической индивидуальности веществ, зависимости свойств веществ от их строения, протекания химических реакций от природы веществ и внешних факторов и др.). Значительный объем учебного материала в курсах отведен блоку прикладной химии, основам технологии и производствам, выпускающим вещества и материалы, необходимые современному обществу. Это позволяет сформировать систему знаний о химической технологии и ее роли в химизации общества, усилить понимание роли науки и производства в повышении уровня жизни общества. При этом много внимания уделено различным областям применения веществ и химических реакций, в том числе в быту. Экологические аспекты и проблемы современного использования веществ и материалов включены практически в каждый раздел учебников химии для 11 класса и рассмотрены в специальных главах в конце изучения курсов. Технологический и экологический материал, отражающий тесную связь химии с жизнью, формирует ценностные отношения к химии, к природе и здоровью человека, в сохранение которого химия вносит большой вклад. Вместе с тем курс химии 11 класса имеет свои особенности в структуре и в содержании. Программа курса для 11класса представлена введением, шестью крупными разделами («Теоретические основы общей химии», «Химическая статика», «Химическая динамика», «Обзор химических элементов и их соединений на основе периодической системы», «Взаимосвязь органических и неорганических соединений», «Технология получения неорганических и органических веществ», «Основы химической экологии»), а также развернутым заключением. Первые три раздела посвящены универсализации теоретических основ общей и органической химии, развитию теоретических систем знаний о веществах и химических реакциях на основе обобщения и теоретического объяснения, опирающихся на фундаментальные понятия, законы и теории химии. Ведущая роль в раскрытии содержания этих разделов принадлежит электронной теории, периодическому закону и системе элементов как наиболее общим научным основам химии. Здесь же показывается их значение в познании мира веществ и их превращений, в развитии науки, производства и прогресса общества. После основ неорганической химии даются разделы, раскрывающие взаимосвязь органических и неорганических веществ и химических реакций. В курсе химии 11 класса усилена методология химии, что выражено в раскрытии функций теоретических знаний, уровней химического познания и теоретических и экспериментальных методов исследования веществ и их свойств. Особое внимание уделено химическому эксперименту, раскрытию роли экспериментального анализа и синтеза, моделированию химических объектов. Обобщение и углубление теоретических знаний в области химической статики и динамики позволяет усилить реализацию триединого подхода к изучению веществ и комплексному использованию структурного, энергетического и кинетического подходов к изучению реакций, а также системному оформлению знаний о веществах и реакциях. Программа данного курса предполагает более глубокое изучение закономерностей протекания обменных и окислительно-восстановительных реакций в водных растворах, рассмотрение объясняющих их теорий (электролитической диссоциации и др.) а также демонстрации научного и практического значения приобретенных знаний. В раскрытии теоретических проблем акцент делается на структурировании учебного материала и выделении главного. С этой целью предлагается использовать рисунки, модели и символико-графические формы описания, обеспечивающие единство вербального и визуального восприятия химических объектов и их свойств. С позиций единства фактов и объясняющих их теорий, а также с помощью сравнительного обобщения дается обзор и систематика химических элементов и их соединений, раскрываются особенности строения и свойств металлов и неметаллов. К изучаемым ранее классам добавлены сведения о комплексных соединениях, дающие новые современные представления о строении и многообразии веществ. Раскрытие классификации и взаимосвязи органических и неорганических веществ и реакций, их роли в живой и неживой природе способствует формированию химической картины природы и естественнонаучной картины мира как основы научного мировоззрения. Важным условием этого познавательного процесса является межпредметная интеграция, обобщение и систематизация знаний о веществе и химической реакции, подтверждающих существование общих законов природы (закон сохранения массы и энергии, периодический закон и др.) и категорий (материя, взаимодействие и др.). Прикладной аспект химии, ее роль в жизни человека наиболее полно отражены в последнем разделе курса. Здесь дано обобщение технологических основ современного производства на примере отдельных производств и отраслей промышленности, показана роль химии в решении глобальных проблем человечества. Практическая направленность содержания этой темы, раскрывающей связь химии с жизнью, показана на примере синтеза новых веществ и материалов, необходимых производству, современному обществу и человеку. Огромная роль химии в жизни человека раскрыта на примерах химических процессов, протекающих в живых организмах, связи химии со здоровьем человека, создания лекарственных препаратов, средств бытовой химии и др. Вместе с тем в курсе 11 класса отражены проблемы социально-экологического характера, вызванные загрязнением окружающей среды химическими производствами и бытовыми отходами, а также меры, позволяющие снизить эти негативные воздействия. Обсуждение этих вопросов направлено на понимание причин напряженных экологических ситуаций, на развитие ценностного отношения учащихся к природе и здоровью человека. В развернутом заключении к курсу 11 класса отражены вопросы непрерывности образования и информации как общечеловеческих ценностей и раскрыты источники получения химической информации, в том числе и из сети Интернет. Программа рассчитана на 68 часов учебного времени (2 ч в неделю) и имеет уровневый характер. Содержание, которое не включается в требования к уровню подготовки выпускников полной (средней) школы, установленные государственным стандартом, выделено в тексте программы курсивом. Программа реализована в учебниках химии для 11 класса (авторы: Н.Е. Кузнецова, Т.Н. Литвинова, А.Н. Левкин), выпущенных Издательским центром «Вентана-Граф» в 2005 году. УЧЕБНЫЙ ПЛАН (2 часа в неделю, 68 часов в год, их них 4 часа – резервное время)
УЧЕБНО-ТЕМАТИЧЕСКИЙ ПЛАН (2 часа в неделю, 68 часов в год, их них 4 часа – резервное время)
СОДЕРЖАНИЕ ПРОГРАММЫ (2 часа в неделю, 68 часов в год, из них 4 часа – резервное время) Раздел I. Теоретические основы общей химии (7 часов) Тема 1. Основные понятия, законы и теории химии (7 часов) УРОК 1. Основные понятия химии Атом. Вещество. Простые и сложные вещества. Элемент. Изотопы. Ядро и нуклоны. Массовое число. Число Авогадро. Моль. Молярный объем. Химическая реакция. Демонстрация. Периодическая система Лабораторный опыт №1. Явления физические и химические (Нагревание стекла в пламени спиртовки, растворение хлорида натрия, прокаливание медной проволоки, действие соляной кислоты на мел или мрамор). Задание на дом: §1(с. 4-9), упр. 3,4,7 стр.12. УРОК 2, 3. Стехиометрические химические законы Закон сохранения массы, закон постоянства состава, закон Авогадро. Задание на дом: §1, упр.5,6, стр.12. УРОК 4. Теория строения атома как научная основа изучения химии Теория строения атома – научная основа изучения химии. Электрон. Дуализм электрона. Квантовые числа. Атомная орбиталь. Распределение электронов по орбиталям. Электронная конфигурация атомов. Валентные электроны. Принципы заполнения электронами атомных орбиталей. Демонстрация. Модели атомов и молекул, схемы, таблицы, набор кодограмм «Теоретические основы общей химии» и «Периодическая система». Задание на дом: §2, упр. 3, стр.17. УРОК 5. Периодический закон и периодическая система Д.И. Менделеева в свете электронной теории Периодический закон и периодическая система Д.И. Менделеева. Демонстрация. Модели атомов и молекул, набор кодограмм «Теоретические основы общей химии» и «Периодическая система». Задание на дом: §3, упр.1,4,5 стр.22. УРОК 6, 7. Общая характеристика s-, p-, d- и f-элементов Основное и возбужденное состояние атомов. s-, р-, d-, f- элементы. Задание на дом: §4, упр.2,4,5 стр.25. Раздел II. Химическая статика (учение о веществе) (12 часов) Тема 2. Строение вещества (6 часов) УРОК 8, 9. Сущность химической связи Химическая связь и ее виды. Ковалентная связь, ее разновидности и механизмы образования. Электроотрицательность. Валентность. Степень окисления. Полярность молекул. Ионная связь. Металлическая связь. Водородная связь. Задание на дом: §9, упр.2, 3,5,7. УРОК 10. Пространственное строение веществ Гибридизация атомных орбиталей. Пространственное строение молекул. Задание на дом: §9. УРОК 11. Аморфное и кристаллическое состояние веществ. Кристаллические решетки Вещества молекулярного и немолекулярного строения. Аморфное и кристаллическое состояние веществ. Кристаллические решетки и их типы. Причины многообразия веществ: изомерия, гомология, аллотропия, изотопия. Демонстрации. Модели молекул кристаллических решеток (кварц, хлорид натрия, железо, графит). Задание на дом: §10, упр. 3,4,5*. УРОК 12, 13. Комплексные соединения Комплексные соединения: строение, номенклатура, свойства, практическое значение. Демонстрации. Эксперимент по получению и изучению свойств комплексных соединений меди и кобальта. Задание на дом: §11, упр. 2 стр.73. Тема 3. Вещества и их системы (6часов)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-20; просмотров: 199; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.79.165 (0.019 с.) |

 вращения:
вращения: