
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ионное произведение воды. Водородный показатель рНСодержание книги
Поиск на нашем сайте
Вода является очень слабым электролитом и в незначительной степени диссоциирует на ионы Н+ и ОН–: Н2О Á Н+ + ОН–. По закону действующих масс константа диссоциации равна:
Так как концентрация [Н2О] недиссоциированной воды много больше концентраций [H+] и [OH–] и остается практически постоянной, то и произведение K ×[H2O] тоже является постоянной величиной; следовательно, можно ввести константу Кw , равную произведению концентраций ионов Н+ и ОН–, которую называют ионным произведением воды. Её величина постоянна в любом растворе при данной температуре и составляет, согласно опытным данным, при комнатной температуре 10–14 моль2/л2
Из этого соотношения вытекает, что в любом водном растворе всегда присутствуют как ионы H+, так и ионы OH–. Зная концентрацию одного из ионов, [H+] или [OH-], легко рассчитать и концентрацию второго иона. Удобнее вместо концентрации использовать десятичный логарифм концентрации ионов Н+, взятый с отрицательным знаком, называемый водородным показателем рН:
Аналогично для концентрации ионов ОН– вводится понятие гидроксильного показателя pOH:
Логарифмируя соотношение (7.24) и меняя знаки на обратные,
В нейтральных растворах: [H+] = [OH–] = 10–7 моль/л, рН = рОН = 7. В кислых растворах: [H+] > [OH–], [H+] > 10–7 моль/л, рН < 7, рОН > 7. В щелочных средах: [H+] < [OH–], [H+] < 10–7 моль/л, рН > 7, рОН < 7. Концентрация ионов Н+ для одноосновной кислоты может быть выражена следующим образом:
где С – молярная концентрация раствора кислоты, моль/л. Пример 10. Концентрация ионов ОН– в растворе составляет 2,5∙10–6 моль/л. Каково значение рН раствора? Решение Из формулы (7.24) для ионного произведения воды определим концентрацию ионов Н+:
Применяя формулу (7.25), найдем: рН = –lg[H+] = –lg4∙10–9, рН = 8,40. Пример 11. Вычислить рН 1 %-го раствора муравьиной кислоты, считая, что плотность раствора 1 г/мл. Константа диссоциации кислоты 2,1∙10–4. Решение 100 г раствора содержит 1 г, а 1 л – 10 г НСООН, поэтому молярная концентрация кислоты составляет:
Из формулы (7.28) следует, что:
Вычислим рН: рН = –lg[H+] = –lg6,8∙10–3 = 2,2.
Задачи 151 – 156 Вычислить массовую долю (%), молярную, моляльную и нормальную концентрацию указанных растворов (см. таблицу), если известны плотность раствора, масса растворенного вещества и объем воды.
157 – 161 Вычислить объём V′ (мл) разбавленного раствора, полученного добавлением воды к 250 мл концентрированного раствора (см. таблицу). Рассчитать молярную долю растворенного вещества в разбавленном растворе.
162 – 167 Рассчитать массовую долю (ω, %) растворенного вещества в растворе, приготовленном смешением 100 мл разбавленного раствора и 10 мл концентрированного раствора указанного вещества (см. таблицу).
168 – 172 Вычислите, до какого объема (л) необходимо выпарить 2,5 л разбавленного раствора, чтобы приготовить концентрированный раствор с молярной концентрацией 1,2 моль/л (см. таблицу).
173 Для нейтрализации 20 мл 0,1 н раствора кислоты потребовалось 8 мл раствора NaOH. Сколько граммов NaOH содержит 1 л этого раствора? Ответ: 10 г. 174 На нейтрализацию 20 мл раствора, содержащего в 1 л 12 г NaOH, израсходовано 24 мл раствора кислоты. Определить нормальность раствора кислоты. Ответ: 0,25 н. 175 Какой объем 0,2 н раствора щелочи NaOH потребуется для осаждения в виде Fe(OH)3 всего железа, содержащегося в 100 мл 0,5 н раствора FeCl3? Какая масса Fe(OH)3 выпадает в осадок? Ответ: 0,25л; 1,78 г. 176 Сколько граммов СаСО3 выпадает в осадок, если к 400 мл 0,5 н раствора СaCl2 прибавить избыток раствора соды? Ответ: 10 г. 177 Давление пара воды при 100 ˚С равно 1,013 ∙ 105 Па. Вычислите давление пара над 4 %-ным раствором мочевины СО(NH2)2 при этой температуре. Ответ: 1∙105 Па. 178 – 179 По данным, приведенным в таблице для разбавленных растворов неэлектролитов, вычислить указанные в ней искомые величины, обозначенные знаком «?».
180 Что такое эбуллиоскопическая и криоскопическая константы растворителя? Вычислите криоскопическую константу бензола, если при растворении 0,0125 вещества в 125 г бензола температура кристаллизации понижается на 0,512 ˚С. Ответ: 5,12 ˚С. 181 Температура кристаллизации уксусной кислоты 16,65 ˚С, а криоскопическая константа равна 3,9. Вычислить температуру кристаллизации раствора, содержащего 0,1 моля растворенного вещества в 125 г уксусной кислоты. Ответ: 13,53 ˚С. 182 – 183 Вычислить молярную массу неэлектролита (г/моль), используя данные таблицы:
184 – 187 По данным, приведенным в таблице для разбавленных водных растворов неэлектролитов, вычислить указанные там же искомые величины, обозначенные знаком «?».
188 Вычислить давление пара 10 %-го раствора Ba(NO3)2 при 28 ˚С. Давление пара воды при той же температуре составляет 37,8∙102 Па. Кажущая степень диссоциации соли 0,2. Ответ: 37,18∙102 Па. 189 Вычислить рН и рОН 0,01 н раствора уксусной кислоты, степень диссоциации которой в этом растворе равна 4,2 %. Ответ:3,38; 10,62. 190 Могут ли рН и рОН быть равными нулю? Меньше нуля? Чему равны рН и рОН раствора, концентрация ионов водорода в котором равна 10–4 моль/л? Ответ: 4; 10. 191 – 194 По данным, приведенным в таблице для разбавленных водных растворов электролитов, вычислите там же искомые величины, обозначенные знаком «?».
195 Константа диссоциации хлорноватистой кислоты равна 3,0∙10–8 при 25 ˚С. Чему равна степень диссоциации HClO в 0,1 н растворе? Ответ: 5,5∙10–4. 196 Вычислить концентрацию ионов Н+ и ОН– в растворе, водородный показатель которого равен 4,3. Ответ: 5∙10–5 моль/л; 2∙10–10 моль/л. 197 Определить молярную концентрацию раствора серной кислоты, если рН равен 2,2. 198–200 Вычислить рН раствора кислоты при α = 1, если для обозначенного известны из таблицы следующие данные:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 397; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.175.83 (0.007 с.) |


 ,
,
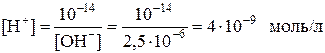 .
.




