
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства основных оксидовСодержание книги
Поиск на нашем сайте
1 Взаимодействие с водой (оксиды щелочных и щелочно-земельных металлов): Na2O + H2O = 2NaOH 2 Взаимодействие с кислотами: ВаО + H2SO4 = BaSO4 + H2O 3 Взаимодействие с кислотными и амфотерными оксидами: CaO + SO2 = CaSO3 K2O + ZnO = K2ZnO2 4 Участие в ОВР. Амфотерные оксиды – оксиды таких металлов как Zn, Al, Be (ZnO, Al2O3, BeO) и ряда переходных металлов в промежуточной степени окисления +3, +4 (Fe2O3, Cr2O3). Химические свойства амфотерных оксидов 1 Взаимодействие с кислотами: ZnО + H2SO4 = ZnSO4 + H2O 2 Взаимодействие со щелочами: Al2O3 + 6NaOH + 3H2O = 2Na3[Al(OH)6] – в водном растворе; Al2O3 + 2NaOH = 2NaAlO2 + H2O – в расплаве. 3 Взаимодействие с кислотными и оснόвными оксидами: ZnO + SO2 = ZnSO3 ZnO + Na2O = Na2ZnO2
Основания – сложные вещества, состоящие из катионов металла или аммония и гидроксогрупп. По растворимости могут быть растворимыми (щелочи: NaOH, Ca(OH)2, Ba(OH)2 и др.) и нерастворимыми (Mg(OH)2, Fe(OH)3 и др.). Основания, соответствующие амфотерным оксидам, обладают амфотерными свойствами (Zn(OH)2, Al(OH)3, Fe(OH)3 и др.). По числу групп ОН основания классифицируются на одно- (NH4OH, KOH) и многокислотные (Ba(OH)2, Al(OH)3 и др.).
Общие способы получения оснований 1 Взаимодействие оснόвных оксидов (щелочных и щёлочноземельных металлов) с водой: BaO + H2O = Ba(OH)2 2 Взаимодействие щелочей с растворимыми солями, если в результате образуется нерастворимое вещество: 2NaOH + Cu(NO3)2 = Cu(OH)2¯+ 2NaNO3 Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH 3 Электролиз водных растворов некоторых солей: 2NaCl + 2H2O = H2 + Cl2 + 2NaOH 4 Взаимодействие щелочных и щёлочноземельных металлов с водой: 2K + 2H2O = 2KOH + H2↑ Химические свойства оснований 1 Важнейшее свойство оснований – взаимодействие их с кислотами с образованием соли и воды (реакция нейтрализации): Ba(OH)2 + 2HCl = BaCl2 + 2H2O 2 Взаимодействие оснований с кислотными и амфотерными оксидами: Ca(OH)2 + 2CO2 = Ca(HCO3)2 Ca(OH)2 + CO2 = CaCO3 + H2O 2NaOH + Al2O3 = 2NaAlO2 + H2O 3 Взаимодействие щелочей с металлами, проявляющими амфотерные свойства: Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 4 Взаимодействие растворимых оснований (щелочей) с солями, приводящее к образованию нерастворимого соединения: 3KOH + FeCl3 = Fe(OH)3¯ + 3KCl Ba(OH)2 + Na2CO3 = BaCO3↓ + 2NaOH 5 Разложение нерастворимых оснований при нагревании: Cu(OH)2↓ = CuO + H2O Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка. По составу кислотного остатка кислоты классифицируют на кислородсодержащие (H2SO4, HNO3) и бескислородные (HCl, H2S, HCN), по числу атомов водорода – на одно- (HF, HCl, HCNS) и многоосновные (H2CO3, H3PO4).
Общие способы получения кислот 1 Бескислородные кислоты получают прямым взаимодействием простых веществ между собой: H2 + Cl2 = 2HCl 2 Кислородсодержащие кислоты получают при взаимодействии кислотных оксидов с водой: SO3 + H2O = H2SO4 3 Кислоты можно получить обменным взаимодействием их солей с другими кислотами: BaCl2 + H2SO4 = BaSO4↓ + 2HCl 2NaCl(тв.) + H2SO4(конц.) = Na2SO4 + 2HCl
Химические свойства кислот 1 Важнейшее свойство кислот – взаимодействие их с основаниями с образованием соли и воды (реакция нейтрализации): 3HNO3 + Fe(OH)3 = Fe(NO3)3 + 3H2O 2 Взаимодействие с оснớвными и амфотерными оксидами: H2SO4 + CaO= CaSO4 + H2O 2HCl + ZnO = ZnCl2 + H2O 3 Разбавленные водные растворы кислот взаимодействуют с металлами, расположенными в ряду напряжений (ряду активности) левее водорода: Zn + 2HCl = ZnCl2 + H2 4 Взаимодействие с солями, в результате которого образуются летучие или нерастворимые соединения: 2HCl + CaCO3= CaCl2 + CO2+ H2O H2SO4 + BaCl2= BaSO4¯+2HCl Соли – сложные вещества, являющиеся продуктами полного или частичного замещения атомов водорода в кислотах на атомы металлов (аммония) или продуктами полного или частичного замещения гидроксогрупп в основаниях на кислотный остаток. Соли классифицируют на средние (Na2SO4, KNO3), кислые (NaHCO3, KH2PO4), оснớвные (MgOHCl, Al(OH)2NO3), двойные (KFeSO4), комплексные (K4[Fe(CN)6]). Способы получения солей 1 Взаимодействие простых веществ: 2Fe + 3Cl2 = 2FeCl3 2 Взаимодействие металлов, находящихся в ряду напряжений левее водорода, с водными растворами кислот: Zn + 2HCl = ZnCl2 + H2 3 Взаимодействие более активных металлов с растворами или расплавами солей менее активных металлов: Fe + CuSO4 = FeSO4 + Cu
4 Взаимодействие металлов, проявляющих амфотерные свойства, с растворами щелочей: Zn + 2H2O + 2NaOH = Na2[Zn(OH)4] + H2 5 Взаимодействие кислотного оксида с основаниями: CO2 + NaOH = NaHCO3 или CO2 + 2NaOH = Na2CO3 + H2O 6 Взаимодействие оснớвного оксида с кислотами: FeO + H2SO4 = FeSO4 + H2O 7 Взаимодействие кислотных и основных оксидов: CO2+ BaO = BaCO3 8 Взаимодействие некоторых амфотерных оксидов с кислотными оксидами: ZnO + N2O5 = Zn(NO3)2 9 Взаимодействие амфотерных и оснớвных оксидов (сплавление):
Al2O3 + MgO = Mg(AlO2)2 (при 1600 ˚С) 10 Взаимодействие кислот и оснований (реакция нейтрализации): 2NaOH + H2SO4 = Na2SO4 + 2H2O H3PO4 + NH4OH = NH4H2PO4 + H2O 11 Взаимодействие соли с кислотой, в результате которого образуется нерастворимое или летучее вещество: AgNO3 + HCl = AgCl¯ + HNO3 FeS + H2SO4 = H2S↑ + FeSO4 12 Взаимодействие растворимой соли со щёлочью, в результате которого образуется нерастворимое соединение: MgCl2 + 2KOH = Mg(OH)2¯ + 2KCl Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH 13 Взаимодействие растворимых солей друг с другом, в результате которого образуется нерастворимое соединение: 3AgNO3 + Na3PO4 = Ag3PO4¯ + 3NaNO3 14 Вытеснение более активным неметаллом менее активного из его солей: Br2 + 2KI = I2 + 2KBr 15 Окисление (или восстановление) некоторых солей: 2FeCl2 + Cl2 = 2FeCl3 Na2SO3 + O2 = Na2SO4 2FeCl3 + Cu = 2FeCl2 + CuCl2 Химические свойства солей 1Взаимодействие растворов или расплавов солей менее активных металлов с более активными металлами: Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓ 2 Взаимодействие соли с кислотой, в результате которого образуется нерастворимое или летучее вещество: AgNO3 + HBr = AgBr¯ + HNO3 FeS + 2HCl = FeCl2 + H2S↑ 3 Взаимодействие растворимой соли с растворимым основанием, в результате которого образуется нерастворимое соединение: CuCl2 + 2KOH = Cu(OH)2¯ + 2KCl K2CO3 + Ba(OH)2 = BaCO3↓ + 2KOH 4 Взаимодействие растворимых солей друг с другом, в результате которого образуется нерастворимое соединение: Na2CO3 + Ca(NO3)2 = CaCO3¯ + 2NaNO3 5 Разложение солей при нагревании: Fe2(SO4)3 = Fe2O3 + 3SO3 2NaNO3 = 2NaNO2 + O2↑ 2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑ 2AgNO3 = 2Ag + 2NO2↑ + O2↑ 6 Гидролиз некоторых солей: (NH4)2CO3 + H2O = 2NH4OH + CO2 MgCl2 + H2O = MgOHCl + HCl Na2CO3 + H2O = NaHCO3 + NaOH 7 Участие в ОВР по кислотному остатку: 2KBr + Cl2 = 2KCl + Br2 2NaNO2 + O2 = 2NaNO3 Na2SO3 + H2O + Cl2 = Na2SO4 + 2HCl
Степенью окисления называется условный заряд на атоме химического элемента, вычисленный исходя из предположения, что все его связи с соседними атомами – ионные, то есть электронные пары полностью смещены в сторону атомов с большей электроотрицательностью. Атомы химических элементов могут иметь различные степени окисления в зависимости от того, в состав каких веществ они входят. В любом простом веществе степень окисления его атомов равна нулю. В соединениях элементы главных подгрупп 1-й и 2-й групп имеют степени окисления +1 и +2 соответственно, алюминий всегда имеет степень окисления +3, цинк +2, фтор –1, кислород –2 (за исключением пероксидов и F2O), водород +1 (за исключением гидридов металлов). Максимальная положительная степень окисления равна номеру группы, в которой находится элемент в периодической системе; наименьшая отрицательная степень окисления (в названиях бинарных соединений это отражается суффиксом –ИД равна (8 – номер группы). В тех случаях, когда степень окисления элемента может иметь разные значения в различных соединениях, ее вычисляют исходя из требования: сумма положительных зарядов в молекуле должна быть равна сумме отрицательных зарядов в молекуле, то есть молекула должна быть электронейтральной. Как составлять уравнение электронейтральности и вычислять степень окисления, понять нетрудно, если внимательно разобраться в приводимых примерах.
По известным значениям степеней окисления составляют формулы химических соединений. Для этого записывают значения степеней окисления отдельных элементов и подбирают индексы таким образом, чтобы молекула оставалась электронейтральной; в формулах неорганических соединений индексы должны быть по возможности наименьшими.
Пример 1. Составить формулы оксида алюминия, фосфида алюминия и сульфата железа (III).
Пример 2. Составьте ионно-молекулярные уравнения реакции взаимодействия в растворах: а) AgNO3 и K2CrO4; б) NaOH и H2SO4; в) CaCO3 и HCl. Укажите признаки необратимости этих реакций. К какому типу реакций они относятся? Решение По схеме классов неорганических соединений (рис. 1.1) определим тип каждой реакции: а) AgNO3 и K2CrO4– две соли, между которыми возможна реакция обмена; б) NaOH – основание, H2SO4 – кислота. Эти соединения имеют противоположную химическую природу. В результате взаимодействия между ними образуется соль. Тип реакции – реакция нейтрализации. в) CaCO3 – соль, HCl – кислота. Между ними происходит реакция обмена. Составляем молекулярные уравнения данных реакций: а) 2Ag+N+5O–23 + K+2Cr+6O–24 = Ag+2Cr+6O–24¯ + 2K+N+5O–23 б) 2Na+O–2H+ + H+2SO–24 = 2H+2O–2 + Na+2SO–24 в) Ca+2C+4O–23 + 2H+Cl– = Ca+2Cl–2 + H+2O–2 + C+4O–22
Так как в этих реакциях не происходит изменения степени окисления элементов, то такие реакции – реакции ионного обмена. Подбор коэффициентов в уравнениях реакций осуществляется в соответствии с законом сохранения массы, то есть число атомов каждого элемента до и после реакции должно быть одинаковым. Напомним, что реакции протекают необратимо, если один из продуктов реакции удаляется из области взаимодействия. В результате протекания данных реакций происходит связывание ионов с образованием осадка (Ag2CrO4¯, табл. 1.1), малодиссоциирующего соединения (H2O) и газа (CO2), то есть выполняются условия необратимости реакций. Составляем ионные уравнения для этих реакций, указав условия их необратимости: а) 2Ag+ + 2NO–3 + 2K+ + CrO2–4 = Ag2CrO4¯ + 2K+ + 2NO–3 2Ag+ + CrO2–4 = Ag2CrO4¯ б) 2Na+ + 2OH– + 2H+ + SO2–4 = 2H2O + 2Na+ + SO2–4 OH– + H+ = H2O в) CaCO3 + 2H+ + 2Cl– = Ca2+ + 2Cl– + H2O + CO2 CaCO3 + 2H+ = Ca2+ + H2O + CO2
Особое место среди классов химических соединений занимает группа амфотерных соединений. Их химическое поведение имеет двойственный характер. При взаимодействии с соединениями кислотного характера амфолиты проявляют оснόвные свойства, а при взаимодействии с оснόвными соединениями – кислотные свойства. Пример 3. К раствору хлорида алюминия добавили гидроксид натрия. Образовавшийся осадок разделили на две части. К одной добавили избыток NaOH, а к другой HNO3. Запишите уравнения соответствующих реакций в молекулярной и ионной формах. Решение С помощью рис. 1 находим, что NaOH относится к классу оснований, а AlCl
AlCl3 + 3NaOH = Al(OH)3¯ + 3NaCl Al3+ + 3Cl– + 3Na+ + 3OH– = Al(OH)3¯ + 3Na+ + 3Cl– Al3+ + 3OH– = Al(OH)3¯ Гидроксид алюминия относится к амфолитам. При взаимодействии гидроксида алюминия с избытком гидроксида натрия Al(OH)3 проявляет кислотные свойства: Al(OH)3¯ + NaOH = Na[Al(OH)4] Al(OH)3¯ + Na+ + OH– Á Na+ + [Al(OH)4] – Al(OH)3¯ + OH– Á [Al(OH)4] – При взаимодействии гидроксида алюминия с кислотой проявляются его свойства как основания: Al(OH)3¯ + 3HNO3 = Al(NO3)3 + 3H2O Al(OH)3¯ + 3H+ + 3NO–3 = Al3+ + 3NO–3 + 3H2O Al(OH)3¯ + 3H+ = Al3+ + 3H2O
Пример 4. Составьте уравнения реакций, которые позволяют осуществить следующие превращения. Пользуясь табл. 1.1, для каждого превращения обоснуйте выбор реагента и укажите условия необратимости реакции. Запишите соответствующие молекулярные и ионные уравнения.
Решение Охарактеризуем участников превращения 1: CuO ® CuCl CuO (оксид меди(II)) – соединение с кислородом, относящееся к классу оснόвных оксидов и является, как и все другие оксиды, неэлектролитом, то есть не диссоциирует в водных растворах. Продукт реакции – CuCl Для осуществления превращения 1 необходимо ввести вместо кислорода кислотный остаток (Cl–). Как известно, кислотные остатки входят в состав кислот или солей. Связывание кислорода из оксида происходит с участием ионов H+, поэтому вторым реагентом является кислота HCl: CuO + 2HCl = CuCl2 + H2O Составляем полное и сокращенное ионные уравнения реакции: CuO + 2H+ + 2Cl– = Cu2+ + 2Cl– + H2O CuO + 2H+ = Cu2+ + H2O Теперь рассмотрим превращение 2: CuCl2 ® Cu(NO3)2 Из соли CuCl2 в результате данного превращения образуется соль Cu(NO3)2. Это соответствует реакции обмена, которая происходит при выполнении условия необратимости (образование осадка, газа или малодиссоциированного соединения). Из табл. 1.1 видно, что соли CuCl2 и Cu(NO3)2 – растворимы. Поэтому необходимо, чтобы второй продукт реакции был нерастворим. Поскольку в левой части имеются ионы Cl CuCl2 + 2AgNO3 = Cu(NO3)2 + 2AgCl¯ Cu2+ + 2Cl– + 2Ag+ + 2NO–3 = Cu2+ + 2NO–3 + 2AgCl¯ Ag+ + Cl– = AgCl¯
Рассмотрим превращение 3: Cu(NO3)2 ® Cu(OH)2 Из табл. 1.1 видно, что Cu(OH)2 – нерастворимый гидроксид. Нерастворимые основания получают при взаимодействии растворимых солей со щелочами: Cu(NO3)2 + 2NaOH = Cu(OH)2¯ + 2NaNO3 Полное ионное уравнение реакции: Cu2+ + 2NO–3 + 2Na+ + 2OH– = Cu(OH)2¯ + 2Na+ + 2NO–3 Сокращенное ионное уравнение: Cu2+ + 2OH– = Cu(OH)2¯
Теперь рассмотрим последнее превращение 4: Cu(OH)2 ® CuO Превращение нерастворимого гидроксида в оксид происходит при нагревании с отщеплением воды:
Задачи В соответствии с номером варианта необходимо выполнить три задания.
Задачи 1 – 20. Задание 1. Запишите формулы химических соединений. Укажите, к какому классу они относятся. Дайте названия этим соединениям. Для соединений, отмеченных звёздочкой, запишите уравнения их диссоциации.
1) Cr+3 x O y; *Cr+3 x Cl y; *Na+1 x (NO3) –1 y; Fe+3 x (OH) –1 y; H x N+5O y. 2) Ag+1 x S–2 y; *Ba+2 x Br– y; Zn+2 x (PO4) –3 y; Fe+2 x (OH) –1 y; *H x Cl– y. 3) *Fe+3 x Cl– y; Cd+2 x O y; *Fe+2 x (SO4) –2 y; Co+3 x (OH) –1 y; *H x Cr+6O y. 4) Co+3 x O y; Si+4 x O y; Mn+2 x (PO4) –3 y; Sn+4 x (OH) y; *H x Cl+7O y. 5) Zn+2 x F–1 y; S+6 x O y; *Cd+2 x (NO3) –3 y; Cr+3 x (OH) –1 y; H x Cr+3O y. 6) *Sn+2 x Cl y; Mn+6 x O y; Ti+4 x (OH) y; *H x Cl+5O y; *Ba x Cl– y. 7) Pb+2 x Cl y; Mo+6 x O y; Fe+2 x (SO3) –2 y; Bi+3 x (OH) –1 y; *H x Cl+O y. 8) P+5 x O y; Mo+4 x S–2 y; *Na+1 x (SiO3) –2 y; Ca+2 x (OH) –1 y; *H x B+3O y. 9) Na+N x O–2 y; C+4 x O y; *K+ x (PO4) –3 y; Mg+2 x (OH) –1 y; *H x C+4O y. 10) Pb+2 x Cl–1 y; P+5 x O y; Al+3 x (OH) y; Na+NO y; Fe y (OH) x. 11) Li+ x Cl y; Ti+4 x O y; *Ca+2 x (HCO3) –1 y; Cr+2 x (OH) –1 y; H x Zn+2O y. 12) K+2Cr+6 x O y; S+4 x O y; Al+3 x (PO4) –3 y; Ni+2(OH) –1 x; *H x I– y. 13) Na+ x Br– y; W+6 x O y; Ni+2 x (PO4) –3 y; Co+2(OH) x; *H x Mo+6O y. 14) Ba+2 x S–2 y; H+1 x Te–2 y; Co+3 x (NO3) –1 y; Sc+3 x (OH) –1 y; *Na x Cl y. 15) As+5 x O y; *K x Br–; *K x S+4O y; V+3 x (OH) –1 y; *LiNO y. 16) Zr+4 x O y; *Ag+ x (NO3) y; Fe+3 x (OH) y; *H x Cl–; Na x HC+4O3. 17) *Cr+3 x Cl y; Bi+5 x O y; Ba+2 x (PO4) –3 y; *H x Se+6O y; Ca+2 x (C+4O3) y. 18) B+3 x O y; *Bi+3(NO3) –1 y; *H x S+6O4; Al+3 x (OH) y; *K x HC+4O3. 19) *K x Cl– y; Ti+4 x O–2 y; Fe+3 x (OH) y; *Ni+2 x (NO3) –1 y; *Li x F–. 20) Sb+5 x O–2 y; V+4 x O–2 y; *Bi+3 x (NO3) – y; *Na+1 x (BeO2) –2 y; *H+1 x C+4O–2 y.
Задачи 1 – 20. Задание 2. Расставьте степени окисления атомов в соединениях. Укажите, к какому классу соединений они относятся, их названия. Какие из них хорошо растворимы в воде? Для соединений, отмеченных звёздочкой, запишите уравнения их диссоциации. 1) *H2SO4; SiO2; *Mn(OH)2; NaOH; *HBr; Ag2O; *ZnCl2; CuO 2) *H2SO3; HMnO4; *K2Cr2O7; Fe(OH) 3; NaBr; *KOH; Cr2O3; *FeCl3 3) *HNO3; *KI; Fe2O3; *HCl; *NH4OH; TiO2; Cu(OH)2; *KMnO4 4) *HI; MgO; Mg(OH)2; *Rb2SO4; CaCO3; Al2O3; *H3PO4; *Na2SO4 5) *HNO2; ZnO; *CsOH; *NH4Cl; Zn(OH)2; *NaNO3; MnO2; (AlOH)2Cl 6) Ca3(PO4)2; *(NH4)2SO3; Na2SO3; *Pb(NO3)2; *Ba(OH)2; KNO3; MnSO4; *H2S 7) Cr2O3; *K2CO3; *Cu(NO3)2; ZnOHNO3; *Na2SO4; Ni(OH)2; Ni(OH)3; *HClO4 8) ZnO; Cr(OH)3; *K2SO4; *HClO2; *HClO3; *Na2CrO4; AlCl3; *HBr 9) Al2O3; Cr2S3; *Na2CO3; *Na2HPO4; *Bi(OH)(NO3)2; *HNO2: CrO3; CaO 10) Co(OH)2; CaSO4; *NiCl2; H2SO3; *H3PO4; *Cu(OH)2; *HI 11) *HMnO4; B2O3; HCl; *AlOHSO4; Fe(OH)3; *NH4NO3; CdSO4; *MnCl2 12) Al2S3; Hg2O; *H2CO3; *ZnOHNO3; Fe(OH)2; KBr; *ZnCl2; *H2SO4 13) Cu2O; Bi(OH)3; Al2(SO4) 3; *HNO3; *NH4Cl; *Cd(NO3)2; *Ba(HCO3)2; *H3PO4 14) P2O3; *FeCl3; Cd(OH)2; *Na2HPO4; *HClO2: PbCrO4; *NaAlO2; *KBr 15) Bi2O3; Pb(OH)2; *Na2BeO2; *NaOH; *HNO3; *ZnCl2; *NH4NO3; *KCNS 16) BaO; Co(CNS)2; Fe2O3; *RbOH;∙ AlCl3; CaSO4; *Hg(NO3)2; *K2MnO4 17) MnO2; *CsOH; *CuOHCl; *K2HPO3; As2S3; *Mn(NO3)2; Ag2SO4; *Fe(NO3)2; *ZnBr2 18) Rb2O; *AgNO3; *SnBr2; (NH4) 2SO3; *NaNO3; *H2CO3; Bi2(SO4)3; Mg(OH)2 19) HgO; *Ba(OH)2; *MgI2; SnF2; *Na2Cr2O7; *H2CrO4; AlF3; *AlOH(NO3)2 20) Na2O; *Ba(OH)2; *MnBr2; MgCrO4; *H2S; *Na2SiO3; *Fe2(SO4) 3; CaS
Задачи 1 – 20. Задание 3. Составьте уравнения реакций, которые позволяют осуществить следующие превращения. Пользуясь табл. 1.1, для каждого превращения обоснуйте выбор реагента и укажите условия необратимости реакции. Запишите соответствующие молекулярные и ионные уравнения. 1) MgCl2 → Mg(OH)2 → MgSO4 → MgCl2 2) AlCl3 → Al(OH)3 → Al2(SO4)3 → Al(NO3)3 3) Cu(NO3)2 → Cu(OH)2 → CuCl2 → Cu(NO3)2 4) Sn(NO3)2 → Sn(OH)2 → SnO → SnSO4 5) FeCl2 → Fe(OH)2 → FeSO4 → FeCl2 6) Ni(NO3)2 → Ni(OH)2 → NiCl2 → Ni(NO3)2 7) MgSO4 → MgCl2 → Mg(OH)2 → Mg(NO3)2 8) AlCl3 → Al(NO3)3 → Al(OH)3 → Al2(SO4)3 9) CuCl2 → Cu(NO3)2 → Cu(OH)2 → CuSO4 10) Pb(NO3)2 → Pb(OH)2 → Pb(NO3)2 → PbI2 11) FeSO4 → FeCl2 → Fe(OH)2 → Fe(NO3)2 12) NiCl2 → Ni(NO3)2 → Ni(OH)2 → NiSO4 13) CdCl2 → Cd(OH)2 → CdSO4 → CdCl2 14) Mg(NO3)2 → Mg(OH)2 → MgCl2 → Mg(NO3)2 15) Al(NO3)3 → Al(OH)3 → AlCl3 → Al(NO3)3 16) CuSO4 → Cu(OH)2 → CuSO4 → CuCl2 17) Zn(OH)2 → ZnO → Zn(NO3)2 → Zn(OH)2 18) FeCl3 → Fe(OH)3 → Fe(SO4)3 → FeCl3 19) NiSO4 → NiCl2 → Ni(NO3)2 → Ni(OH)2 20) P2O5 → H3PO4 → Na3PO4 → Ca3(PO4)2
Таблица 1.1
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 306; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.127.14 (0.013 с.) |

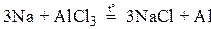






 – к классу солей, между соединениями этих классов возможна реакция обмена:
– к классу солей, между соединениями этих классов возможна реакция обмена:
 , то нерастворимое вещество – соль соляной кислоты и реагент должен удовлетворять следующим требованиям: нитрат этого металла растворим в воде, а хлорид – нет. В табл. 1.1 находим подходящий этим требованиям реагент: нитрат серебра AgNO3 растворим, хлорид серебра AgCl – нерастворим. Составляем молекулярное и ионные уравнения для превращения 2:
, то нерастворимое вещество – соль соляной кислоты и реагент должен удовлетворять следующим требованиям: нитрат этого металла растворим в воде, а хлорид – нет. В табл. 1.1 находим подходящий этим требованиям реагент: нитрат серебра AgNO3 растворим, хлорид серебра AgCl – нерастворим. Составляем молекулярное и ионные уравнения для превращения 2:



