
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Количественное определение скорости химической реакцииСодержание книги
Поиск на нашем сайте В настоящем курсе мы будем иметь дело с гомогенными реакциями, протекающими во всем объеме в закрытых термодинамических системах при постоянном объеме. В этом случае скорость химической реакции определяется уравнениями (3.1) и (3.2):
Здесь nср. – средняя скорость химической реакции; n – мгновенная скорость химической реакции; Химическая реакция – результат столкновений между частицами реагентов, приводящих к образованию продуктов реакции. Очевидно, что чем больше концентрация каждого из реагентов участников реакции, тем быстрее при данных внешних условиях протекает химическая реакция. Отсюда вытекает основной закон химической кинетики, который называется законом действующих масс, справедливый для реакций, протекающих при постоянных объёме и температуре. Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Для реакции, записанной в общем виде (3.3):
закон действующих масс можно записать как (3.4):
где CA и CB – молярные концентрации реагентов; kС – константа скорости химической реакции. Индекс «С» у величины kC указывает, что скорость химической реакции определяется через концентрации. Величина kC зависит от природы реагентов и температуры, но не зависит от концентраций. Физический смысл величины kC: она численно равна скорости химической реакции
где pA и pB – парциальные давления реагентов в системе, пропорциональные их молярным концентрациям; kP – константа скорости химической реакции. Индекс «р» у величины kP указывает, что скорость химической реакции определяется через парциальные давления. Физический смысл величины kP: она численно равна скорости химической реакции Для простейших реакций степени в уравнениях (3.4) и (3.5) должны быть равны стехиометрическим коэффициентам реакции (3.3), но, как показывают опытные данные, это далеко не всегда так. В этой связи различают молекулярный и кинетический порядок реакции. Молекулярный порядок реакции. Для определения молекулярного порядка реакции следует иметь в виду, что уравнения (3.4) и (3.5) должны описывать элементарный химический акт взаимодействия. Молекулярность есть число частиц реагентов, которые сталкиваются между собой в элементарном химическом акте, приводящем к образованию продукта. В этой связи различают реакции мономолекулярные, бимолекулярные и тримолекулярные, которые характерны для элементарных химических актов. Столкновения более трех частиц одновременно в элементарном химическом акте крайне маловероятны. Ниже приводятся примеры реакций различных молекулярных порядков, установленных экспериментально. Мономолекулярные реакции:
Скорость мономолекулярной реакции:
Бимолекулярные реакции:
Скорость бимолекулярной реакции:
Тримолекулярные реакции: 2NO + H2 → N2O + H2O, 2NO + O2 → 2NO2, 2NO + X2 → 2NOX (X=Cl, Br). Скорость тримолекулярной реакции: Показатель степени в уравнении элементарного акта (3.4) или (3.5) у концентрации или парциального давления одного из реагентов есть молекулярность реакции по этому реагенту. Кинетический порядок реакции. Показатели степени в уравнениях закона действующих масс (3.4) и (3.5), найденные экспериментально при изучении зависимости скорости реакции от концентрации реагентов, называются кинетическими порядками по соответствующим реагентам, а их сумма – кинетическим порядком реакции. При таком определении степени в уравнениях (3.4) или (3.5), равно как и их сумма, могут оказаться и не целочисленными величинами. Это свидетельствует о том, что суммарный механизм реакции сложен и состоит из ряда различных последовательных или параллельных элементарных актов, или тех и других вместе. Для установления механизма таких реакций и соответствующих им элементарных актов требуются специальные исследования. Часто в учебниках по химии исключительно в дидактических целях рассматриваются задачи с молекулярным порядком реакции большим, чем три. Пример 1. Как изменится скорость реакции 2NO + O2 = 2NO2, если объем газовой смеси уменьшить в 3 раза? Решение Обозначим начальные концентрации реагирующих веществ [NO] = а, [O2] = в. Согласно закону действующих масс, скорость реакции до изменения объема равна ν1 = kа
[NO] = 3 a, [O при новых концентрациях скорость реакции: ν2 = k (3 a) Отсюда
Следовательно, скорость реакции увеличится в 27 раз. Пример 2. Реакция между веществами А и В протекает по уравнению 2 А + В = С. Начальные концентрации равны [ A ] = 6 моль/л и [ B ] = 3 моль/л. Константа скорости реакции равна 0,6 л Решение Удобно решать эту задачу с использованием таблицы, в которую записываются: С 0 – начальные концентрации веществ; C – концентрации веществ в момент, когда в реакционной смеси останется 40 % вещества А, что составляет 6 ∙ 0,4 = 2,4 моль/л; DС – изменение концентрации в процессе реакций, что для вещества А составляет (6 – 2,4) = 3,6 моль/л. Из уравнения реакции видно, что вещества А и В взаимодействуют в соотношении 2: 1, поэтому концентрация В уменьшилась на (3,6: 2) = 1,8 моль/л и стала равной (3 – 1,8) = 1,2 моль/л.
Запишем закон действующих масс для данной реакции: ν = k [ A ] На основании найденных начальных и конечных концентраций рассчитываем скорости реакции: ν 0 = 0,6 × 62 × 3 = 64,8 моль/л×с, ν = 0,6 × 2,42 × 1,2 = 4,15 моль/л×с. Результаты расчета показывают, что скорость реакции с течением времени уменьшается, так как вещества расходуются в процессе реакции.
С увеличением температуры в реакционной системе интенсивность теплового движения частиц реагентов, вступающих в реакцию, увеличивается. Поэтому растет и число столкновений между ними в единицу времени, в том числе и таких столкновений, которые благоприятны для протекания химической реакции. Отсюда следует, что с ростом температуры в реакционной среде скорость химической реакции всегда увеличивается. В простейшем виде увеличение скорости реакции в зависимости от температуры дается правилом Вант-Гоффа, которое он установил эмпирически. Это правило формулируется так: с ростом температуры на каждые 10 градусов скорость химической реакции увеличивается в 2 – 4 раза и записывается с помощью формулы (3.6):
где Как видно из уравнения (3.6), скорость реакции сильно изменяется в зависимости от температуры, так как эта зависимость является степенной.
Пример 3. Во сколько раз увеличится скорость реакции при повышении температуры от 40 до 70 ˚С, если температурный коэффициент равен 2? Решение Согласно правилу Вант-Гоффа:
отсюда
Следовательно, скорость реакции увеличится в 8 раз.
Более точно зависимость скорости реакции от температуры через зависимость константы скорости от температуры передает теория Аррениуса. Согласно этой теории, зависимость константы скорости химической реакции
где A и Ea – константы, не зависящие от температуры, а зависящие только от природы реагентов. Величина A называется предэкспоненциальным множителем или частотным фактором, а величина Ea – энергией активации химической реакции. Согласно Аррениусу, не все столкновения между частицами реагентов благоприятны образованию продуктов химической реакции. Для того чтобы между частицами реагентов произошла реакция, столкновения между ними, происходящие в результате теплового движения в реакционной системе, должны удовлетворять двум требованиям: энергетическому и пространственному. Энергетическое требование. Благоприятны для протекания реакции только те столкновения между частицами, суммарная энергия столкновения которых не меньше некоторого минимального значения Ea, называемого энергией активации, которое зависит лишь от природы частиц реагентов (атомы, молекулы, ионы). Удобно эту величину приводить не в расчете на одну из частиц реагентов, а на моль частиц, что имеет место в уравнении Аррениуса (3.7). Выполнение энергетического требования необходимо, но не достаточно. Нужно, чтобы выполнилось и пространственное требование. Пространственное требование. Среди всех столкновений между частицами реагентов, энергия столкновения которых не меньше, чем Ea, благоприятны лишь такие, при которых взаимодействующие частицы сталкиваются между собой реакционными центрами. В уравнении Аррениуса это требование учитывается величиной предэкспоненциального множителя A, который тоже зависит только от природы реагентов, в том числе и от их пространственного строения. Свое название «частотный фактор» этот множитель получил потому, что согласно кинетическому уравнению реакции первого порядка размерность величины A равна размерности константы скорости kC, то есть с – 1, что является размерностью частоты, в данном случае частоты столкновений. Величину энергии активации можно рассчитать с помощью уравнения (3.8), вытекающего из уравнения Аррениуса (3.7), если известны значения констант скоростей химических реакций для двух разных температур Т1 и Т2:
где R – универсальная газовая постоянная, равная 8,314 Дж/моль×К.
Рис. 3.1. Зависимость потенциальной энергии взаимодействия между веществами, участвующими в реакции, от координаты реакции
На рис. 3.1 изображена энергетическая схема протекания реакции, упрощенно записанной как А → В, где А – исходные вещества, В – продукты реакции. Здесь показана зависимость потенциальной энергии взаимодействия между веществами – участниками реакции – от координаты реакции. Исходные вещества и продукты соответствуют минимумам потенциальной энергии на графике. Вершина кривой отвечает так называемому переходному состоянию взаимодействующих реагентов, Пример 4. Рассчитайте энергию активации реакции, если константы скорости реакции при 273 и 283 К равны соответственно 4×10–5 и 8×10–5 c–1. Решение Из уравнения Аррениуса энергия активации равна:
Подставив данные, получим:
Влияние катализатора Катализаторами называются вещества, которые не входят в конечные продукты реакции, химически не изменяются и не расходуются, но изменяют скорость химических реакций. Катализаторы позволяют изменять скорость химической реакции, не изменяя температуру системы. Одни катализаторы сильно ускоряют реакции (положительный катализ), другие, напротив, замедляют реакции (отрицательный катализ). Различают гомогенный и гетерогенный катализы. При гомогенном катализе реагенты и катализатор находятся в одной фазе (жидкость или газ), при гетерогенном – в различных фазах (обычно катализатор твердый). Вне зависимости от вида катализа, реакции при участии катализатора протекают через образование промежуточного комплекса с катализатором, и роль катализатора в том, что образование этого комплекса приводит к снижению или повышению энергии активации. В результате, в силу экспоненциальной зависимости (3.7), скорость реакции резко возрастает или, напротив – убывает. Действие катализатора избирательно. Подбирая катализаторы, можно из одного и того же вещества получать совершенно различные продукты. Для каждой реакции имеется свой катализатор. Часто в качестве катализаторов применяют твердые вещества: платину, палладий, железо, натрий, калий; оксиды Al2O3, MnO2, Cr2O3; активированный уголь, силикагель и другие. Катализ имеет огромное значение в хозяйственной деятельности человека и в природе. Одни катализаторы направляют химический синтез веществ с заданными свойствами, другие (ингибиторы) – предотвращают нежелательные реакции разрушения деталей машин, зданий, сооружений и самых различных материалов. Область применения катализаторов в современных технологиях просто необозрима. Производство аммиака, азотной и серной кислот, формальдегида, этилена, ацетилена, спиртов, каучука и многих технически важных полимеров является каталитическими процессами. Крекинг и реформинг нефтепродуктов – многотоннажные каталитические процессы. Жизнедеятельность организмов любого уровня сложности сопровождается процессами ферментативного катализа. Ферменты – биологические катализаторы белковой природы, обладающие исключительно эффективным и селективным действием. Задачи 51 Реакция идет по уравнению A (Г) + 2 B (Г) ® C (Г). Как изменится скорость реакции, если давление увеличить в 3 раза и одновременно повысить температуру на 30 ˚С? Температурный коэффициент скорости реакции равен 3.
Ответ: увеличится в 729 раз. 52 Реакция протекает по уравнению 2 A (Г) + B (Г) ® 2 C (Г). Как изменится скорость реакции при уменьшении давления в системе в 2 раза и одновременном понижении температуры на 40 ˚С? Температурный коэффициент скорости равен 2. Ответ: уменьшится в 128 раз. 53 Скорость реакции возросла в 243 раза, температурный коэффициент равен 3. На сколько градусов была повышена температура? Ответ: на 50 ˚С. 54 Скорость реакции возросла в 100 раз. Температурный коэффициент равен 2,5. На сколько градусов была повышена температура? Ответ: на 50 ˚С. 55 При повышении температуры на 50 ˚С скорость реакции возросла в 32 раза. Вычислите температурный коэффициент скорости реакции. Ответ: γ = 2. 56 При понижении температуры на 45 ˚С реакция замедлилась в 35 раз. Определите температурный коэффициент скорости реакции. Ответ: γ = 2,2. 57 Реакция протекает по уравнению N2 + 3H2 Á 2NH3. Как изменится скорость реакции, если концентрацию азота увеличить в 4 раза, а концентрацию водорода – в 2 раза? Ответ: возрастет в 32 раза. 58 Реакция протекает по уравнению 2 A + B ® C. Начальные концентрации реагирующих веществ (моль/л): CA = 0,8, CB = 0,6. Как изменится скорость реакции, если концентрацию вещества В увеличить до 0,9, а вещества А до 1,2 моль/л? Ответ: возрастет в 3,4 раза. 59 Реакция протекает по уравнению 2 A + B ® C. Начальные концентрации реагирующих веществ (моль/л): CA = 2,5, CB = 8. Как изменится скорость реакции, если концентрацию вещества А уменьшить до 1,5, а вещества В до 4 моль/л? Ответ: уменьшится в 5,6 раза. 60 Разложение N2O протекает по уравнению 2N2O = 2N2 + O2. Константа скорости равна 5×10–4 л/моль×мин. По истечении некоторого времени концентрация N2O стала равной 3 моль/л. Сколько процентов N2O разложилось, если отношение конечной скорости к начальной равно 0,36? Какова начальная скорость реакции? Ответ: 40 %; 0,0125 моль/л×мин. 61 Омыление этилацетата описывается следующим уравнением CH3COOC2H5 + NaOH Á CH3COONa + C2H5OH. Начальная концентрация эфира 0,02 моль/л, щелочи 0,1 моль/л. По истечении некоторого времени прореагировало 75 % эфира, и скорость реакции стала равной 4,25×10–5 моль/л×мин. Вычислить начальную скорость реакции. Ответ: 2×10–4 моль/л×мин. 62 Реакция между веществами А и В выражается следующим уравнением 2 A + B ® C. Константа скорости равна 0,7 л2/моль2×мин. Начальная концентрация вещества В равна 0,6 моль/л. После того как прореагировало 40 % вещества А, его концентрация стала равной 0,3 моль/л. Найдите начальную скорость и скорость реакции в тот момент, когда прореагирует 40 % вещества А. Ответ: 0,105; 0,0315 моль/л×с. 63 Реакция между веществами А и В протекает по следующему уравнению 2 A + B ® C. Начальные концентрации реагирующих веществ (моль/л): CA = 6, CB = 5. Константа скорости реакции равна 0,5 л2/моль2×c. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в системе останется 45 % вещества В. Ответ: 90; 0,28 моль/л×c. 64–67 Константа скорости реакции при t1 ˚C равна k1, при t2 ˚C – k2. Энергия активации равна Ea, кДж/моль. Вычислить величины, обозначенные вопросом.
68–70 Рассчитайте, во сколько раз изменится константа скорости реакции при увеличении температуры от t1 ˚C до t2 ˚C, если энергия активации равна
71 Во сколько раз станет больше скорость прямой реакции по сравнению со скоростью обратной реакции в системе 2 A (Г) + 3 B (Г) Á 2 C (Г) при увеличении давления в 2 раза? Ответ: в 8 раз. 72 В системе 2 A + B ® C концентрацию А увеличили от 0,03 до 0,12 моль/л, а концентрацию В – от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость прямой реакции? Ответ: в 48 раз. 73 Реакция протекает по уравнению H2(Г) + I2(Г) Á 2HI(Г). Константа скорости реакции равна 0,16 моль/л. Начальные концентрации веществ были (моль/л): С Ответ: 3,2×10–4; 1,9×10–4 моль/л×c. 74 Реакция протекает по уравнению A + B ® C. Начальные концентрации веществ A = 0,1 моль/л, В = 0,1 моль/л. Через некоторое время концентрация вещества А стала равной 0,04 моль/л. Во сколько раз уменьшится скорость реакции? Ответ: в 6,25 раза. 75 Реакция идет по уравнению A + 2 B ® C. Константа скорости равна 0,4 л2/моль2с, а начальные концентрации (моль/л): CА = 0,3, CВ = 0,5. Вычислите скорость реакции в начальный момент и после того, как прореагирует 0,1 моль/л вещества А. Ответ: 0,03; 0,0072 моль/л×c. 76 Реакция протекает по уравнению 3H2 + N2 Á 2NH3. Скорость реакции увеличилась в первом случае в 216 раз в результате увеличения концентрации H2, а во втором в 256 раз в результате повышения давления. Во сколько раз были увеличены концентрация H2 и давление? Ответ: в 6 и 4 раза. 77 Реакция протекает по уравнению 2N2O = 2N2 + O2. Константа скорости реакции равна 5×10–4л/моль×мин. Начальная концентрация N2O равна 3,2 моль/л. Вычислите скорость реакции в начальный момент и в тот момент, когда разложится 25 % N2O. Ответ: 5,12×10–3; 28,8×10–4 моль/л×мин. 78 Реакция протекает по уравнению на A (Г) + 2 B (Г) ® C (Г). Как изменится скорость реакции при уменьшении давления в системе в 4 раза и одновременном понижении температуры на 20 ˚C? Температурный коэффициент скорости равен 3. Ответ: уменьшится в 576 раз. 79 Вычислите константу скорости реакции 2 A + B ® C, если при концентрациях А и В, равных соответственно 0,5 и 0,6 моль/л, ее скорость составляет 0,018 моль/л×мин. Ответ: 0,12 л2/моль2мин. 80 Реакция протекает по уравнению 2NO + O2 Á 2NO. Начальные концентрации веществ равны (моль/л); C
Ответ: увеличится в 8 раз.
4 ХИМИЧЕСКОЕ РАВНОВЕСИЕ
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 442; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |

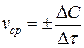 ,
,
 .
.
 – молярная концентрация вещества, по которому определяется скорость реакции; t – текущее время; n – число молей одного из веществ, участвующих в реакции; V – объем системы, в котором протекает гомогенная реакция. Для того чтобы скорость химической реакции всегда была больше нуля, знак «+» берется для продуктов реакции, знак «–» – для исходных реагентов. Не важно, по какому из веществ, продукту или исходному реагенту, определяется скорость реакции. Если же скорость реакции задана, то желательно указывать, по отношению к какому веществу она определена. Изменения количеств реагирующих веществ и продуктов реакции однозначно связаны между собой материальным балансом уравнения химической реакции. Определения, данные формулами (3.1) и (3.2), читаются так: скорость химической реакции есть изменение концентрации одного из веществ – участников реакции – в единицу времени.
– молярная концентрация вещества, по которому определяется скорость реакции; t – текущее время; n – число молей одного из веществ, участвующих в реакции; V – объем системы, в котором протекает гомогенная реакция. Для того чтобы скорость химической реакции всегда была больше нуля, знак «+» берется для продуктов реакции, знак «–» – для исходных реагентов. Не важно, по какому из веществ, продукту или исходному реагенту, определяется скорость реакции. Если же скорость реакции задана, то желательно указывать, по отношению к какому веществу она определена. Изменения количеств реагирующих веществ и продуктов реакции однозначно связаны между собой материальным балансом уравнения химической реакции. Определения, данные формулами (3.1) и (3.2), читаются так: скорость химической реакции есть изменение концентрации одного из веществ – участников реакции – в единицу времени. ,
,
 , если концентрации реагентов равны единице (1 моль/л). Для реакций, протекающих в газовой фазе, часто вместо концентраций реагентов пользуются их парциальными давлениями в системе, тогда уравнение (3.4) запишется как (3.5):
, если концентрации реагентов равны единице (1 моль/л). Для реакций, протекающих в газовой фазе, часто вместо концентраций реагентов пользуются их парциальными давлениями в системе, тогда уравнение (3.4) запишется как (3.5): ,
,



 .
.


 , частный случай
, частный случай  при
при  .
. , частный случай
, частный случай  при
при  при
при  .
. в. После уменьшения объема гомогенной системы в 3 раза концентрация каждого из реагирующих веществ увеличится в 3 раза:
в. После уменьшения объема гомогенной системы в 3 раза концентрация каждого из реагирующих веществ увеличится в 3 раза: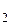 ] = 3 b,
] = 3 b,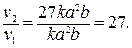
 ,
,
 и
и  – скорости химической реакции при температурах
– скорости химической реакции при температурах  и
и  соответственно; g – температурный коэффициент реакции, принимающий значения от 2 до 4 в зависимости от природы реагентов.
соответственно; g – температурный коэффициент реакции, принимающий значения от 2 до 4 в зависимости от природы реагентов. ,
, .
. от температуры Т дается уравнением (3.7), которое называется уравнением Аррениуса:
от температуры Т дается уравнением (3.7), которое называется уравнением Аррениуса: ,
,


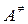 , или активированному комплексу. Величины энергий активации
, или активированному комплексу. Величины энергий активации  и
и  соответствуют протеканию прямой (вдоль координаты реакции) и обратной (против координаты реакции) реакций. Они указывают, какой минимальной энергией должны обладать взаимодействующие вещества для протекания этих реакций. На приведенной схеме прямая реакция экзотермична (
соответствуют протеканию прямой (вдоль координаты реакции) и обратной (против координаты реакции) реакций. Они указывают, какой минимальной энергией должны обладать взаимодействующие вещества для протекания этих реакций. На приведенной схеме прямая реакция экзотермична ( ), а обратная – эндотермична (
), а обратная – эндотермична ( ).
). .
.
 , кДж/моль
, кДж/моль

 = 0,04, С
= 0,04, С  = 0,05. Вычислите начальную скорость реакции и ее скорость, когда С
= 0,05. Вычислите начальную скорость реакции и ее скорость, когда С  = 0,03, C
= 0,03, C  = 0,05. Как изменится скорость реакции вследствие увеличения концентрации кислорода до 0,1, а оксида азота до 0,06 моль/л?
= 0,05. Как изменится скорость реакции вследствие увеличения концентрации кислорода до 0,1, а оксида азота до 0,06 моль/л?


